基于叶片显微结构分析2 个核桃品种耐冷胁迫研究
2021-12-14冯启科刘晓敏王红霞安秀红张志华
刘 凯,冯启科,刘晓敏,王红霞,安秀红,张志华
(1. 河北农业大学 园艺学院,河北 保定 071001;2. 河北省山区工程创新中心/国家北方山区农业工程技术研究中心,河北 保定 071001)
非生物胁迫可影响果树生长发育,是影响果树生存的重要因素之一[1]。其中冷害是影响植物生长发育的主要环境因子,是我国农林生产中的主要自然灾害[2]。轻度冷害胁迫会导致植物叶片、茎等形态指标以及生物量的变化,主要表现在外部的形态和内部生理代谢等方面,在外部表现为叶片萎蔫、黄化、枯死、结实率低等,在内部表现为细胞膜被破坏、叶绿素含量和结构被改变等,而严重冷害会引起植物新陈代谢紊乱甚至导致植株死亡[1,3-4]。因此,植物抗寒性研究是农业和植物领域研究的热点之一。
据研究,植物的组织结构与耐冷胁迫能力密切相关。叶片是植物主要器官,是进行光合作用和蒸腾作用的主要场所,它的形态结构与周围环境有着密切联系,具有可塑性,对环境变化反应明显,在不同的环境下会有不同的结构特征[5]。因此,可以通过植物叶片的显微结构来评判植物抗性强弱[6]。抗寒性强的植物具有上下表皮厚,叶肉细胞排列紧密,组织结构紧密度大,栅栏组织厚度大,栅海比值大来适应低温环境[7-8]。束际林等研究发现能抵御更恶劣的低温环境的植物叶肉组织发达,栅栏组织的厚度大,细胞排列紧密[9]。抗寒性强的菊花品种叶片和上表皮较厚,栅栏组织发达,叶肉细胞排列紧密,抗寒性差的品种则恰好相反[10];杏品种的抗寒性与叶片组织的紧密度成正相关,与疏松海绵组织厚度的指数成负相关[11];通过对比低温胁迫下大叶黄杨和小叶黄杨的叶片结构发现,栅海比高,组织细胞排列越紧密都有利于植物提高抗寒能力[12];曹红星等[13]解剖低温处理下椰树叶片的结构发现,低温胁迫时间越长,海绵组织和栅栏组织结构变得越不规则。
植物在长期进化过程中,通过改变自身的结构特点对一些生理生化活动进行调节,以适应胁迫环境,如叶形变小、叶片增厚、角质层厚、表皮毛多、叶肉组织紧密等结构特征均是植物抗性强的表现。在我国北方农业生产中存在的主要问题是倒春寒和晚霜等冷害,其影响远大于其他环境因素[14]。因核桃(Juglans regiaL.)其枝条含水量比较高且髓心大,所以冷害会影响其生长,甚至会影响核桃产量和经济效益[15-16]。本研究以‘清香’和‘辽宁8 号’叶片为试材,通过石蜡切片技术观察冷胁迫不同时间下核桃叶片显微结构,通过分析叶片表皮厚度、栅栏组织、栅海比、CTR、韧皮部、木质部等指标,了解冷胁迫对核桃叶片组织结构的影响,旨在为核桃耐冷胁迫品种选育及耐冷胁迫分子机制研究提供材料基础。
1 材料和方法
1.1 供试材料
试验材料位于河北农业大学标本园,2018 年盆栽播种,2019 年同一砧木嫁接‘辽宁8 号’和‘清香’。用于后续研究的试验材料分为正常组(0.5 ℃冷处理0 h)和0.5 ℃冷处理4、8、12、24、36、48 h。选取植株上部东南方向健康复叶上左起第3 枚小叶备用,3 次重复。
1.2 试验方法
切取大小一致的核桃叶片经过固定、脱水、透明、浸蜡后包埋在石蜡中,进行修块,YD-3 旋转式切片机进行切片,切出蜡带后粘附在载玻片上,烘干水分后用番红固绿进行染色,再接着进行封片,晾干后在H-2 显微镜(Olympus)下进行观察,并且测量数据,15 个重复,利用Mvlmage vt 进行数据整理。
1.3 数据处理
采用 Excel 2017 和 SPSS 20.0 软件进行方差和显著性分析。
2 结果与分析
2.1 核桃叶片的横切结构
‘辽宁8 号’和‘清香’叶片中(图1、2)海绵组织和栅栏组织分化明显,属于典型的异面叶,两者组织结构十分相似,包括表皮、叶肉和叶脉。表皮分为上表皮和下表皮,均由单层细胞组成,横切面呈扁圆形,排列紧密,表皮外壁有较厚的角质层,近上表皮为长柱状细胞组成的栅栏组织,近下表皮处为多层排列疏松的海绵组织细胞。

图1 ‘清香’核桃叶片结构(×40)Fig.1 Leaf structure of ‘Qingxiang’walnut (×40)
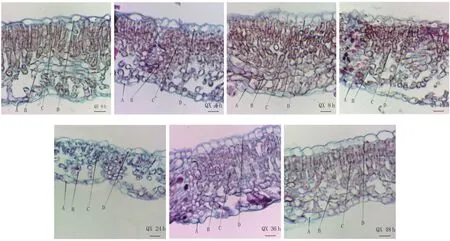
图2 ‘辽宁8 号’核桃叶片结构(×40)Fig.2 Leaf structure of ‘Liaoning No.8’ (×40)
2.2 冷胁迫对叶片厚度的影响
由图3 可知,冷胁迫0 h 的‘辽宁8 号’和‘清香’2 个品种叶片厚度有所差异,‘辽宁8 号’的叶片厚度为202.26 μm,‘清香’的叶片厚度为183.86 μm。2 个品种经过低温处理后,在胁迫24 h前叶片厚度均呈先上升后下降趋势,‘清香’在12 h 出现最大值,升高了1.35 倍。24 ~48 h‘清香’出现不规则变化。‘辽宁8 号’的叶片厚度在低温处理0 ~8 h 时有所升高,在8 h 处达到最大值,之后叶片厚度逐渐降低,且差异较显著,‘清香’的叶片厚度在处理12 h 时到达最大值后呈下降趋势,且差异显著。
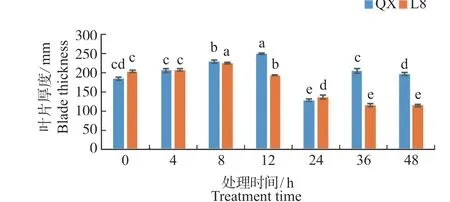
图 3 冷胁迫处理对核桃叶片厚度的影响Fig. 3 Effect of chilling treatment on leaf thickness in walnuts
2.3 冷胁迫处理对表皮厚度的影响
由图4 可知,冷胁迫0 h 时,‘清香’上表皮厚度为14.64 μm,‘辽宁8 号’为15.88 μm,‘清香’下表皮厚度为12.68 μm,‘辽宁8 号’为14.87 μm,2 个品种表皮厚度很接近,但‘辽宁8 号’表皮厚度大于‘清香’。在冷胁迫下,2 个品种表皮厚度变化趋势相同,‘清香’上表皮与下表皮均在冷胁迫处理12 h 时达到最大值,且变化显著,是0 h 的1.6 倍和1.26 倍;‘辽宁8 号’上表皮与下表皮均在冷胁迫处理12 h 时达到最大值,是0 h 的1.39倍。由此可知,低温胁迫会使叶片表皮厚度先增加后下降。

图 4 冷胁迫处理对核桃叶片表皮厚度的影响.Fig.4 Effect of cold treatment on epidermal thickness in walnuts.
2.4 冷胁迫处理对栅栏组织的影响
如图5 所示,冷胁迫0 h 时‘清香’栅栏组织厚度为81.70 μm,‘辽宁8 号’栅栏组织厚度为84.90 μm。发生冷胁迫后,0 ~24 h 2 个品种栅栏组织厚度均呈先上升后下降趋势,‘清香’在低温胁迫12 h 时达到最大值,是0 h 的1.14 倍;‘辽宁8 号’在低温胁迫8 h 时达到最大值,是0 h 的1.09 倍,且变化显著;在24 h 时最小,下降了31%。2 个品种栅栏组织变化趋势与叶片厚度变化趋势一致。
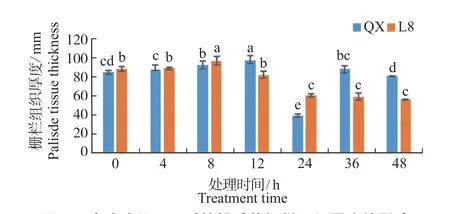
图 5 冷胁迫处理下对核桃叶片栅栏组织厚度的影响Fig.5 Effect of chilling treatment on palisade tissue thickness in walnuts
2.5 冷胁迫处理对海绵组织厚度的影响
如图6 所示,冷胁迫0 h 时‘清香’叶片海绵组织厚度为72.59 μm,‘辽宁8 号’叶片海绵组织厚度为54.53 μm。冷胁迫发生后,2 个品种均呈先上升后下降趋势,‘清香’在低温胁迫12 h 时达到最大值,‘辽宁8 号’在低温胁迫8 h 时达到最大值,且变化显著,与栅栏组织、叶片厚度变化趋势一致。

图 6 冷胁迫处理对核桃叶片海绵组织厚度的影响Fig.6 Influence of chilling treatment on tissue thickness of sponge in walnuts
2.6 不同低温处理对栅海比值的影响
栅海比在抗性分析中经常作为重要指标。由图7 所示,冷胁迫0 h‘清香’的栅海比低于‘辽宁8 号’,冷胁迫开始后2 个品种的栅海比均呈现先下降再上升的趋势,而且‘清香’的栅海比低于‘辽宁8 号’。‘清香’在冷胁迫24 h 时比值最低,下降至0 h 的54%。‘辽宁8 号’在冷胁迫8 ~12 h 时比值最低,下降至0 h 的61%。

图7 冷胁迫处理核桃叶片栅海比值的影响Fig.7 Influence of chilling treatment on the ratio of palisade tissue to spongy tissue in walnuts
2.7 不同低温处理对细胞结构疏松度(ST)的影响
细胞结构疏松度也经常作为抗性指标。如图8所示,冷胁迫后,‘清香’与‘辽宁8 号’的细胞结构疏松度均呈现先上升后下降的趋势,均在12 h达到最大值,是0 h 的1.52 倍和1.55 倍,‘清香’的ST 始终高于‘辽宁8 号’。
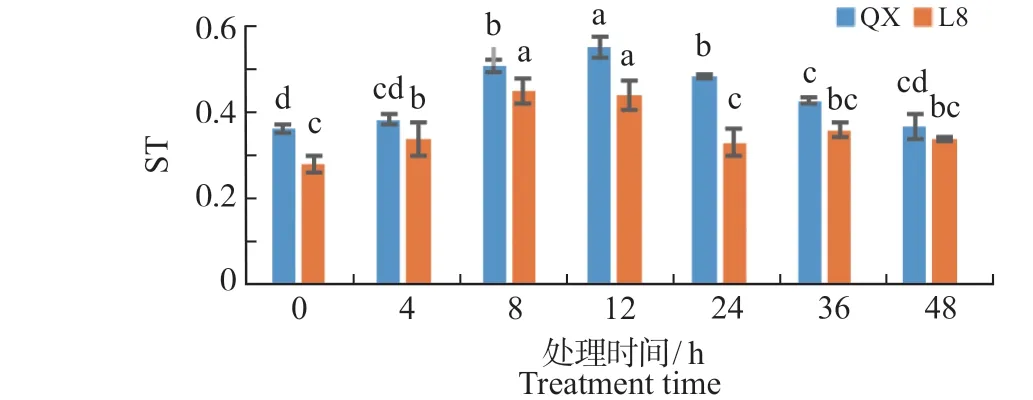
图8 冷胁迫处理对核桃叶片细胞结构紧疏松度(ST)的影响Fig.8 Effect of chilling treatment on ST in walnuts
2.8 不同低温处理对细胞结构紧密度(CTR)的影响
细胞结构紧密度也经常作为抗性指标。如图9所示,低温胁迫前后,‘清香’的CTR 均低于‘辽宁8 号’,且2 个品种在低温处理后叶片叶肉组织排列变得紧密,均呈现先下降后上升的趋势,‘清香’在冷胁迫24 h 出现最低值,下降至0 h 的72.80%;‘辽宁8 号’在12 h 出现最低值,下降至0 h 的76%。由此看出,‘辽宁8 号’能够提前对冷胁迫进行响应。
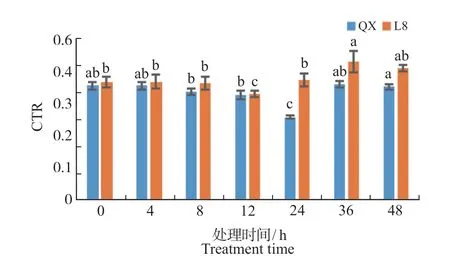
图9 冷胁迫处理对核桃叶片结构紧密度(CTR)的影响Fig.9 Effect of chilling treatment on CTR in walnuts
2.9 冷胁迫下核桃叶片组织变化相关性分析
利用SPSS 18.0 对冷胁迫下核桃叶片组织变化相关性分析(表1、2)。

表1 冷胁迫下‘清香’核桃叶片组织变化相关性分析Table 1 Correlation analysis of leaf tissue changes of ‘Qingxiang’ under chilling stress
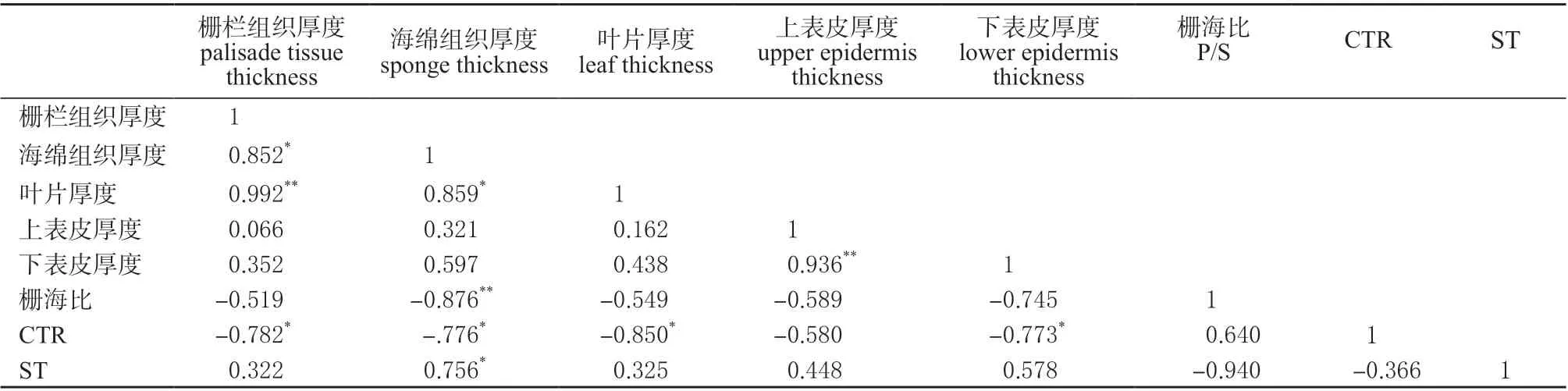
表2 冷胁迫下‘辽宁8 号’核桃叶片组织变化相关性分析Table 2 Correlation analysis of leaf tissue changes of ‘Liaoning NO.8’ under chilling stress
在冷胁迫下,‘清香’栅栏组织与叶片厚度呈极显著正相关,与CTR 呈显著相关;海绵组织厚度与叶片厚度呈显著正相关;下表皮厚度与栅海比呈显著负相关,与ST 呈显著正相关。在冷胁迫下,‘辽宁8 号’栅栏组织厚度与海绵组织厚度呈现显著相关,与叶片厚度呈现极显著正相关,与CTR 呈现显著负相关;海绵组织厚度与叶片厚度和ST 呈显著正相关,与栅海比呈极显著负相关,与CTR 呈显著负相关;叶片厚度与CTE 呈显著负相关;上表皮厚度与下表皮厚度呈极显著正相关;下表皮与CTR 呈显著负相关;ST 与栅海比呈极显著负相关。
3 讨论与结论
叶片植物暴露在环境中重要的器官,其中冷害是影响其生长发育最重要的生态因子[17]。叶片是进行光合作用和蒸腾作用的主要器官,叶片通过组织结构变化来响应环境变化[18]。因此叶片结构指标的变化常被用来作为植物抗寒鉴定的依据之一。
大量研究表明,观察叶片显微结构变化是反应植物响应非生物胁迫的重要方法。云琳颖等[17]采用石蜡制片法对5 种不同品种的核桃品种叶片结构进行分析,并筛选出抗性强的品种海绵组织厚度要小于抗性差的品种,并且栅栏组织也小于抗性差的品种。曹红星等[19]研究指出叶片受伤害情况与温度呈正相关。其中油棕叶片组织疏松度(SR)在不同低温处理下变化明显,可作为抗性的结构指标。马婷[20]等对12 个云南核桃品种叶片显微结构进行观察综合评价,认为叶片组织结构疏松度、海绵组织厚度是影响核桃抗寒性能的重要指标。于龙凤等[21]认为低温弱光处理使西葫芦表皮细胞厚度、栅栏组织厚度、叶片厚度、海绵组织减小。李琦瑶等[22]认为低温胁迫下,烤烟幼苗叶片组织结构紧密度降低,叶片组织结构疏松度增加,证明低温胁迫破坏了叶片的组织结构。在本研究中,通过分析冷胁迫不同时间下叶片表皮厚度、栅栏组织、栅海比、CTR 等结构,冷胁迫使叶片厚度先增加后降低;会使表皮厚度增加,细胞紧密度先下降后增加,细胞结构疏松度先增加后下降,均体现了冷胁迫对核桃叶片组织的破坏,与栅栏组织相比,海绵组织受到的迫害更为严重。以细胞结构疏松度和细胞紧密度为标准评价‘辽宁8 号’和‘清香’,‘辽宁8 号’的耐冷胁迫能力要强于‘清香’。
