2型糖尿病合并骨质疏松患者骨代谢标志物特点及分析
2021-12-13张婷婷周冬梅
张婷婷 周冬梅
随着人口老龄化的进展,2型糖尿病(type 2 diabetes mellitus,T2DM)和骨质疏松(osteoporosis,OP)的发生率不断提高,成为危害健康的重大公共卫生问题。糖尿病合并骨质疏松多由糖代谢性因素导致骨量减少,骨组织微结构改变,骨强度降低、脆性增加,是糖尿病在骨骼系统出现的慢性严重并发症之一[1]。疾病早期症状隐匿,多在轻微外力导致骨折后才被发现,是糖尿病致残率最高的疾病之一[2]。国际上常采用双能X线吸收检测仪(dual-energy X-ray absorptiometry,DXA)作为测定骨密度(bone mineral density,BMD)的金标准,但由于BMD检查存在滞后性,其对早期骨量减少的敏感度低,且仅能反映骨质量的变化,不能完全反映骨强度,也不能反映骨骼内有机成分的变化情况[3,4]。相比而言,骨代谢标志物(markers of bone metabolism,MBM)可反映早期骨代谢状态,其中反映骨代谢转化的指标称为骨转化标志物(biochemical bone turnover markers,BTMs)。
目前,关于糖尿病是否影响骨质疏松患者骨代谢指标仍存在争议,尚需进一步探讨。本研究旨在通过分析糖尿病合并骨质疏松患者的临床资料,比较糖尿病合并骨质疏松患者与单纯骨质疏松患者骨代谢标志物变化情况,探讨糖尿病合并骨质疏松患者骨代谢特点,分析其危险因素,为糖尿病合并骨质疏松患者的临床治疗提供新思路。
对象与方法
1.研究对象:选取2015年3月~2021年3月在徐州医科大学附属医院住院的骨质疏松患者66例作为研究对象,根据其是否患有T2DM分为糖尿病合并骨质疏松组30例(糖尿病组)和单纯骨质疏松组36例(非糖尿病组)。
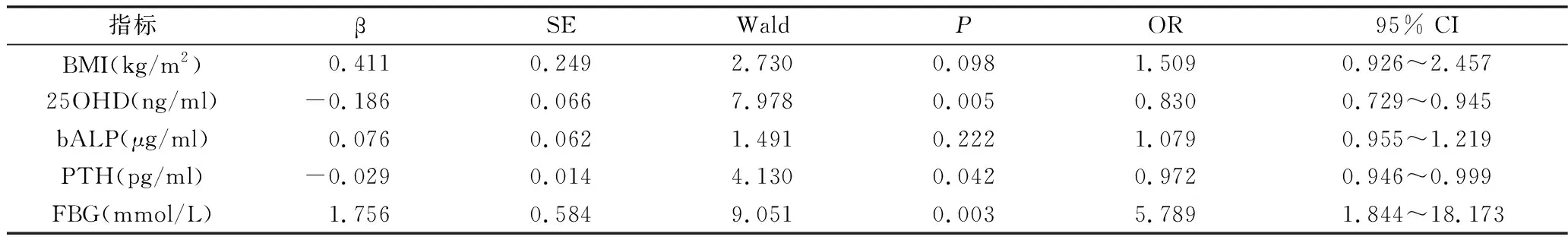
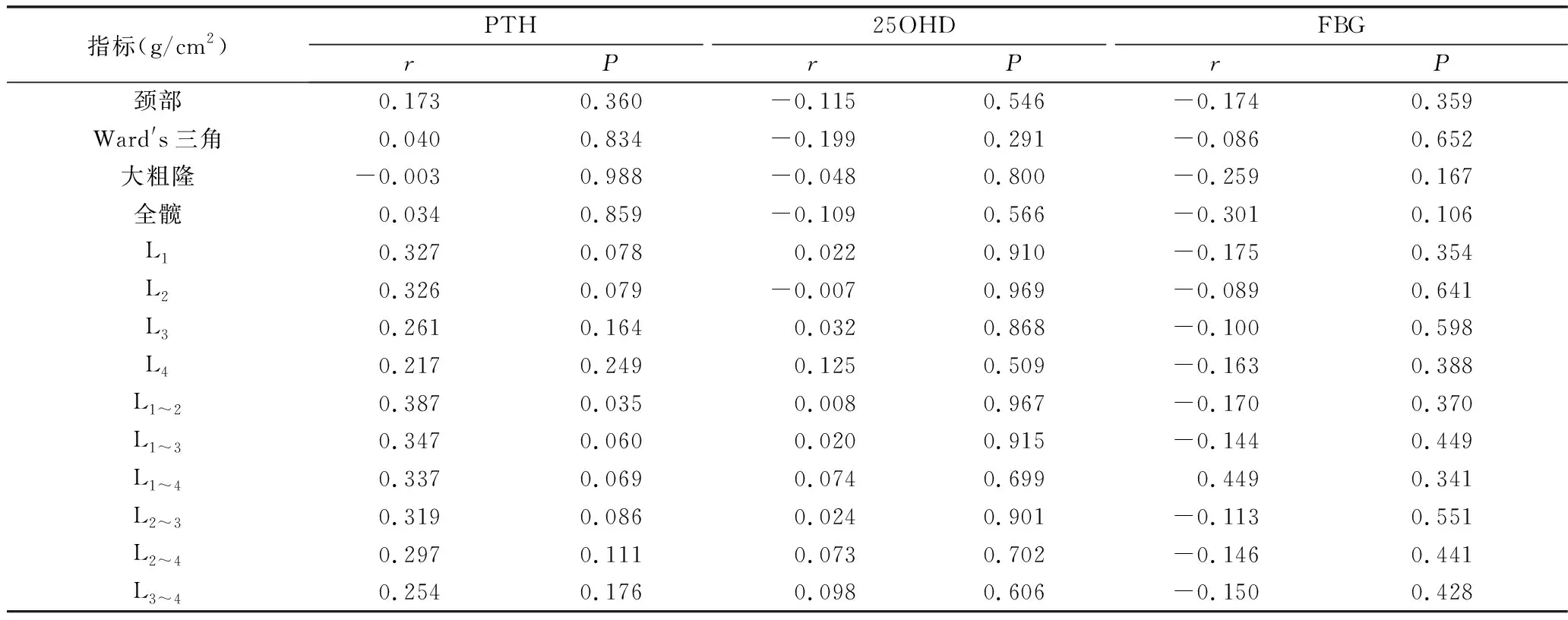
2.入组及排除标准:(1)入组标准:OP诊断标准符合1994年WHO推荐标准进行划分:T值>-1SD为骨量正常,-2.5SD 3.资料采集:记录患者的性别、年龄、身高、体重、收缩压(SBP)、舒张压(DBP)和既往病史,计算体重指数[BMI=体重(kg)/身高(m)2]。禁食8h后,于次日清晨抽取患者空腹肘静脉血,检测骨代谢标志物[甲状旁腺激素(PTH)、骨碱性磷酸酶(bALP)、Ⅰ型胶原氨基端延长肽(TP1NP)、β-胶原特殊序列(β-CTX)、骨钙素(OC)、25羟基维生素D(25OHD)]、空腹血糖(FBG)、尿酸(UA)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、碱性磷酸酶(ALP)、血钙(Ca)、血磷(P)、血镁(Mg)等相关指标。采用DXA检测所有患者腰椎(L1~4)、股骨颈、Ward′s三角、大粗隆、全髋的BMD值。本研究方案经由徐州医科大学附属医院医学伦理学委员会批准(批号:XYFY2021-KL123-01)。 1.两组患者一般情况及骨密度指标比较:本研究共纳入66例患者,根据患者是否合并2型糖尿病分为糖尿病组30例患者,非糖尿病组36例患者。除BMI之外,两组患者的一般情况及骨密度指标比较,差异均无统计学意义(P>0.05,表1),具有可比性。 2.两组实验室参数比较:两组患者ALP、TC、TG、HLD-C、LDL-C、UA、TP1NP、OC、β-CTX、比较,差异均无统计学意义(P>0.05)。与非糖尿病组比较,糖尿病组PTH、25OHD、Ca、Mg降低,bALP、BMI、FBG升高,差异均有统计学意义(P<0.05,表2)。 3.糖尿病合并骨质疏松患者危险因素的Logistic回归分析:以T2DM为因变量,以单因素分析结果显示差异有统计学意义的指标为自变量,拟纳入BMI、25OHD、bALP、PTH、FBG,进行Logistic回归分析。PTH、25OHD、FBG是糖尿病合并骨质疏松患者的独立危险因素,糖尿病组患者血糖更高,维生素D、PTH缺乏更严重(P<0.05,表3)。 表3 糖尿病合并骨质疏松危险因素的Logistic回归分析 4.糖尿病合并骨质疏松组各指标与骨密度之间的相关性:在糖尿病合并骨质疏松组中,分别以PTH、25OHD、FBG为因变量,以腰椎(L1~4)、股骨颈、Ward′s三角、大粗隆、全髋骨密度为自变量,Pearson相关分析结果显示,2型糖尿病合并骨质疏松患者的L1~2骨密度与甲状旁腺激素呈正相关(P<0.05,表4)。 表4 糖尿病合并骨质疏松组各指标与骨密度之间的相关性 随着我国社会经济发展和人口老龄化的进程,糖尿病在群体的发生率较前明显上升,相关研究表明,糖尿病患者更易并发骨质疏松,严重影响糖尿病患者的生活质量[5]。糖尿病合并骨质疏松发病机制较复杂,可能与胰岛素缺乏、长期高血糖状态、糖基化终末产物、骨微血管损伤、激素水平变化、慢性炎症及降糖药物使用等有关[6]。对T2DM患者而言,BMD增高、降低或者不变的结果国内外文献均有报道[7~10]。本研究发现,与非糖尿病组比较,除大粗隆外,各个部位骨密度均较糖尿病组略低,大粗隆较糖尿病组略高,但差异无统计学意义。 骨代谢标志物可大致分为骨代谢调控激素(维生素D及其代谢产物、PTH等)和骨转化标志物。骨转换标志物可分为骨形成标志物和骨吸收标志物,TP1NP是成骨细胞Ⅰ型原胶原聚合成Ⅰ型胶原过程中释放的副产物,而β-CTX则是Ⅰ型胶原分解代谢过程中的产物[3,11 ]。由于TP1NP、β-CTX特异性、稳定性较好,目前推荐其为首选的骨形成、骨吸收标志物。OC由成骨细胞分泌,除了能反映成骨细胞的活性外,更多的是反映骨转化水平的综合状态[12]。骨矿化过程中,ALP可通过水解磷脂释放无机磷,使局部磷浓度升高,利于骨形成,多用于评价骨形成指标,但因其在多个组织中存在,对骨组织敏感度和特异性差。与之相比,bALP具有较高的骨组织特异性,在骨代谢性疾病中使用更广泛[13]。 血清钙及磷反映体内钙离子与磷酸根离子的情况,二者受PTH、降钙素(CT)、维生素D的严密调控[14]。既往研究认为,T2DM患者的骨代谢异常是由于骨吸收更显著,骨转化率下降导致[15]。但在本研究中糖尿病与非糖尿病两组的TP1NP、OC、β-CTX比较,差异无统计学意义,提示当两组研究对象骨质疏松程度相仿时,糖尿病组患者其成骨状态及破骨状态较非糖尿病组患者比较,差异无统计学意义。与非糖尿病组比较,糖尿病组的Ca、Mg降低,这可能是T2DM患者机体存在全身性代谢紊乱,高血糖引起渗透性利尿,导致尿钙、磷、镁排泄增加,同时抑制肾小管对钙、磷、镁的重吸收,使机体处于负钙平衡[16,17]。 维生素D和PTH是重要的骨代谢调控激素。维生素D一方面可促进成骨细胞的合成和矿化,另一方面可抑制部分破骨细胞的活性。维生素D缺乏会导致骨质疏松,增加骨折的风险[18]。由于25OHD不受饮食和生理节律影响的特性,临床上常使用25OHD反映机体维生素D营养情况。国际上建议,25OHD低于20ng/ml判为维生素D缺乏,20~30ng/ml为维生素不足[4]。本研究中两组患者25OHD均低于该水平,与非糖尿病组比较,糖尿病组25OHD水平更低,差异有统计学意义。提示糖尿病组患者体内维生素D缺乏更严重,这与既往大量研究结果相符,考虑可能与糖代谢紊乱影响维生素D吸收相关,此外维生素D羟化需要镁,镁缺乏可导致维生素D吸收抵抗,本研究中可见糖尿病组患者Mg较非糖尿病组患者明显下降。同时,也有研究显示维生素D缺乏就是糖尿病合并骨质疏松的危险因素[19]。 PTH是由甲状旁腺主细胞合成和分泌的,PTH与维生素D相互作用,维持血钙水平的稳定性。既往研究认为,T2DM的高血糖引起的渗透性利尿促使钙、磷、镁排除体外,从而导致血液中的钙浓度降低,刺激PTH分泌增加,25OHD水平减低会引起继发性PTH升高,导致骨质疏松。但在本研究中,与非糖尿病组比较,糖尿病组的Ca、25OHD水平减低,但同时PTH水平也减低,这与当前研究存在很大的差异,提示对于骨质疏松程度相仿的两组研究对象,T2DM患者可能同时存在PTH缺乏。选取糖尿病组患者为研究对象,以PTH为因变量,以腰椎(L1~4)、股骨颈、Ward′s三角、大粗隆、全髋的骨密度为自变量,Pearson相关分析结果显示,PTH与L1-2骨密度呈正相关,提示T2DM随着PTH的减低,L1~2骨密度越低,骨折风险增加。本研究中女性患者(61例)明显多于男性患者(5例),且均为绝经后妇女,相关调查提示,腰椎是老年妇女骨质疏松性骨折好发部位,这与本研究结果一致[20]。英国骨质疏松防治指南指出,对于绝经后女性,甲状旁腺素类似物(parathyroid hormone analogue,PTHa)建议用于骨折风险极高患者,特别是椎体骨折高风险患者[21]。由此,对于糖尿病合并骨质疏松患者,PTHa补充替代治疗不失为一种很好的治疗方法。 PTHa是目前临床上促进骨形成的代表性药物,通过刺激成骨细胞活性,促进骨形成,改善骨质量,同时可降低椎体和非椎体骨折的发生风险。本研究中糖尿病组患者PTH较非糖尿病组患者明显降低,差异有统计学意义。同时,Pearson相关结果提示,T2DM患者PTH与L1~2骨密度呈正相关,提示对于糖尿病合并骨质疏松患者,或许可在常规治疗的基础上,加用PTHa补充替代治疗,以减少腰椎骨折风险。 综上所述,25OHD、PTH、FBG是糖尿病合并骨质疏松患者的独立危险因素。因此,对于糖尿病患者,一方面需要积极控制血糖,减缓骨量的丢失,另一方面需提供更为积极的替代或维持方案补充维生素D。最后,可在结合患者经济情况的前提下,使用PTHa补充治疗。 本研究存在一定的局限性,首先本研究系回顾性研究,纳入研究的患者人数较少,且没有控制不同降糖方案等其他混杂因素,另外,本研究中的研究对象缺少糖化血红蛋白的检测。目前关于PTHa的研究较少,后期需要开展大样本量、多中心的研究,为2型糖尿病合并骨质疏松患者的治疗提供新思路。
结 果

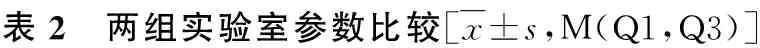
讨 论
