油酸对非酒精性脂肪肝细胞活性氧、周期及凋亡的影响
2021-12-13李建华黄登亮田美媛张耀刚马艳艳
李建华 侯 静 黄登亮 田美媛 张耀刚 刘 哲 马艳艳
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种引起肝脏脂肪沉积的疾病,发生于男性饮酒量<30g/d,女性饮酒量<20g/d的人群[1]。根据病理诊断,NAFLD可分为单纯性脂肪变性和脂肪性肝炎。进展型非酒精性脂肪肝,即非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),可导致肝硬化和肝细胞癌[2]。随着社会经济水平的提高,不良生活方式和饮食习惯使得NASH的发生率显著提高。NASH影响世界25%人口,已经成为世界重大公共卫生问题,预计在2016~2030年期间,与NASH相关的病死率将增长1倍[3, 4]。研究发现,部分NASH患者发展成肝硬化,其风险远高于单纯性脂肪肝[5]。
目前,甘油三酯(triglyceride, TG)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)是临床上评价肝功能的常用指标,NASH引起TG、AST、ALT升高,同时研究也发现血浆高浓度TG可以引起脂肪变性[6,7]。饱和脂肪酸到单不饱和脂肪酸比率影响细胞的生长和分化,这一比率的改变可造成肝功能紊乱、小肠炎症等疾病[8]。油酸属于单不饱和脂肪酸,是人类饮食中最丰富的脂质形式之一,与其他脂肪酸比较,其在循环中的含量相对较高,常被用来建造非酒精性脂肪肝模型[9~12]。目前NASH的研究主要集中肝细胞的氧化应激反应及凋亡,很少有研究报道在NASH肝细胞中油酸代谢产生的活性氧(ROS)是如何影响细胞周期及凋亡。
细胞模型常被用于研究脂肪变性,研究常采用HepG2及L02细胞系, AML-12是正常小鼠肝脏细胞,本研究通过油酸处理AML-12细胞建立NASH细胞模型,观察细胞脂肪变性,分析ROS、周期及细胞损伤变化,为NASH的发病机制及预防提供理论基础[10~12]。
材料与方法
1.材料:小鼠AML-12细胞株购自上海通派生物科技有限公司。油酸(货号:01008)、油红O(货号:00625)、DMSO(货号:34943)购自美国Sigma公司;DMEM(货号:2230805)购自美国Gibco公司;ROS检测试剂盒(货号:S0033M)购自上海碧云天生物技术有限公司;Annexin V-PI凋亡试剂盒(货号:556547)购自美国BD公司;TG(货号:A110-1-1)、AST(货号:C010-2-1)、ALT(货号:C009-2-1)试剂盒购自南京建成生物工程研究所;EdU细胞增殖检测试剂盒(货号:RN:R11053.9)购自广州瑞博生物科技有限公司。
2.细胞培养及处理:小鼠肝细胞系AML-12用含10%胎牛血清的DMEM培养基在37℃、5%CO2培养箱培养。含有10ml DMEM的100mm培养皿中接种细胞1×106个,细胞贴壁4h后,加入60μg/ml油酸,分别在第24、48、72h测定细胞上清液TG、ALT、AST含量,同时收集细胞进行凋亡和周期检测。在含有2ml DMEM的6孔板中接种2×105个细胞,贴壁4h后,加入60μg/ml油酸,72h后进行油红O、EdU染色。
3.TG、AST、ALT测定:分别收集24、48、72h细胞培养上清液,按照南京建成TG、AST、ALT检测试剂盒操作说明书进行检测。(1)TG检测原理:TG在脂肪酶的作用下生成甘油及脂肪酸,甘油及ATP在甘油激酶的作用下生成甘油-3-磷酸和ADP,甘油-3-磷酸在3-磷酸甘油氧化酶的作用下生成磷酸羟基丙酮和H2O2,H2O2和4-AAP及对氯酚在过氧化物酶的作用下生成红色醌化物。通过510nm波长检测,查标准曲线,求酶活力单位。(2)AST检测原理:AST能使α-酮戊二酸和天门冬氨酸移换氨基和酮基,生成谷氨酸和草酰乙酸。草酰乙酸在反应过程中可自行脱羧成丙酮酸。丙酮酸与2,4-二硝基苯肼反应生成2,4-二硝基苯腙,在碱性溶液中显红棕色。通过510nm波长检测,查标准曲线,求酶活力单位。(3)ALT检测原理:ALT在37℃及pH7.4条件下,作用于丙氨酸及α-酮戊二酸组成的底物,生成丙酮酸及谷氨酸。反应30min后加入2,4-二硝基苯肼盐酸溶液,即中止反应,同时2,4-二硝基苯肼与酮酸中羰基加成,生成丙酮酸苯腙。苯腙在碱性条件下呈红棕色,通过510nm波长检测,查标准曲线,求酶活力单位。
4.油红O染色观察脂滴形成:称取油红O粉末溶于异丙醇中,配制成5mg/ml储存液,避光密封保存。油红O储存液∶双蒸水=3∶2稀释成工作液,用定性滤纸过滤,室温放置10min,现配现用。吸取弃掉6孔板中的培养基,用2ml PBS漂洗1遍,加10%中性甲醛固定30min,弃掉甲醛,加入2ml油红O工作液,染色10min。弃掉油红O,加入2ml PBS洗1遍,弃掉PBS,加入60%异丙醇脱色,弃掉脱色液,加入2ml PBS在显微成像仪下观察脂滴形成情况。
5.EdU染色观察:EdU染色按照锐博EdU细胞增殖检测使用说明书进行操作,之后用Cytation5 细胞显微成像仪观察,并用仪器自带软件进行统计分析。
6.ROS流式检测:每支流式管中加入1×106个细胞,同时加入10μmol/L的ROS检测荧光探针,37oC避光孵育20min,加1ml PBS重悬细胞,450×g离心5min,倒掉上清,加入400μl PBS重悬上机。
7.细胞周期流式检测:每支流式管中加入1×106个细胞,加入1ml 70%乙醇,涡旋混匀,4oC固定30min,450×g离心5min倒掉上清,加1ml PBS重悬细胞,450×g离心5min倒掉上清,加100μl PBS,再加入1μl RNase A(10mg/ml)和5μl PI,涡旋混匀,避光孵育15min,加1ml PBS重悬细胞,450×g离心5min,倒掉上清,加入400μl PBS重悬上机。
8.细胞凋亡流式检测:每支流式管中加入1×106个细胞,加入PI和Annix V各5μl,涡旋混匀,避光孵育15min,加入400μl Binding buffer 染色缓冲液,涡旋混匀上机。

结 果
1.TG、ALT、AST测定:在24、48及72h分别检测细胞培养上清液TG、ALT、AST含量,发现处理组TG含量在24、48及72h比对照组高,差异有统计学意义(P<0.05),24、48h 时ALT、AST比较,差异无统计学意义(P>0.05),72h时ALT、AST比对照组高,差异有统计学意义(P<0.05,图1)。

图1 细胞培养上清液TG、ALT、AST柱状图A.TG;B.ALT;C.AST
2.油红O染色脂滴形成情况:72h后,油红染色结果发现60μg/ml油酸处理后,细胞质内可见橘红色脂滴形成,印戒形脂滴形成明显(图2中A、B),经统计分析发现处理组油O平均吸光度比对照组高,差异有统计学意义(P<0.05,图2C),说明油酸处理后形成了脂肪变性现象。

图2 72h脂滴显微成像及统计图A.处理组油红O染色图(×20);B.对照组油红O染色图(×20);C.柱状图;D.处理组油红O染色图(×4); E.对照组油红O染色图(×4)
3.EdU染色结果分析:72h后,EdU染色结果显示处理组比对照组阳性高,差异有统计学意义(P<0.05),因此60μg/ml油酸处理后进入S期细胞增多(图3)。
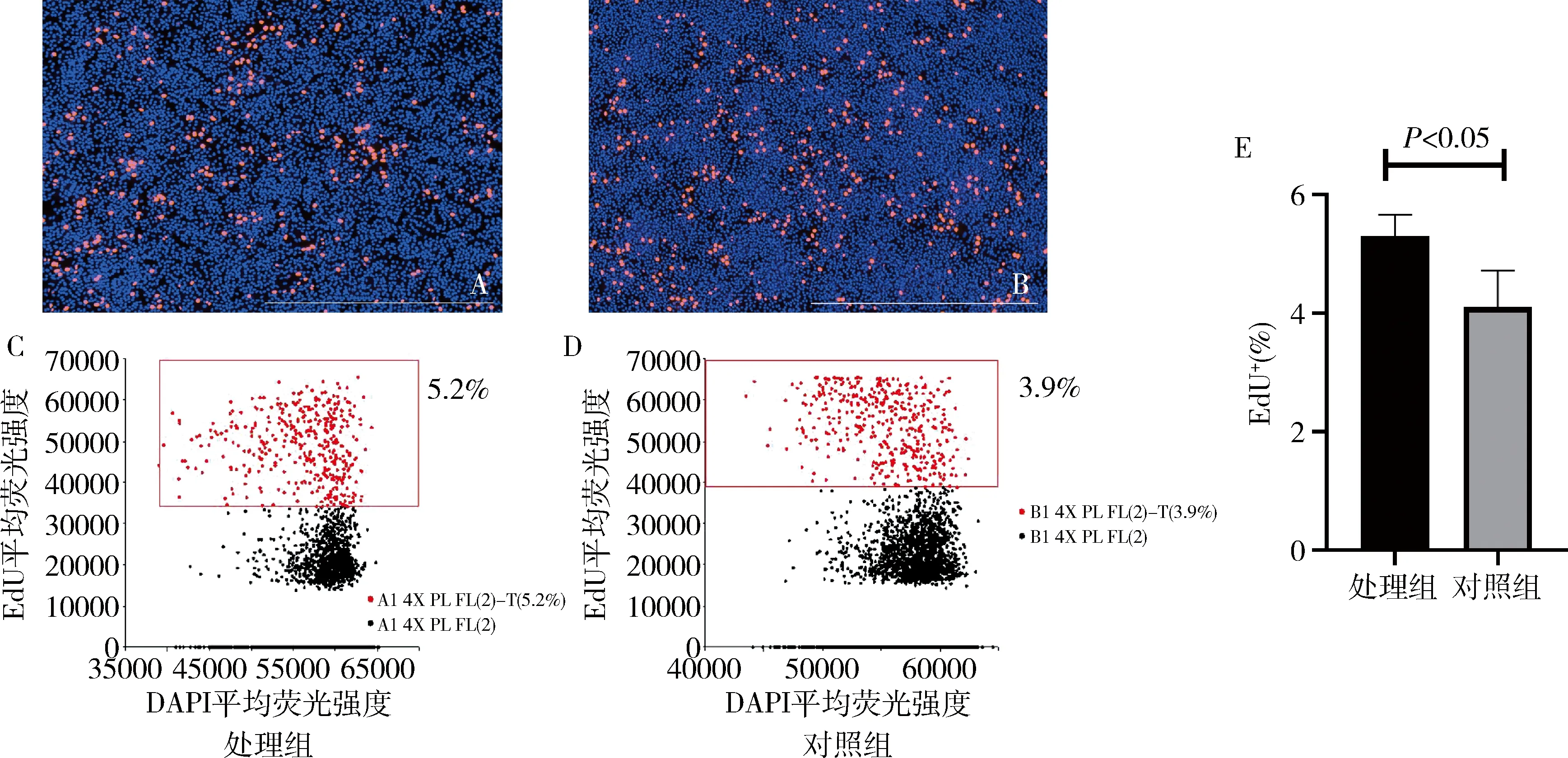
图3 72hEdU染色成像散点图及柱状图(EdU染色,×4)A.处理组成像图;B.对照组成像图;C.处理组散点图;D.对照组散点图;E.柱状图
4.流式ROS结果分析:油酸处理细胞72h后,经过流式检测分析发现,处理组与对照组比较,ROS明显升高,差异有统计学意义(P=0.000,图4)。

图4 细胞ROS流式单参数直方及柱状图A.处理组;B.对照组;C.柱状图
5.流式周期结果分析:油酸处理细胞72h后,经过流式检测分析发现,处理组与对照组相比G0/G1期细胞降低,差异有统计学意义(P<0.01),S期细胞数量增多,差异有统计学意义(P<0.05),G2/M期没有变化,差异无统计学意义(P>0.05,图5)。

图5 流式细胞周期分析图A.处理组;B.对照组;C.统计图
6.流式凋亡结果分析:油酸处理细胞72h后,经过流式检测分析发现,处理组细胞凋亡比对照组高,差异有统计学意义(P=0.000),处理组坏死比对照组高,差异有统计学意义(P<0.01,图6)。

图6 细胞凋亡及坏死散点图及柱状图A.处理组;B.对照组;C.柱状图
讨 论
NASH是肝功能不全最常见的原因之一,肝细胞脂质沉积过多是其主要特征之一,主要由高脂饮食引起。长期高脂饮食可以增加血液中的游离脂肪酸(FFA)水平,增强外周脂肪组织的脂肪分解,导致甘油三酯及游离脂肪酸在肝脏中的积累。脂质的过氧化、线粒体功能紊乱、炎症都可能最终导致肝细胞损伤和肝纤维化,研究也发现游离脂肪酸可降低肝细胞的存活率并诱导细胞凋亡,同时NASH患者8-羟基-脱氧鸟苷可引起DNA的氧化损伤,油酸属于游离脂肪酸在诱导非酒精性脂肪肝发生、发展过程中起了一定作用[13,14]。
潘雪丰等[12]研究发现60μg/ml油酸处理L02细胞24、48及72h后,形成橘红色脂滴较明显,本研究通过60μg/ml油酸处理AML-12细胞24、48h后发现,TG升高,ALT及AST并没有升高,因此24、48h只是造成脂滴形成,脂肪变性,但并未造成肝细胞实质性损伤,72h后TG、AST、ALT比对照组升高,说明72h后造成了肝细胞实质性损伤。因此,非酒精性脂肪肝造成的损伤是长时间脂代谢障碍引起的,可导致肝脏甘油三酯的异常积累及线粒体功能紊乱。线粒体功能紊乱主要表现在线粒体β氧化和过氧化物酶体β氧化,线粒体β氧化异常可引起脂肪酸在肝细胞基质中堆积,当肝细胞中蓄积大量脂肪酸,过氧化物酶体可对中长链脂肪酸进行氧化,产生大量ROS及细胞因子,造成肝细胞损伤及肝脏纤维化[15]。本研究也发现经过60μg/ml油酸处理72h后ROS含量明显升高,这可能是造成本实验中肝细胞损伤的主要原因。丙二醛是脂质过氧化的一个产物,能与DNA等新核性生物大分子发生反应,从而使细胞的结构和功能造成损伤[16]。本研究发现,经过60μg/ml油酸处理72h之后,S期细胞增多,G0/G1降低,G2/M期细胞不变,通过EdU染色结果也发现通过油酸处理后,进入S期的细胞增多,说明油酸参与细胞代谢后产生的ROS可能使细胞阻滞在S期,造成肝细胞的凋亡和坏死,而且流式结果也发现在72h之后,处理组凋亡和坏死细胞增多,这一现象可能与脂质的过氧化产物与DNA等生物大分子发生反应相关。
综上所述,在非酒精性脂肪肝细胞模型中,油酸代谢产生的ROS可能使细胞阻滞在S期,同时加快细胞凋亡和坏死,而且也有研究发现人肝癌细胞HepG2中油酸的氧化产物环氧硬脂酸能够诱导HepG2细胞周期阻滞于G0/G1期,同时引起细胞凋亡[17]。除此之外,用油酸处理牛骨骼肌卫星细胞后G0/G1期细胞降低,S期细胞升高,使细胞阻滞在S期,同时上调细胞脂代谢相关基因表达[18]。这也表明不同的疾病模式,油酸对细胞周期的影响机制可能不同,具体机制有待于进一步研究。
