自发缓解的滤泡性细支气管炎伴非特异性间质性肺炎1例报道并文献复习
2021-12-13王飞,朱翔,贺蓓,朱红,沈宁△
王 飞,朱 翔,贺 蓓,朱 红,沈 宁△
(北京大学第三医院 1.呼吸与危重医学科;2.病理科,北京 100191)
滤泡性细支气管炎(folliculor bronchiolitis,FB)是一种病理学诊断,主要累及细支气管,由局限于细支气管周围区域的淋巴滤泡增生所致[1]。大多数FB与免疫功能障碍或慢性气道炎性疾病有关[2],由于其诊断主要依靠肺组织病理学检查,因此FB的相关报告较少。此外,FB的治疗和预后各不相同,仍存在一定争议。为了进一步加深对该疾病的认识,现将北京大学第三医院经病理证实的1例自发缓解的FB报告如下,并进行文献复习。
1 病例报告
患者为41岁的女性,主因“间断咳嗽1年”入院。入院1年前患者出现咳嗽、咳黄绿痰,无发热、呼吸困难,行胸部CT发现双肺多发结节影(图1),当地医院给予口服抗生素治疗(具体不详);入院前4个月,患者开始出现口、眼干燥,视物模糊,双手指间关节痛,双下肢肌肉疼痛、无力及体质量下降;入院2个月前复查胸部CT结节影较前有所增多(图2)。既往5年前因间断喘息发作,外院诊断为“支气管哮喘”,当地医院使用激素治疗后可好转,平时未规律用药。患者对花粉过敏,否认粉尘、放射线接触史,无动物饲养史,无特殊药物服用史。
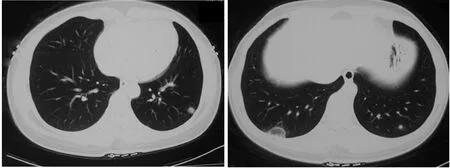
图1 肺CT可见双肺多发实性和磨玻璃结节,部分结节可见反晕征Figure 1 Chest CT showed multiple ground-glass opacities and solid nodules scattered in the bilateral lung fields with the reversed halo sign

图2 肺CT可见结节较前增多,部分结节仍可见反晕征Figure 2 Chest CT images showed that the number of opacities increased compared with a CT scan performed 2 months previously and the reversed halo sign could still be seen
体格检查:体温36.5 ℃,脉搏76次/min,呼吸16次/min,血压110/50 mmHg。皮肤黏膜未见皮疹、紫癜,口唇无紫绀;双肺呼吸音清,未及干湿啰音或胸膜摩擦音;心腹查体未见阳性体征;双手无畸形,关节无红肿、压痛;双下肢无水肿。
实验室检查:肿瘤标志物(鳞状上皮细胞癌抗原、神经元特异性烯醇化酶、癌胚抗原、骨胶素Cyfra21-1、胃泌素释放前肽、糖类抗原19-9和糖类抗原CA125)正常,抗核抗体为均质斑点型1 ∶80,类风湿因子、抗双链DNA抗体、抗Sm抗体、抗干燥综合征(SSA/SSB)抗体、抗核糖核蛋白(ribonucleoprotein,RNP)抗体、抗Jo-1抗体、抗SCL-70抗体、抗核糖体RNA(ribosomal RNA,rRNA)抗体和抗中性粒细胞胞浆抗体均为阴性,血IgG水平正常,血真菌β-1.3-D葡萄糖和曲霉半乳甘露聚糖抗原阴性,痰细菌和真菌培养以及痰涂片抗酸染色检查均为阴性。
肺功能检查:第1秒用力呼气容积(forced expiratory volume in one second,FEV1)占用力肺活量(forced vital capacity,FVC)的比值(FEV1/FVC)为86%,FEV1占预计值的百分比(FEV1%)为95%,肺总量(total lung capacity,TLC)占预计值的百分比(TLC%)为87%,一氧化碳弥散量(diffusing capacity of carbon monoxide,DLCO)占预计值的百分比为93%。
气管镜下所见气道大致正常,刷检未见结核菌、真菌以及肿瘤细胞。唾液流率稍减低,唇腺活检未见明显异常。入院后患者复查胸部CT显示胸膜下结节较前密度减低,范围缩小(图3)。为明确病变性质,进行胸腔镜下肺活检,组织病理提示细支气管壁及血管壁周围可见多灶性淋巴细胞增生、浸润,伴淋巴滤泡形成,免疫组织化学染色后可见由CD20阳性B细胞组成的B细胞区,包括生发中心,符合FB;肺泡间隔增厚,有炎症细胞浸润,符合非特异性间质性肺炎(non-specific interstitial pneumonia,NSIP)(图4)。

图3 肺CT可见结节影密度减低变小,反晕征消失Figure 3 Chest CT performed on admission showed that the opacities were smaller and thinner than previously,and the reversed halo sign had disappeared

A,HE ×4;B,HE ×20.图4 细支气管壁及血管壁周围淋巴滤泡形成,肺泡间隔增厚,有炎症细胞浸润Figure 4 Histopathology showed that hyperplastic lymphoid follicles with reactive germinal centers were found along narrowed bronchioles and peribronchiolar interstitium;A thickened alveolar septum with lymphocyte infiltration could also be seen outside the bronchial vascular bundles
考虑到患者肺部阴影较前缩小,未予特殊治疗。定期电话随访发现,患者眼睛、关节、肌肉的症状持续存在,但程度无明显加重。出院7个月后,复查胸部CT提示肺部阴影较前明显吸收,原病变部位只留下纤维索条(图5)。随访7年,患者临床症状仍持续存在,但多次复查血清自身免疫相关指标始终阴性。

图5 肺CT可见结节较前明显吸收,仅遗留少许索条Figure 5 Chest CT showed only some fibrous cables remained in the right lower lobe of the lung
2 文献复习和讨论
以“滤泡性细支气管炎”为关键词在万方数据库中进行检索,以“follicular brochiolitis”为关键词检索PubMed和Ovid数据库,检索时间设置为2000年1月1日至2018年12月31日。共检索到具有明确病理诊断、治疗经过和临床转归的完整文献18篇,包括51例成人患者,其中英文文献15篇,中文文献3篇。
51例成人FB中,18例未找到明确病因,考虑为特发性,其余33例为继发性。在继发性FB中病因以自身免疫性疾病最为常见,包括结缔组织病(connective tissue disease,CTD)和血管炎,我国报道的11例FB患者中有5例病因考虑为CTD,其中4例干燥综合征[3-5];此外,可导致FB的病因还有慢性感染性疾病,如人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染、结核或非结核分支杆菌感染、细菌性肺脓肿、哮喘、支气管扩张、原发性纤毛不动综合征或囊性纤维化等。
文献报告的绝大多数继发性和特发性FB患者(41例,80.4%)均单独使用糖皮质激素或联合免疫抑制剂治疗[1,4-15],另有部分患者(6例,11.8%)针对原发疾病使用抗感染治疗[16-18],小部分患者(5例,9.8%)未用药物治疗[1,3,5-6]。最长随访期限为107个月,未经药物治疗的5例患者中2例为特发性FB,其中之一死于转移性黑色素瘤[6];1例经4年随访发现肺部影像无明显变化[6];1例继发于HIV感染,3个月后症状和影像加重[1];1例继发于干燥综合征,随访4年肺部阴影略有增加[3];另1例继发于Castlemans 病,随访15个月影像较前加重[5]。
FB是一种淋巴组织增生性肺疾病,属于良性病变范畴,其特征是细支气管周围伴有生发中心的淋巴滤泡增生。由于淋巴滤泡主要位于细支气管和肺动脉之间,因此,经常可见细支气管腔受到压迫,从而导致相应的肺部影像表现。FB胸部CT的主要影像学特点为双肺弥漫分布的小结节,多为直径1~3 mm的小叶中心性结节,可伴随细支气管周围结节或树芽征[19],也可表现为磨玻璃影和网状影,多位于细支气管血管周围;部分患者可有囊状影、支气管扩张、支气管壁增厚及肺气肿,偶有小叶间隔增厚及支气管血管周围实变等[4]。本例患者的胸部CT表现为双侧胸膜下多发的实性和磨玻璃结节,该影像特点并非FB的典型表现,可能与该患者肺部的病理改变并不单纯是FB,而是同时合并了NSIP有关。此外,部分磨玻璃结节在发病初期可见反晕征,反晕征在FB影像中并不多见,常见于机化性肺炎(organizing pneumonia,OP)(隐源性或继发性)和真菌感染,亦可见于活动性肺结核、肺部恶性肿瘤以及结节病、肺栓塞、血管炎肺累及等非感染性疾病[20]。从患者的整体临床演变过程和影像变化特点(逐渐吸收减少),结合血清生物标记物,分析本例患者影像中表现出的反晕征提示OP可能性大。然而,因患者来我院就医时,其反晕征已经不明显,因此,这可能是活检病理未见OP表现的原因。
FB的病因和发病机制尚未完全清楚,临床上通常根据有无基础疾病,将FB分为特发性和继发性,其中继发性FB更为多见,往往与许多全身和肺部疾病相关,包括CTD(如类风湿性关节炎和干燥综合征[3-5,9,12,21]、肉芽肿性血管炎[6,22]、获得性免疫缺陷综合征[1,7-8])、超敏性疾病(如嗜酸性粒细胞增多症[11])和慢性气道炎症(如支气管扩张、囊性纤维化和哮喘[10-11])等。研究发现,CTD相关的肺部病变可同时合并多种病理类型,如FB和NSIP、FB和寻常型间质性肺炎(usual interstitial pueumonia,UIP)、NSIP和OP等,其中,类风湿关节炎相关的肺部病变以FB和NSIP的组合最为多见[21]。本例患者临床表现高度可疑CTD,但血清学检测均阴性,诊断CTD的证据不足。历经7年的随访,患者关节肌肉疼痛的症状并无缓解,但血清学指标始终阴性,最终诊断为特发性FB。目前,该病例仍在随访中。
关于FB的治疗和预后仍然存在争议。文献报告大多数FB患者使用糖皮质激素和免疫抑制剂治疗,部分患者的临床症状和肺部影像可以得到改善,但仍有部分患者使用糖皮质激素或免疫抑制剂治疗无效或随激素减量肺部影像复发[1,4-15]。目前文献报告的病例最长随访至107个月[6],因此,FB的远期预后并不清楚,但未见直接死于FB的病例报告。既往报道的5例未使用药物治疗的患者,1例死于其他疾病,3例肺部影像提示病变加重,1例无明显变化[1,3,5-6]。而本例患者未经治疗肺部阴影自行吸收,并且随访7年间,肺部阴影始终没有复发,提示FB有自发缓解的可能,以往未见类似报告。有学者提出FB患者的预后可能取决于两个因素:出现时的年龄和潜在的原发疾病,诊断为特发性FB的中老年患者预后最为理想,而30岁以下具有潜在免疫缺陷的患者则倾向于发展为进展性疾病[23-24]。
FB是一种少见疾病,其治疗和预后目前还存在争议,我们希望通过本例患者的报告和分析,可以为临床诊断和治疗提供更多参考。
