不同转流标准对颈动脉内膜切除术后脑梗死的影响
2021-12-13陶立元李正迁郭向阳
白 鹏,王 涛,周 阳,陶立元,李 刚,李正迁,郭向阳△
(北京大学第三医院1.麻醉科,2.神经外科,3.临床流行病研究中心,北京 100191)
颈动脉狭窄是造成脑梗死的重要原因[1],外科治疗方法包括颈动脉内成形术/支架植入术和颈动脉内膜切除术(carotid endarterectomy,CEA)。CEA通过切除颈动脉粥样硬化斑块,纠正颈总动脉或颈内动脉的狭窄,达到预防脑梗死的目的。CEA手术管理的核心是能否在颈动脉阻断期间维持足够的颅脑灌注。为了在阻断颈动脉期间保证足够的脑灌注,避免因手术操作导致的脑缺血,目前常用的方法包括提升患者血压或使用转流技术。对于转流技术的使用目前尚存在争议,如是否需要放置转流管、什么情况下需要放置等。北京大学第三医院的CEA手术由两个不同的外科单元完成,二者在转流管置入标准和依据上存在一定差异。本研究旨在分析CEA术中不同转流标准对患者术后脑梗死的影响。
1 资料与方法
1.1 研究对象及分组
纳入北京大学第三医院两个不同外科单元2年内所有在全身麻醉下接受标准式CEA的457例患者进行回顾分析,同期联合行CEA+冠状动脉旁路移植术(coronary artery bypass grafting,CABG)、CEA+腹主动脉人工血管置换术、颈动脉支架置入术后行CEA+颈动脉支架取出术的患者均排除(共排除14例,图1)。

CEA,carotid endarterectomy;CABG,coronary artery bypass grafting.图1 不同转流策略流程图Figure 1 The flow chart of different shunt strategies
收集443例患者术前人口学资料和既往病史,依据北美症状性颈动脉内膜切除术试验(North American Symptomatic Carotid Endarterectomy,NASCET)标准将颈部血管狭窄程度分为轻度(0~49%)、中度(50%~69%)和重度狭窄及闭塞(70%及以上),记录术前1 d(T1)、入手术间(T2)、颈动脉阻断前10 min(T3)、颈动脉阻断期间(T4)、颈动脉开放后10 min(T5)、术后1 d(T6)的收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)和平均动脉压(mean blood pressure,MBP),其中T4时间点的血压是以麻醉单记录颈动脉阻断时间和颈动脉开放时间为起点和终点,每5 min记录一次,以每例患者阻断期间血压平均值作为阻断期间血压,同时记录其标准差以反映阻断期间血压波动情况,记录患者颈动脉阻断时间、是否使用转流管、术后住院时间以及住院期间是否发生脑梗死(存在明确神经症状、影像学检查证实存在新的梗死灶或原有梗死灶面积增大)。
两个外科单元的手术医师均采用标准式CEA,但转流标准不同,根据不同转流标准分为影像组(268例)和残端压组(175例)。影像组:依据术前患者血管造影或CT血管造影(CT angiography,CTA)结果决定术中是否放置颈动脉转流管,如果影像学显示对侧颈动脉重度狭窄或闭塞且颅内大脑动脉环(Willis环)不完整(Willis环不完整的定义为CTA显示双侧大脑前动脉、双侧大脑后动脉起始段、双侧颈内动脉末段以及前后交通动脉其中任意部分不能显影造成的整个血管环路不完整)、前或后交通动脉开放不满意,则术中放置颈动脉转流管。残端压组:术前不刻意要求患者血管造影或CTA,术中在颈动脉阻断时监测残端回流压力,若残端回流压<40 mmHg则置入颈动脉转流管,若残端回流压≥40 mmHg则提升血压以满足颅脑灌注需求。两组经倾向性评分匹配后,匹配出影像组和残端压组各105例患者纳入进一步分析(图1)。
1.2 统计学分析
采用SPSS 23.0软件进行统计分析,符合正态分布的计量资料用均值±标准差表示,采用独立样本t检验;不符合正态分布的计量资料用中位数(四分位数间距)表示,采用Wilcoxon秩和检验;计数资料采用卡方检验或Fisher确切概率法。P<0.05为差异有统计学意义。
采用R软件Macthlt程序进行倾向性评分匹配,匹配变量包括:性别、年龄、体重指数、术前神经症状、术侧及对侧颈动脉狭窄程度、T1~T6血压及阻断时间。倾向性得分的计算采用Logistic回归,匹配比例为1 ∶1,匹配容许误差为0.1,当容许误差出现时采用随机抽样的方法抽取对照,匹配后对比两组患者术后脑梗死的差异。
2 结果
最终影像组入组患者268例次,残端压组175例次,基本资料见表1。残端压组收治的患者年龄大于影像组[68.0(62.0,75.0)岁vs.65.0(60.0,71.0)岁,P=0.009],但是手术侧及对侧颈动脉狭窄程度较轻。
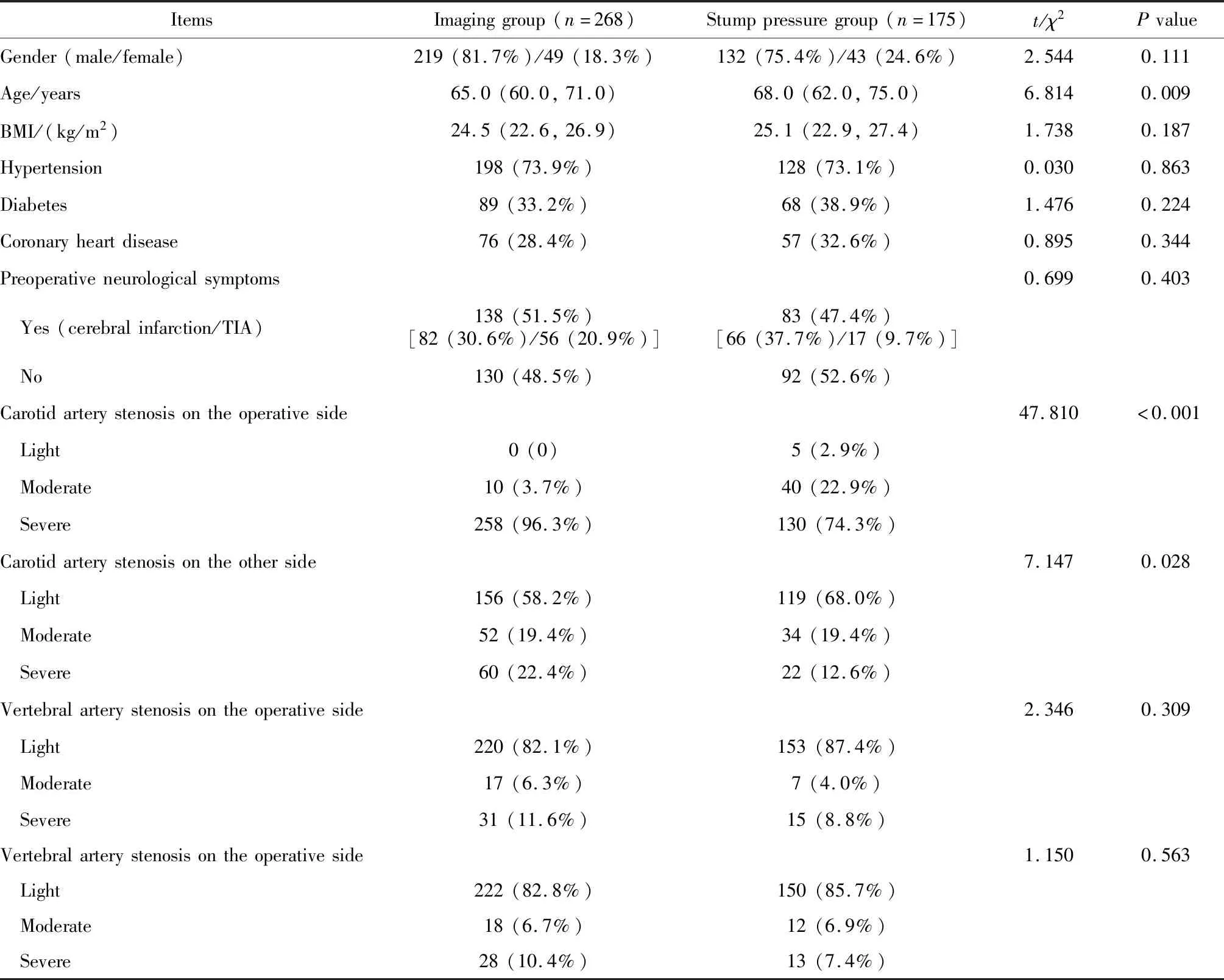
表1 两组术前的基本资料Table 1 Preoperative basic data of the two groups
两组患者各时间点血压情况见表2。影像组术中血管阻断时间短于残端压组[25.0(25.0,29.0)minvs.35.0(23.0,42.0)min,P<0.001]。影像组术中转流率为5.2%(14/268例),残端压组术中转流率为18.3%(32/175例),组间差异有统计学意义(P<0.001,表2)。
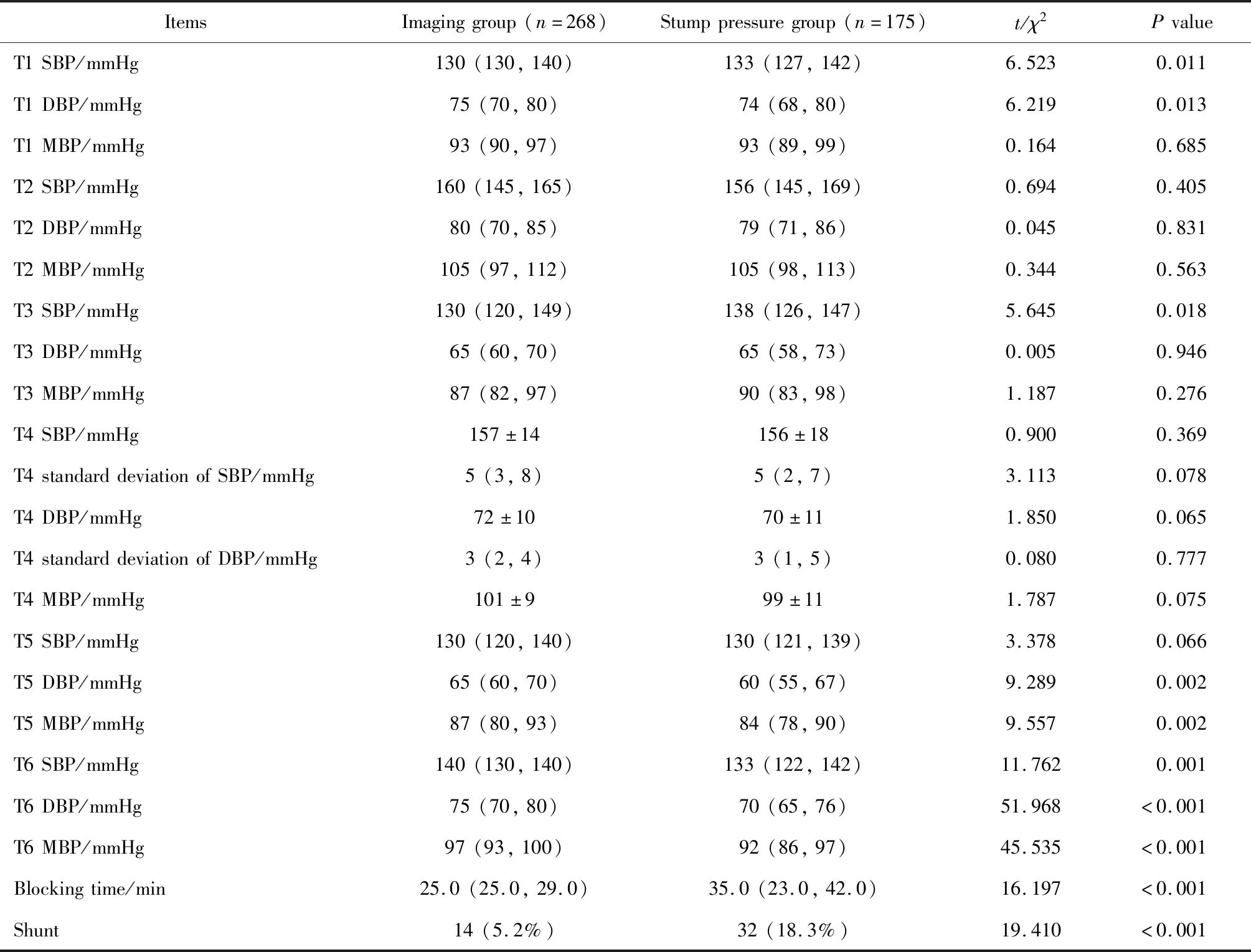
表2 两组患者血压、转流管使用及血管阻断时间Table 2 Blood pressure,shunt and blocking time of the two groups
患者术后不良事件及住院时间见表3,影像组术后脑梗死发生率略高于残端压组[1.9%(5/268例)vs.0.6%(1/175例)],但两组间差异无统计学意义(P=0.410),影像组的术后住院时间明显长于残端压组[8(7,8)dvs.5(5,6)d,P<0.001]。
因两组患者基本情况、血管阻断时间和各时间点血压存在较大差异,为了尽可能地排除干扰因素,采用R软件的Macthlt程序进行倾向性评分匹配,匹配变量包括患者术前基本情况和术中血压管理等可能影响术后脑梗死发生率的因素,包括性别、年龄、体重指数、术前神经症状、术侧及对侧颈部血管狭窄程度、T1~T6各时间点收缩压、舒张压和平均动脉压、血管阻断时间,设计容差为0.1。T4收缩压标准差和舒张压标准差属于统计计算结果,并非实际观察测量值,转流例数是不同转流标准造成的直接结果,因此并未纳入匹配变量。匹配后,影像组105例,残端压组105例,两组患者术前情况见表4。

表4 倾向性评分匹配后两组患者的术前基本资料Table 4 Preoperative basic data after propensity score matching of the two groups
各时间点血压情况见表5。影像组的105例患者均未行颈动脉转流,残端压组的105例患者中有24例置入转流管,转流率为22.9%,组间差异有统计学意义(P<0.001,表5)。

表5 倾向性评分匹配后两组患者血压、转流管使用及血管阻断时间Table 5 Blood pressure,shunt and blocking time after propensity score matching of the two groups
倾向性评分匹配后两组患者术后不良事件情况见表6。两组患者术后脑梗死发生率差异无统计学意义(1.9%vs.1.0%,P>0.999),影像组患者术后住院时间长于残端压组[8(7,8)dvs.5(4,6)d,P<0.001]。

表6 倾向性评分匹配后两组患者术后不良事件及住院时间Table 6 Postoperative adverse events and hospital stay after propensity score matching of the two groups
影像组脑梗死患者2例,1例为术后第2天下地活动时感轻度头晕,无其他不适,术后第5天查头颅MRI提示手术侧脑梗死,无明确症状,出院后门诊随诊;另1例患者为术后1天出现对侧肢体无力伴言语障碍,嗜睡,急查头颅CT示双侧多发脑梗死,经治疗后症状好转出院。残端压组脑梗死患者1例,患者术中未使用转流管,术后当天出现运动性失语伴对侧肌力降低,影像学检查示手术同侧脑梗死,经治疗后好转出院。
3 讨论
无论采取何种CEA术式,颈动脉阻断期间维持足够的颅脑灌注是CEA手术关注的要点。为了在阻断颈动脉后保证一定的脑血流,避免因手术操作导致的脑缺血,常用的方法包括提升患者血压或使用转流技术,其中转流技术是CEA术中的一种保护性措施,可在阻断颈动脉血流的情况下,无需大幅度提升血压即可为大脑提供充足的血流量,使医师不受阻断时间的影响,有充分时间进行手术操作,同时降低了因术中血流动力学剧烈波动造成的患者心脑血管意外的潜在风险[2]。但是,采用转流技术存在转流管损伤动脉内膜、动脉斑块脱落导致脑栓塞、血栓形成、动脉夹层等风险,导致手术操作难度增加[3],因此CEA术中是否需要转流,什么情况下需要转流存在一定争议。Samson等[4]对1 780例CEA患者的研究显示,常规不转流是安全的,其中127例患者合并对侧颈动脉闭塞,不使用转流管并未增加脑梗死风险。Aburahma等[5]对200例CEA患者进行的前瞻性随机对照研究发现,常规转流与选择性转流患者术后脑梗死的发生率差异无统计学意义。有研究对1966—2013年报道的CEA数据进行了分析,结果显示常规转流与选择性转流相比,总体脑梗死发生率、同侧脑梗死发生率及术后30天死亡率无明显差异,提示采用术中常规转流并不能避免脑梗死发生[6],推测可能与置入转流管操作过程中损伤血管内不稳定斑块,导致阻断远端的血管内斑块脱落有关。
本研究中两组患者均采用选择性转流的策略,脑梗死发生率分别为1.9%和1.0%,均低于既往报道的3%~4%的发生率[7],提示在我院现有医疗流程下,选择性转流策略可以很好地保障CEA患者的临床安全。
根据采用的监测方法不同,目前选择性转流技术的置管标准也有不同,如术中唤醒监测、脑电图(electroencephalogram,EEG)监测、残端回流压监测、超声多普勒监测、局部脑氧饱和度监测等[8]。术前影像学检查同样具有重要提示意义,Banga等[9]的研究提示,术前CTA检查显示大脑Willis环不完整是CEA术后早期神经症状的独立危险因素,Willis环不完整的患者如不进行转流管置入,其神经症状发生率可能超过10倍以上。中华医学会外科学分会血管外科学组发布的指南建议,出现以下情况应放置转流管[10]:对侧颈内动脉完全闭塞;颈动脉反流压<50 mmHg;术中不能耐受颈动脉阻断试验;术中经颅超声多普勒检查显示大脑中动脉血流减少;通过术中脑电图或体感诱发脑电图监测提示可能出现脑缺血;颅内Willis环代偿不全;既往有过脑卒中。
本研究中影像组主要依据术前血管造影或CTA结果判断患者手术对侧血管及颅脑Willis环情况以决定术中是否转流,残端压组主要根据颈动脉阻断后监测残端回流压力决定是否转流,这两种方法均为国内外常用的选择性转流标准[8,11-12],且符合国内相关治疗指南。两组患者脑梗死发生率差异无统计学意义,本研究未能对比出两种转流策略的优劣,但我们注意到,由于脑梗死属于发生概率较低的小概率事件,差异无统计学意义也可能与样本量较小有关,两种转流标准的对比可能需要更大样本的观察。
术后发生脑梗死值得关注。影像学组有1例患者术后第2天出现轻微症状,术后第5天确认脑梗死,术后因素在其中的作用不容忽视。Huibers等[13]对国际颈动脉支架研究(International Carotid Stenting Study,ICSS)的数据进行了统计分析,819例CEA患者中27例发生了脑卒中,其中21例是缺血性脑卒中(脑梗死),20例发生在术后,25例发生在治疗同侧,提示患者回到普通病房后应更密切地监护病情变化,及时发现脑梗死的早期表现并尽早开始治疗,对保障CEA围术期安全、改善患者预后具有重要意义,也是今后研究中需要着重观察考虑的问题。本研究中另1例患者术后1天表现出临床症状,影像学检查显示双侧多发脑梗死。这种双侧多发脑梗死需要考虑栓塞机制在其中的作用,不稳定斑块可能由于栓子脱落造成脑梗死或神经损伤,是脑梗死的相关因素之一[14]。另外,单纯依靠术前影像学检查结果决定是否在术中使用转流管,并依赖于阻断期间提升脑灌注压力的办法,是否能够有效防止脑缺血或脑梗死的发生,是否会遗漏一些应该行颈动脉转流的患者,尚有待进一步研究探索,而且术前影像学显示的血管状态在麻醉后的手术中是否会发生变化也尚不清楚。残端压组在回流压>40 mmHg且经过提升血压后,仍有1例患者在术后当日出现了手术同侧的脑梗死,其原因值得思考。刁永鹏等[15]的研究显示,颈动脉阻断时间延长会增加CEA手术的风险(OR=0.93,95%CI:0.88~0.98)。本研究中,在倾向性评分匹配前,残端压组采用的策略可能显著延长血管阻断时间(35 minvs.25 min,P<0.001),即使经过倾向性评分匹配后,两组阻断时间的差异无统计学意义,但残端压组的阻断时间仍相对更长[30.0(20.0,40.0)minvs.25.0(25.0,30.0)min,P=0.198],至于其是否具有临床意义,值得在今后的研究中进一步深入探讨。同时,测量残端回流压的方法只能在一定程度上反映对侧和颅内血管的代偿功能,对于斑块脱落栓塞或其他机制造成的脑梗死的临床监测意义有限。
尽管本研究未对不同转流标准的CEA手术时间及住院期间费用进行专门的统计研究,但影像组血管阻断时间短,考虑不同外科单元手术医师在阻断前后的手术步骤技术类似,可推断影像组策略血管阻断时间短、总体手术时间短,但影像组要求患者术前必须进行血管造影或CTA检查,可能会一定程度增加患者住院期间的医疗费用。尽管目前的研究认为不同转流标准对CEA患者术后神经功能的损伤、同侧脑梗死的发生率、术后死亡率等没有影响[6,8],但综合考虑患者的临床安全、经济效益等多方面因素,转流管的放置策略仍值得进一步深入研究。
本研究的局限性在于:受限于回顾性研究,未能对患者进行脑梗死以外的神经功能评分及评定;受限于我院CEA实际手术量,以脑梗死作为临床观察终点,在样本量较小的情况下结果的说服力有限,需要今后更大样本的进一步观察研究,因此,本研究结果尚不足以对CEA手术的转流标准给出优劣判断。随着技术的发展和设备的更新,多个监测指标联合应用共同协助判断病情成为可能。我院现已开展术前影像学联合术中脑氧饱和度监测、经颅多普勒超声监测以及神经功能监测,用于指导术中转流管置入及预测患者愈后,因此,转流管的放置策略和标准有待今后进一步深入研究。
综上所述,我院以术前影像学作为转流依据的CEA术中转流管使用率低于以残端回流压作为转流依据的患者组,两种转流标准的术后住院期间脑梗死发生率差异无统计学意义,不同转流标准对患者术后脑梗死的影响有待进一步深入研究。
