茶树橙花叔醇合成酶CsNES基因两个可变剪接转录本的功能分析
2021-12-11周汉琛雷攀登
周汉琛,雷攀登
茶树橙花叔醇合成酶基因两个可变剪接转录本的功能分析
周汉琛,雷攀登*
安徽省农业科学院茶叶研究所,安徽 黄山 245000
茶树橙花叔醇合成酶CsNES是催化()-橙花叔醇生物合成的关键酶。基于茶树全长转录本及基因组数据分析显示,橙花叔醇合成酶基因除全长转录本外,还存在两个较短的可变剪接基因亚型。利用5′RACE方法验证了基因分别在第二、三个外显子上存在可变的转录起始位点,并命名为和。体外蛋白重组显示,CsNES-2和CsNES-3表达产物均能够催化底物法尼基焦磷酸FPP生成()-橙花叔醇。基因表达分析显示,和在花中的表达量较高,在叶片中的表达水平较弱,而在嫩叶中的表达水平显著高于成熟叶片。在激素GA和MeJA处理下,和能够被MeJA诱导并上调表达。结果表明,基因存在5′端可变剪接事件,且其可变剪接产物具有催化活性,这为后续研究基因可变剪接机制对茶树萜类代谢的调控有重要指导意义。
茶树;橙花叔醇合成酶;可变剪接;功能分析;表达分析
基因的可变剪接广泛存在于动植物群体中,不仅受个体发育状态、细胞类型的影响,且环境胁迫能够显著影响基因的可变剪接现象[1]。基因的可变剪接方式主要有内含子保留(Intron retention,IR)、外显子跳跃(Exon skipping,ES)、可变5′端剪接位点(Alternative 5′ donor,AD)和可变3′端剪接位点(Alternative 3′ acceptor,AA),其中IR在植物界中广泛存在,而ES则在动物中广泛存在[1]。环境胁迫能够显著改变无意义mRNAs(Nonsense mRNAs)的积累。拟南芥中的研究显示,热胁迫能够促使基因的一个IR可变剪接基因亚型表达水平发生变化,使其表达水平在特定时间里出现延迟,即逆境条件下植物中的mRNA总丰度可以通过改变功能性mRNAs和无意义mRNAs转录的比率来进行调节以抵御逆境[2]。报道显示,茶树叶片在干旱胁迫、热胁迫两种逆境共同作用下,发生可变剪接的基因数量显著上升[3]。茶树脂氧合酶基因可变剪接基因亚型在生物逆境、非生物逆境下均可被诱导表达,而其中的响应机制尚未清楚[4]。随后研究发现,利用反寡义核苷酸(Antisense oligodeoxynucleotide,AsODNs)抑制茶树叶片中可变剪接基因亚型1、2和可变剪接基因亚型3的表达后,叶片中顺-3-己烯醇的含量呈现下降趋势,这表明基因可变剪接产物在调节茶树代谢方面存在潜在机制[5]。茶树中的芳樟醇合成酶基因通过5′端可变剪接能够产生两个基因亚型,其中全长基因亚型含有质体信号肽定位于质体中,能够促进芳樟醇的合成;较短的可变剪接基因亚型定位于细胞质能够催化底物合成橙花叔醇[6]。本研究基于已发表的茶树三代转录测序数据[7],发现橙花叔醇合成酶基因也存在5′端可变剪接现象。
橙花叔醇是一类重要的花香物质,对茶叶的香气品质形成具有重要贡献[8],尤其是乌龙茶[9]。橙花叔醇含有多个同分异构体形态,包括()-橙花叔醇和()-橙花叔醇。目前研究表明,茶树()-橙花叔醇的生物合成由CsNES[9]或者CsLIS/NES催化[6]。基因在乌龙茶加工过程中随着摇青次数的增加,其表达水平显著上调,并证明该基因能够响应机械损伤带来的逆境胁迫。低温胁迫处理显示,基因表达水平上调,同时茶树叶片中()-橙花叔醇含量也显著上升[9]。茶树挥发性萜类物质多以糖苷形态储藏在细胞内,近期研究显示茶树橙花叔醇葡萄糖苷具有潜在的防御冷胁迫的生物学功能[10],这表明橙花叔醇不仅积极参与茶树生长发育,且对茶叶品质形成具有重要影响。因此,本研究对茶树基因可变剪接亚型是否具有催化功能及其表达模式进行分析,研究结果为可变剪接基因调控茶树次级代谢产物的后续研究提供理论支撑。
1 材料与方法
1.1 试验材料及激素处理
茶树芽、第一叶、第二叶、第三叶,以及茶花取样于安徽农业大学农翠园,为7年生舒茶早茶树。激素处理试验材料为一年生舒茶早茶籽苗,培养于植物培养室(光照为16 h;温度为白天25℃、夜晚20℃);处理时采用10 mmol·L-1茉莉酸甲酯(MeJA)或10 mmol·L-1赤霉素(GA)喷施茶树叶片,1 h后取样。以上材料均立即置于液氮中速冻,然后放置于–80℃冰箱,用于后续RNA提取、基因定量分析。用于橙花叔醇丰度分析的茶树叶片于–80℃冷冻干燥48 h,后置于–20℃冰箱保存。
1.2 CsNES基因可变剪接转录本的5′RACE验证
基因可变5′端剪接事件采用5′RACE方法验证[5]。首先利用Clontech公司SMART 5′ RACE试剂盒合成5′RACE模板,利用表1中的CsNES-R1和CsNES-R2引物进行两步PCR扩增,扩增酶为TAKARA公司PrimeSTAR高保真酶,扩增程序为:98℃ 10 s,55℃ 15 s,72℃ 20 s,共30个循环。两轮PCR后利用2.5%琼脂糖分离克隆产物,纯化目的条带,连接全式金生物公司pEASY-blunt载体后测序。

表1 本研究中所用的引物序列
1.3 原核表达载体构建
验证基因存在5′端可变剪接位点后,分别设计全长克隆引物(表1)。基于其全长转录本已验证功能[9],利用表1中的CsNES-2-PET和CsNES-3-PET引物克隆基因两个可变剪接基因亚型和,通过酶切位点EcoRI和SalI连接到原核表达载体pET32a中,然后将构建好的质粒转化Trans-T1,测序结果无误后转入大肠杆菌表达菌株BL21中。
1.4 体外酶活验证
将以上转入pET32a-CsNES-2、pET32a-CsNES-3质粒的BL21菌株过夜培养,OD600约为0.5时,加入IPTG并使其终浓度为0.5 mmol·L-1,于18℃摇床220 r·min-1诱导10 h,以未加IPTG的菌液为对照[6]。诱导结束后,菌液在6 000 r·min-1转速下离心10 min,去掉上清液后加1×PBS缓冲液悬浮,然后加入终浓度为1 mmol·L-1的溶菌酶于37℃反应30 min,反应结束后于冰上裂解至澄清。裂解液于转速5 000 r·min-1下离心10 min,上清液与沉淀分别用PBS缓冲液溶解后,进行SDS-PAGE分析。重组蛋白定量后,添加底物FPP于37℃水浴反应30 min,然后利用65 μm PDMS/DVB SPME萃取头(Stable Flex,Supelco Inc.,Bellefonte,PA,USA)吸附30 min。吸附结束后,立即将SPME萃取头于250℃的气相色谱-质谱中解吸5 min,用于GC-MS分析。
1.5 橙花叔醇丰度分析
橙花叔醇丰度分析参考Han等[11]方法。准确称取冷冻干燥样0.2 g于20 mL萃取瓶,加5 mL沸水后置于70℃水浴平衡5 min,然后利用65 μm PDMS/DVB SPME萃取头于70℃水浴下吸附30 min。吸附结束后,立即将SPME萃取头于250℃的气相色谱-质谱中解吸5 min,用于GC-MS分析。
1.6 GC-MS分析
气相色谱仪Agilent 7697A-质谱仪Agilent 7890A结合色谱柱DB-5(30 m×0.25 mm× 0.25 μm,Agilent)用于橙花叔醇分析,其中氦气(>99.999%)为载气。GC运行条件为:初始温度为50℃并保持1 min,然后以10℃·min-1升至100℃并保持1 min,再以4℃·min-1升高到200℃并保持1 min,最后以16℃·min-1升高到280℃后保持7 min。通过橙花叔醇标准品对试验中的化合物进行鉴定。
1.7 基因表达分析

1.8 数据统计分析
采用SPSS 19.0软件对试验样品间的差异进行单因素方差分析(Analysis of variance,ANOVA),其中运算方法为最小显著性差异法(Least significant difference,LSD),以检验不同样品间的显著性(<0.05)。
2 结果与分析
2.1 茶树橙花叔醇合成酶基因CsNES 5′端可变剪接验证
基于三代全长转录数据,以及基因组数据的应用[13],显示茶树橙花叔醇合成酶基因CsNES存在5′端可变剪接事件,即该基因除全长转录本外,存在2个较短的可变剪接基因亚型,且转录起始位点分别位于第二和第三个外显子,并命名为和(图1-A)。利用5′RACE方法共获得3条序列(图1-B),测序结果显示最长序列为全长转录本,较短的两条序列为和(图1-C)。除去接头序列,和共相差262个碱基(图1-C),与全长转录本数据结果相一致,以上结果证实茶树基因存在5′端可变剪接事件。
2.2 茶树CsNES可变剪接基因亚型的功能分析
基因全长转录本翻译的蛋白序列含有547个氨基酸,其2个5′可变剪接基因亚型分别含有483个和398个氨基酸序列。InterProScan在线网站蛋白结构域分析显示,CsNES-2和CsNES-3在N-端和C-端均含有萜类合成酶特征结构域IPR001906和IPR034741,以及萜类合成酶特殊的metal-binding结构域IPR005630;利用SWISS-MODEL网站构建蛋白3D模型,结果如图2-A所示,CsNES-2在N端多出84个氨基酸组成的螺旋结构。通过异源表达,获得CsNES-2和CsNES-3表达产物(图2-B);以FPP为底物,GC-MS分析结果显示CsNES-2和CsNES-3催化底物FPP生成()-橙花叔醇及少量()-橙花叔醇(图2-C)。这表明CsNES-2和CsNES-3虽与其全长蛋白序列相比在N-端缺少64个和149个氨基酸序列,但结构分析及体外酶活反应显示2个可变剪接基因亚型翻译产物依旧有催化活性(图2)。
2.3 CsNES-2和CsNES-3的表达模式分析
利用表1中的定量分析引物,对和在茶树叶片和花中(图3-A)的相对表达水平进行分析。结果显示,和均在花中有较高的表达量,两者在嫩叶中的表达水平显著高于成熟叶(图3-B和图3-C)。通过GC-MS分析茶树第二叶和花中的挥发性成分,结果显示茶树第二叶中橙花叔醇的丰度显著高于茶树花中的丰度,这表明茶树叶片中有更多的橙花叔醇积累(图3-D)。
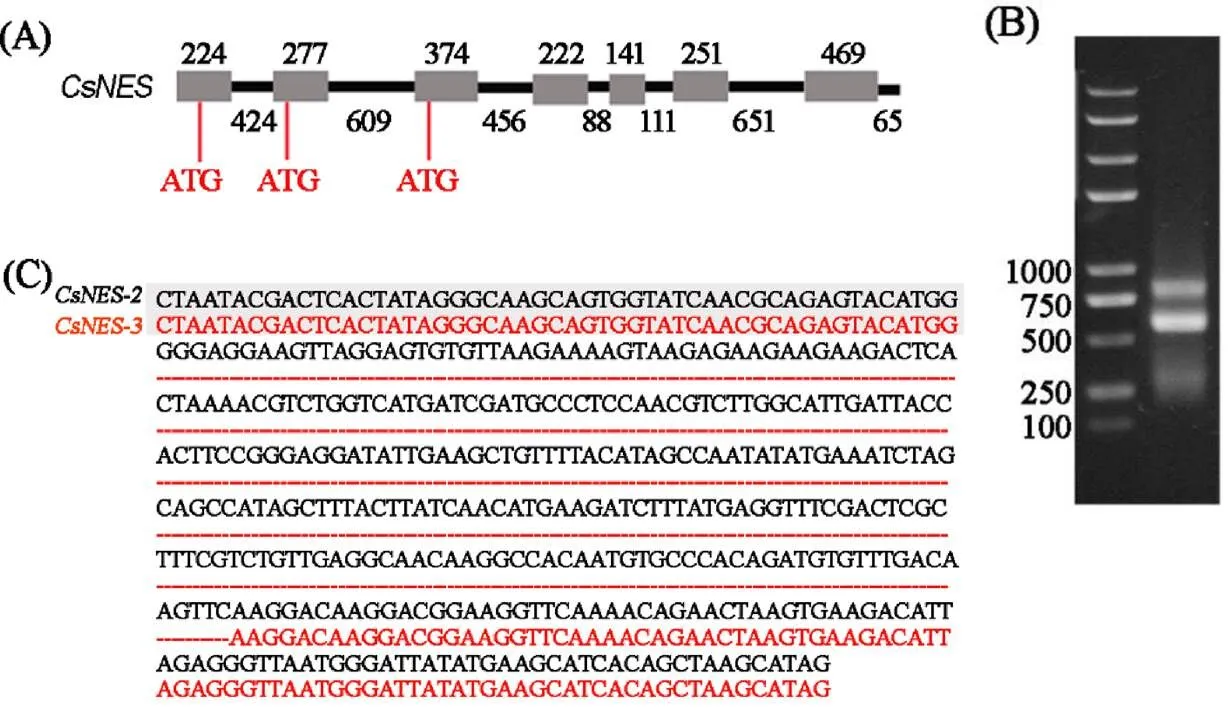
注:(A)CsNES基因5′端可变剪接发生位点;(B)CsNES基因5′RACE验证结果;(C)CsNES基因2个较短可变剪接基因亚型测序结果(其中灰色部分为RACE接头序列)
本研究分析了不同激素处理下和的表达水平变化,结果显示和在MeJA激素处理下表达水平显著上升(<0.05),而GA激素处理后和的表达水平无显著变化(>0.05)(图4-A和图4-B)。GC-MS分析结果表明,橙花叔醇丰度在MeJA激素处理下显著增加(<0.05)(图4-C),而GA激素处理后橙花叔醇丰度有增加但未达到显著水平(>0.05)(图4-C)。
3 讨论
植物基因存在广泛的可变剪接事件,同一个基因可以产生多个转录本,尤其是在逆境环境中基因可变剪接的发生普遍存在[14]。植物不仅可以在光的诱导下调控基因的可变剪接[15],且在不同发育阶段也调控了基因可变剪接的发生,比如植物开花进程中基因可变剪接的发生[16-17]。已有研究表明,植物通过基因的可变剪接来增加蛋白质组学的复杂性,且可通过可变剪接减少结构域紊乱蛋白质的产生来适应环境[14]。
茶树基因存在普遍的可变剪接事件,比如茶树、基因[4,6],这些基因的可变剪接产物或通过体外酶活验证具有催化功能[6],或通过基因的抑制表达证实了对其催化产物的形成产生影响[4],表明可变剪接产物具有一定生物学活性。本研究中,茶树基因通过5′端可变剪接产生2个相对较短的转录本,体外酶活证实了2个较短可变剪接转录本重组产物能够催化底物FPP生成橙花叔醇,这表明和具有潜在的生物学功能。后续研究中可通过稳定表达验证、在茶树体内是否具有催化活性。
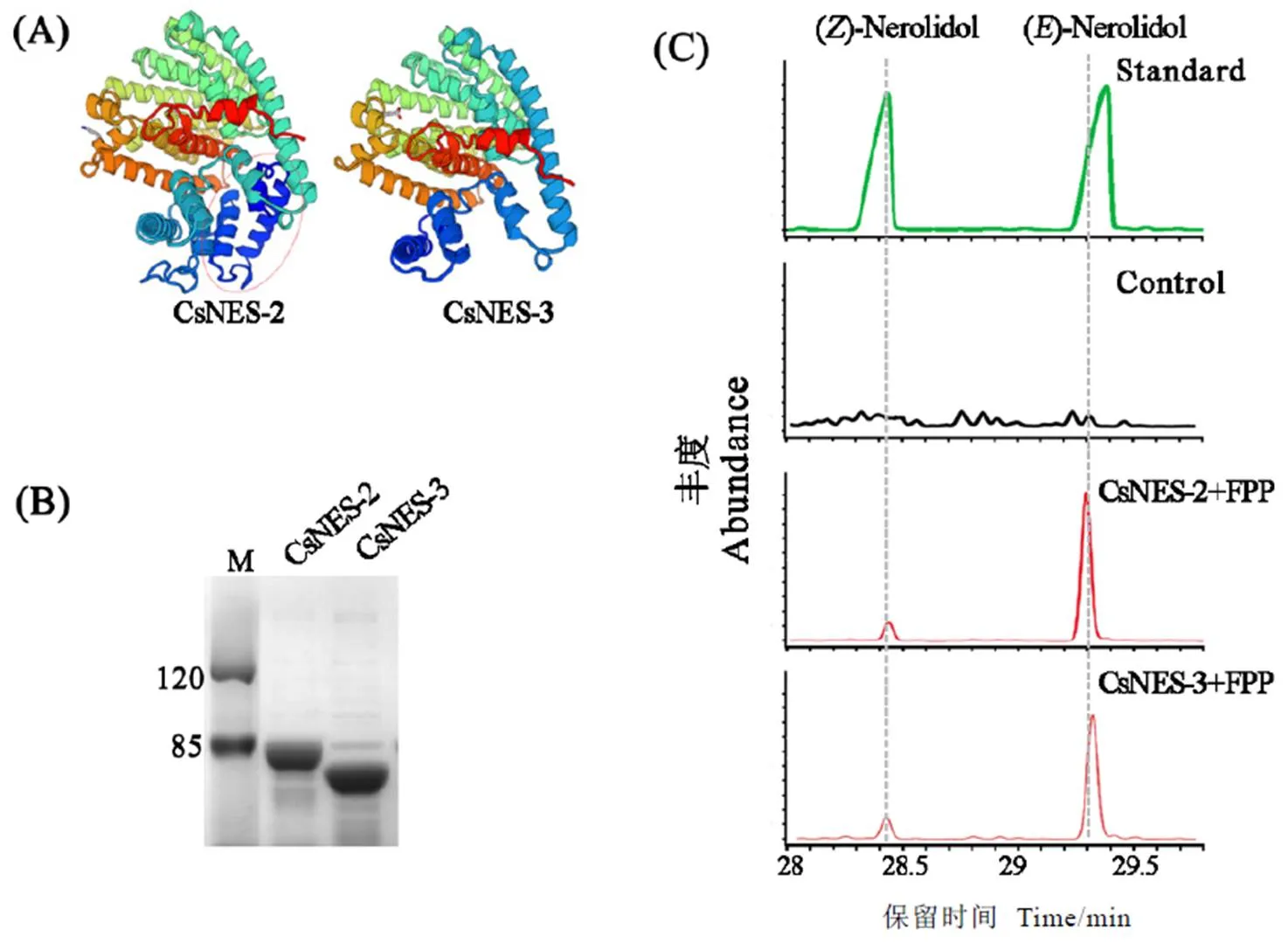
注:(A)CsNES-2, CsNES -3蛋白结构分析;(B)CsNES-2, CsNES-3蛋白重组;(C)GC-MS分析CsNES-2, CsNES-3表达产物的催化活性(其中对照(control)为空载体表达产物与底物FPP反应)

注:图中F、B、FL、SL、TL分别表示茶树花、芽、第一叶、第二叶、第三叶;(B)和(C)展示CsNES-2和CsNES-3在茶树花部位和叶片不同部位中的表达分析,(D)展示茶树第二叶和花中橙花叔醇丰度分析。图中不同字母表示0.05水平上差异显著

注:(A)CsNES-2和CsNES-3;(B)在GA和MeJA处理下的表达分析;(C)激素处理下茶树叶片橙花叔醇丰度变化分析。图中不同字母表示0.05水平上差异显著
表达模式分析显示,和在花中表达量较高,而橙花叔醇丰度分析显示其在叶片中有更多的积累。Liu等[6]通过溶剂萃取方法分析茶树花与叶片中的挥发性成分,也表明叶片中的橙花叔醇含量(75 μg·kg-1)显著高于花中的含量(7 μg·kg-1)。茶树橙花叔醇的生物合成可能由多个基因调控,如[6]、[9]以及[18]。报道显示[6]、[18]均在茶树花中有较高的表达量。另有研究显示全长转录本在茶树叶片中的表达水平显著高于花中的表达水平[19],这表明全长转录本对茶树叶片中橙花叔醇的积累具有重要作用。
近期研究表明,橙花叔醇合成酶能够被茶尺蠖(Prout)所诱导表达,并促进了橙花叔醇的生物合成与释放[18]。[6]、[9]也受MeJA或低温等胁迫诱导并上调表达。本研究中基因2个较短的可变剪接基因亚型受激素MeJA诱导并上调表达,表明、3表达水平受逆境胁迫影响。此外,MeJA处理后茶树叶片中的橙花叔醇丰度显著增加,鉴于茶树橙花叔醇生物合成涉及多个基因,推测逆境下橙花叔醇合成增加并不是单一基因作用的结果。
综上所述,茶树橙花叔醇合成酶基因存在5′端可变剪接事件,能够产生3个转录本,除全长转录本具有催化功能外,其2个较短可变剪接基因亚型在离体条件下也具有催化活性。此外,2个较短可变剪接基因亚型受MeJA信号诱导表达,推测其参与了茶树橙花叔醇的生物合成。本研究结果为后续研究萜类合成酶的可变剪接机制提供了理论基础。
[1] Yu H, Tian C, Yu Y, et al. Transcriptome survey of the contribution of alternative splicing to proteome diversity in[J]. Mol Plant, 2016, 9(5): 749-752.
[2] Filichkin S A, Cumbie J S, Dharmawardhana P, et al. Environmental stresses modulate abundance and timing of alternatively spliced circadian transcripts in[J]. Mol Plant, 2015, 8(2): 7-27.
[3] Ding Y, Wang Y, Qiu C, et al. Alternative splicing in tea plants was extensively triggered by drought, heat and their combined stresses [J]. Peer J, 2020, 8: e8258. doi: 10.7717/peerj.8258.
[4] Zhu J, Wang X, Guo L, et al. Characterization and alternative splicing profiles of the lipoxygenase gene family in tea plant () [J]. Plant Cell Physiol, 2018, 59(9): 1765-1781.
[5] Xu Q, Cheng L, Mei Y, et al. Alternative splicing of key genes inpathway involves biosynthesis of volatile fatty acid derivatives in tea plant () [J]. J Agr Food Chemistry, 2019, 67(47): 13021-13032.
[6] Liu G F, Liu J J, He Z R, et al. Implementation ofin linalool biosynthesis involves transcript splicing regulation in[J]. Plant Cell Environ, 2018, 41(1): 176-186.
[7] Qiao D H, Yang C, Chen J, et al. Comprehensive identification of the full-length transcripts and alternative splicing related to the secondary metabolism pathways in the tea plant () [J]. Scientific Reports, 2019, 9(1): 2709. doi: 10.1038/s41598-019-39286-z.
[8] 宛晓春. 茶叶生物化学[M]. 北京: 中国农业出版社, 2003: 39-49.
Wan X C. Tea Biochemistry [M]. Beijing: China Agriculture Press, 2003: 39-49.
[9] Zhou Y, Zeng L T, Liu X Y, et al. Formation of ()-nerolidol in tea () leaves exposed to multiple stresses during tea manufacturing [J]. Food Chemistry, 2017, 231: 78-86.
[10] Zhao M Y, Zhang N, Gao T, et al. Sesquiterpene glucosylation mediated by glucosyltransferase UGT91Q2 is involved in the modulation of cold stress tolerance in tea plants [J]. New Phytol, 2020(226): 362-372.
[11] Han Z X, Rana M M, Liu G F, et al. Green tea flavour determinants and their changes over manufacturing processes [J]. Food Chemistry, 2016, 212: 739-748.

[13] Wei C L, Yang H, Wang S B, et al. Draft genome sequence ofvar.provides insights into the evolution of the tea genome and tea quality [J]. PNAS, 2018, 115(18): E4151-E4158.
[14] Chaudhary S, Jabre I, Reddy A S N, et al. Perspective on alternative splicing and proteome complexity in plants [J]. Trends Plant Sci, 2019, 24(6): 496-506.
[15] Godoy Herz M A, Kubaczka M G, Brzyżek G, et al. Light regulates plant alternative splicing through the control of transcriptional elongation [J]. Mol Cell, 2019, 73(5): 1066-1074.
[16] Eckardt N A. Alternative splicing and the control of flowering time [J]. Plant Cell, 2002, 14(4): 743-747.
[17] 卢欢欢, 邓琴霖, 吴梦丹, 等. 可变剪接调控植物开花的作用机制进展[J]. 生物工程学报, 2021, 37(8): 1-14.
Lu H H, Deng Q L, Wu M D, et al. Research progress on the mechanism of alternative splicing in regulating plant flowering [J]. Chin J Biotech, 2021, 37(8): 1-14.
[18] Liu G, Yang M, Fu J. Identification and characterization of two sesquiterpene synthase genes involved in volatile-mediated defense in tea plant () [J]. Plant Physiol Biochem, 2020, 155: 650-657.
[19] 刘晶晶. 茶树重要萜类香气物质生物合成机理的研究[D]. 合肥: 安徽农业大学, 2018.
Liu J J. Mechanisms of volatile terpenoids biosynthesis in tea plants [D]. Hefei: Anhui Agriculture University, 2018.
The Functional Identification of Two Alternative Splicing Transcripts of
ZHOU Hanchen, LEI Pandeng*
Tea Reasearch Institute of Anhui Academy of Agricultural Sciences, Huangshan 245000, China
CsNES is a key enzyme for the formation of ()-nerolidol in tea plants. According to the analysis of full-length transcriptome and genome data, it is shown thathas two shorter alternative splicing transcripts besides the full-length transcript. The rapid amplification of cDNA ends (RACE) result indicates that theundergoes 5’ alternative splicing in the second and third exons, respectively, which were named asand. The recombinant proteins of CsNES-2 and CsNES-3 possess strong activities to catalyze the FPP into ()-nerolidol and weak activities to hydrolyze FPP into ()-nerolidol. The gene expression analysis shows thatandhad higher expression levels in tea flower compared to those in tea leaves. Their expressions in young leaves were higher than those in mature leaves. Furthermore, the expression levels ofandwere induced by the MeJA treatment. This study identified two alternative splicing transcripts of thegeneand gave insights into the regulation of gene alternative splicing in terpenoids metabolism in.
, nerolidol synthase, alternative splicing, function analysis, expression analysis
S571.1;Q52
A
1000-369X(2021)06-753-08
2021-05-08
2021-06-18
国家自然科学基金(32002096)、安徽省农业科学创新团队(2021YL036)
周汉琛,女,博士,主要从事茶树生物化学及分子生物学研究。*通信作者:lpteagle@126.com
(责任编辑:赵锋)
