桦褶孔菌挥发油的化学成分及2种活性研究
2021-12-11孔德仙王军民
郭 磊 田 野 高 然 孔德仙 王军民 华 燕
(1. 西南林业大学云南森林资源培育与利用协同创新中心,云南 昆明 650233;2. 西南林业大学生命科学学院,云南 昆明 650233)
植物挥发油是植物体内的次生代谢物,由相对分子质量较小的简单化合物组成,具有一定的消炎、抗氧化及抑制病虫害等多种生物活性[1-2],具有极大的开发和应用价值,也是药品、食品、化妆品等领域的研究热点。
桦褶孔菌(Lenzites betulina)是属于担子菌门(Basidiomycete)、伞菌纲(Agaricomycetes)、多孔菌目(Aphyllophorales)、多孔菌科(Polyporaceae)、褶孔菌属(Lenzites)的一种大型真菌,通常生在桦树倒木上,在中国有着广泛分布[3-4]。桦褶孔菌含有多种生理活性物质,比如多糖、吡喃酮、甾醇等[5-7],已被用于臀部和股骨疼痛、肩高病、中风和感冒疾病的治疗[8]。目前,对桦褶孔菌的研究较少,只是在子实体中多糖的分离纯化及化合物的分离鉴定方面有较少的报道,对其挥发油化学成分及其生物活性研究还处于空白阶段。因此,本研究以桦褶孔菌子实体为原料,通过超临界CO2萃取技术并结合GC−MS对挥发油的化学组成进行鉴定;同时,测定挥发油对DPPH·、O2−·、·OH和ABTS+·的清除能力及抑菌活性,以期为桦褶孔菌资源的综合利用和深度开发提供参考依据。
1 材料与方法
1.1 材料与试剂
桦褶孔菌子实体购自深圳悦云商贸有限公司,由西南林业大学张颖博士鉴定为桦褶孔菌,标本保存于西南林业大学林学院植物资源利用系。菌种由西南林业大学生物多样性保护与利用学院和西南山地森林资源保育与利用教育部重点实验室提供,分别为大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、四联球菌(Micrococcus tetragenus)、变形杆菌(Proteus vulgaris)、金黄色葡萄球菌金黄亚种(Staphylococcus aureus subsp. aureus)和铜绿假单胞菌(Pseudomonas aeruginosa)。
1,1−二苯基−2−三硝基苯肼(DPPH)、2,2'−联氮−双−3−乙基苯并噻唑啉−6−磺酸(ABTS),正己烷、亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、磷酸二氢钠、磷酸氢二钠、过硫酸钾、铁氰化钾、三氯乙酸、三氯化铁、盐酸、水杨酸、硫酸亚铁、过氧化氢、焦性没食子酸、抗坏血酸、二甲基亚砜(DMSO),均为分析纯;牛肉膏、蛋白胨、琼脂,氯化钠,均为试剂纯。
1.2 仪器与设备
Speed SFE超临界萃取仪(ASI,美国);7890A−5975C气相色谱质谱联用仪(Agilent,美国);UV−VIS 300紫外分光光度计(Thermo Fisher,美国);BAS2245电子天平(Strtorius,德国,精度0.1 mg);HH−2数显电子恒温水浴锅(金坛市丹瑞电器厂,中国);恒温恒湿培养箱(上海秋佐科学仪器有限公司,中国)。
1.3 实验方法
1.3.1 超临界CO2萃取桦褶孔菌挥发油
称取30 g桦褶孔菌干燥粉末装入超临界CO2萃取仪萃取釜内,设置萃取压力25 MPa,萃取温度40 ℃,萃取时间2 h;静态萃取后在CO2流量10 L/h条件下连续萃取0.5 h,用正己烷收集得到有特殊香味的黄色油状物。
1.3.2 桦褶孔菌挥发油GC-MS分析
GC条件:DB−5 MS 毛细管色谱柱(30 m ×0.25 mm × 0.25 μm);载气为氦气,流速1.0 mL/min;采用程序升温,进样口温度250 ℃,初始温度80 ℃,保持1 min,以20 ℃/min速率升至260 ℃,保持1 min,以5 ℃/min 速率升至280 ℃,保持6 min;再以5 ℃/min速率升至310 ℃,保持10 min;采用无分流进样,进样量为1.0 μL。MS条件:EI离子源;离子源温度240 ℃;接口温度280 ℃; 电子能量70 eV;溶剂延时4.5 min;扫描方式:全谱图扫描; 质量扫描范围50~600 amu。
1.3.3 桦褶孔菌挥发油抗氧化活能力测定
1)清除DPPH·能力参照曾昭成等[9]的方法并略作修改,将桦褶孔菌挥发油溶于DMSO配成6.25、12.5、25、50、100、200、300、400、500 μg/mL浓度的溶液,量取2.0 mL样液加入2.0 mL DPPH−乙醇溶液(0.2 m moL)摇匀后静置30 min,在517 nm处测定吸光值(A1)。以等体积无水乙醇代替DPPH−乙醇溶液测吸光值(A2),以等体积无水乙醇代替样液测吸光值(A0),以维生素C为对照, 每个样品进行3次平行实验。按公式(1)计算桦褶孔菌挥发油清除DPPH·清除率。
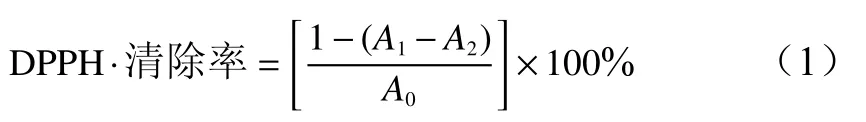
2)清除O2−·能力的测定采用邻苯三酚法[10],取3.0 mL Tris−HCl缓冲液(pH 8.2)加入1 mL 6.25、12.5、25、50、100、200、300、400、500 μg/mL浓度的桦褶孔菌挥发油溶液和0.4 mL邻苯三酚溶液(5.0 mmol/L)摇匀,在25 ℃水浴中放置4 min后,立即加入0.1 mL HCl溶液(8.0 mol/L)终止反应,在320 nm处测定吸光度(As),以等体积蒸馏水代替样液测吸光值(Ac),以等体积蒸馏水代替邻苯三酚测定吸光值(Ab),以维生素C为对照, 每个样品进行3次平行实验,按公式(2)计算O2−·清除率。
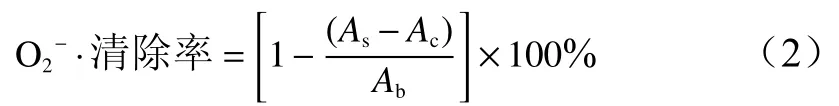
3)清除·OH能力参照Wannes等[11]的方法并略作修改,取不同浓度的桦褶孔菌挥发油(6.25、12.5、25、50、100、200、300、400、500 μg/mL)2.0 mL,依次加入3 mmol/L FeSO4溶液、6 mmol/L水杨酸−乙醇溶液和4 mmol/L H2O2溶液各0.2 mL,摇匀静置60 min后在510 nm下测吸光值(Aα)。以等体积蒸馏水代替水杨酸测吸光值(Aβ),以等体积蒸馏水代替样液测吸光值(Aγ)。以维生素C为对照,每个样品进行3次平行实验,按公式(3)计算·OH清除率。
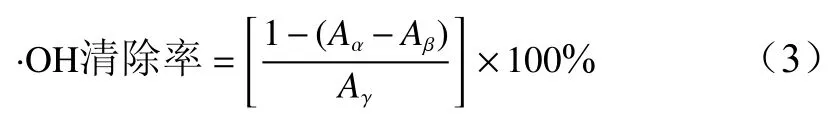
4)清除ABTS+·能力的测定参照文献[12]并适 当 修 改,将2.45 mmol·L−1过 硫 酸 钾 溶 液 与7 mmol/L ABTS溶液混合(体积比为1∶1)并避光放置12 h后,用无水乙醇将其稀释,使其吸光值在734 nm 处为0.68 ~ 0.72之间,取3.0 mL混合液与0.3 mL挥发油样液于室温下反应6 min后,迅速在734 nm处测定吸光度值(Ai) ,以等体积蒸馏水代替储备液测吸光值(Aii),以等体积蒸馏水代替样液测定吸光值(Aiii)。以维生素C为对照,每个样品进行3次平行实验,按公式(4)计算ABTS+·清除率。
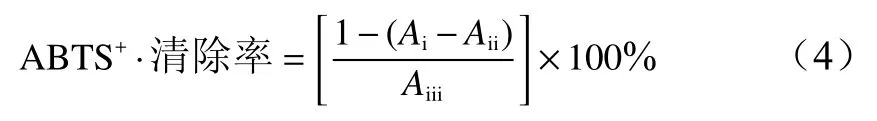
1.3.4 桦褶孔菌挥发油抑菌活性测定
1)菌种培养 抗菌试验菌株为3种革兰氏阴性菌如大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomanas aeruginosa)和变形杆菌(Proteus vuigaris),3种革兰氏阳性菌如金黄色葡萄球菌金黄亚种(Staphylococcus aureussubsp. aureus)、枯草芽孢杆菌(Bacillus subtilis)和四联球菌(Micrococcus tetragenus)。菌种培养采用冯小飞等[13]方法并略作修改,将固体琼脂培养基在121 ℃高压灭菌20 min后平铺于培养皿,用划线法接种这6种细菌,将培养皿置于28 ℃恒温培养箱中培养24 h,所有操作均在无菌条件下操作。
2)最低抑菌浓度(MIC)的测定参照李肖等[14]方法并略作修改。精确称量桦褶孔菌挥发油并用DMSO配制成不同浓度的初始液,并用二倍稀释法再进行配制。具体操作如下:在无菌96孔板中,第1列至第6列为样品孔,第7列为空白对照孔,第8列为阳性对照孔,每孔加入100 μL液体培养基,实验组加入50 μL的样品溶液,利用二倍稀释法使第1至6列的浓度梯度为100、50、25、12.5、6.25、3.125 mg/mL,空白对照加入50 μL DMSO,阳性对照组加入50 μL链霉素溶液(0.1 g/L)。在每孔中加入50 μL菌液置于28 ℃培养箱中培养24 h,平行测定3次,加入40 μL碘硝基四唑紫溶液(0.2 g/L),观察微孔中是否出现紫色来检查有无细菌生长,以不出现紫色的微孔浓度为MIC。
1.4 数据处理
每个实验均平行测定3次,使用Origin Pro 2017 C对试验中得到的数据进行处理,利用SPSS Statistics 20对数据进行统计学分析。
2 结果与分析
2.1 挥发油化学成分分析
由表1可知,从桦褶孔菌挥发油中鉴定出31种化合物,主要化学成分有亚油酸(12.9%)、三十四烷(9.4%)、二十四烷(6.4%)、抗坏血酸二棕榈酸酯(4.5%)、9(11)−脱氢麦角甾醇苯甲酸酯(3.2%)、二十烷(2.3%)、二十一烷(2.3%)、2,4−二叔丁基苯酚(2.2%)、二(6−甲基庚基)邻苯二甲酸酯(1.8%)、3,6−二羟基胆烷酸(1.7%)、4−硝基苯基壬醚(1.6%)、2,6,10,14−四甲基十八烷(1.5%)、5−(2−甲基丙基)壬烷(1.4%)、5−丁基−壬烷(1.4%)、四十四烷(1.4%)、2−甲基十七烷(1.4%)、2,2−二甲基癸烷(1.3%)和2−苯−2−丁烯(1.2%)。
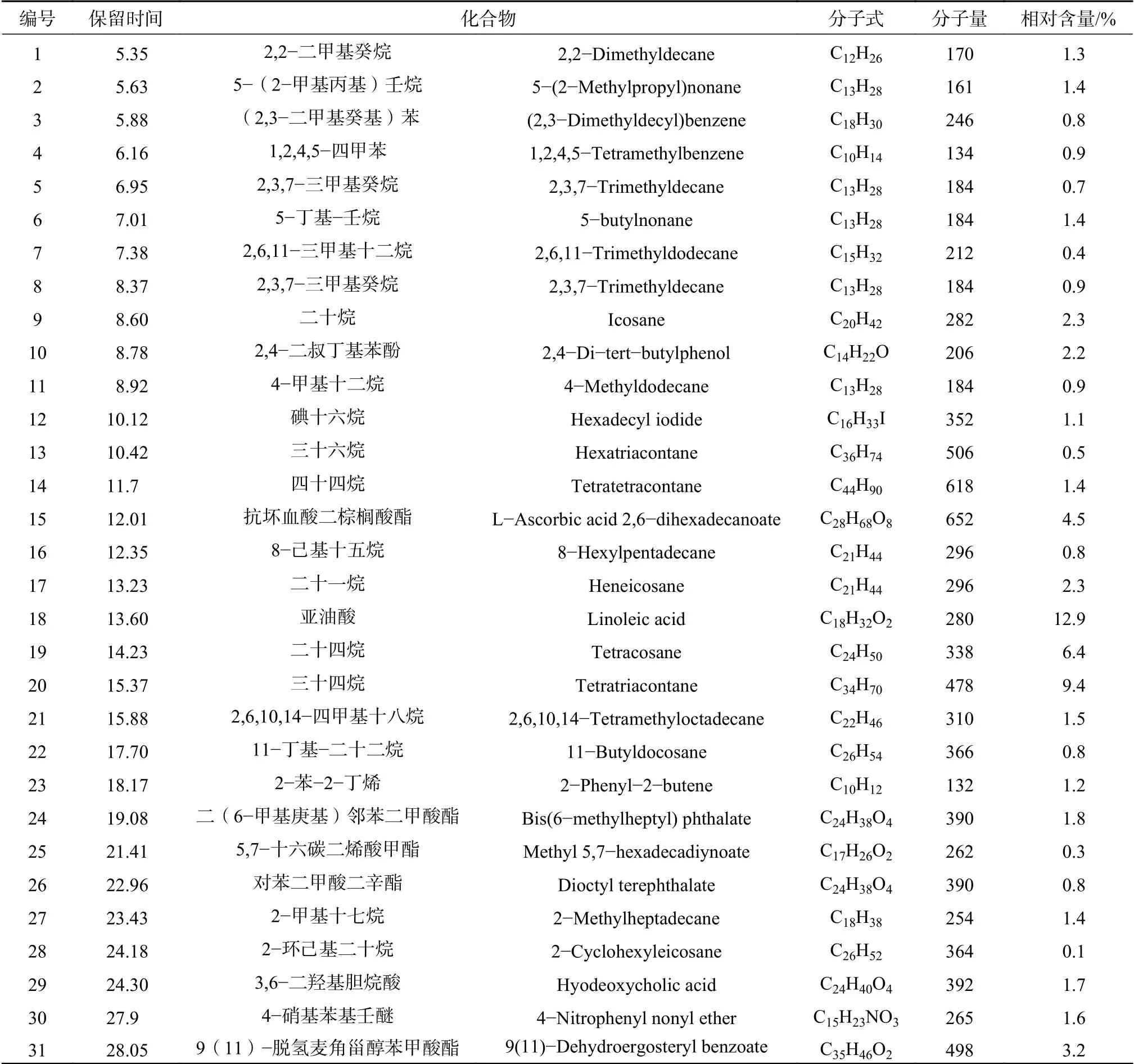
表1 桦褶孔菌挥发油的化学成分分析Table 1 The chemical constituents of volatile oil from L. betulina
2.2 桦褶孔菌挥发油抗氧化活性
2.2.1 桦褶孔菌挥发油对DPPH·的清除作用
由图1可知,桦褶孔菌挥发油对DPPH·的清除能力在浓度为6.25~500 μg/mL的范围内呈现较好的量效关系。当浓度为500 μg/mL时,桦褶孔菌挥发油和维生素C对DPPH·的清除率分别达到了(81.11 ± 0.15)%和(95.44 ± 0.15)%。相同浓度条件下,桦褶孔菌挥发油对DPPH·的清除能力低于维生素C。表2是用Probit函数进行回归计算桦褶孔菌挥发油和维生素C抗氧化活性的EC50值,从表中可以看出桦褶孔菌挥发油清除DPPH·的EC50值为(115.81 ± 4.75)μg/mL,低于维生素C清除DPPH·的EC50值(16.74 ± 2.82)μg/mL。

表 2 桦褶孔菌挥发油抗氧化活性的EC50值Table 2 EC50 of volatile oils from L. betulina μg/mL
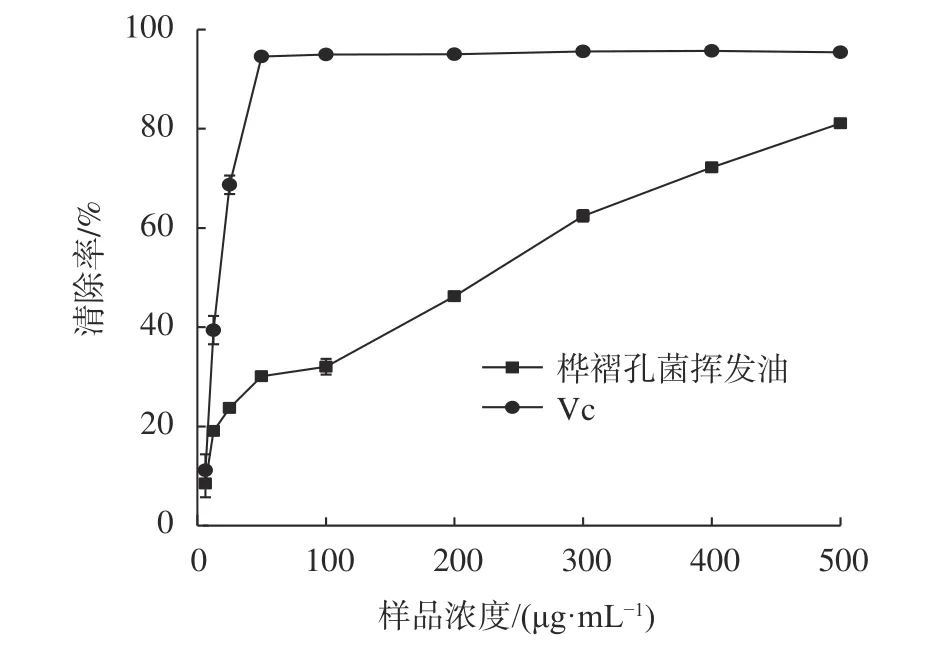
图1 桦褶孔菌挥发油浓度对DPPH·的清除效果影响Fig. 1 DPPH· free radical scavenging capacity of volatile oils from L. betulina
2.2.2 桦褶孔菌挥发油对O2−·的清除作用
由图2可知,桦褶孔菌挥发油和维生素C清除O2−·能力的强弱,桦褶孔菌挥发油对O2−·的清除能力在实验范围内与浓度呈现良好的量效关系。相同浓度下,桦褶孔菌挥发油清除O2−·的能力低于维生素C。桦褶孔菌挥发油对O2−·的清除率在浓度为100~500 μg/mL范围迅速上升,当浓度达到500 μg/mL时,桦褶孔菌挥发油对O2−·的清除能力达到(87.97 ± 1.84)%,此时维生素C的清除能力为(98.28 ± 1.29)%。由表2可知,桦褶孔菌挥发油清除O2−·的EC50值为(40.72 ±3.71)μg/mL,略高于维生素C(5.39 ± 1.69)μg/mL。
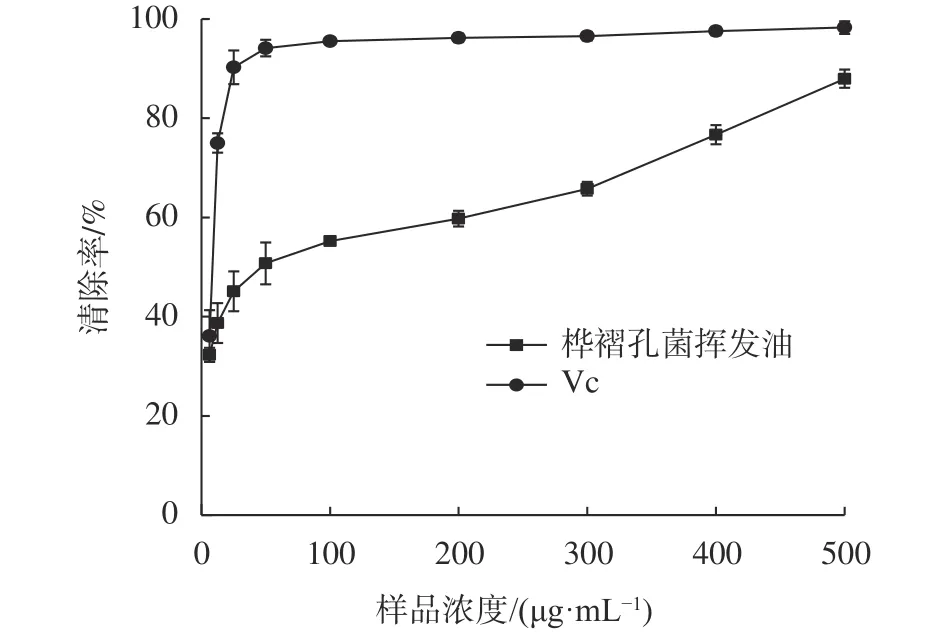
图2 桦褶孔菌挥发油浓度对O2−·清除效果的影响Fig. 2 Superoxide anion free radical scavenging capacity of volatile oils from L. betulina
2.2.3 桦褶孔菌挥发油对·OH的清除作用
由图3可知,在浓度为6.25~50 μg/mL之间,桦褶孔菌挥发油对·OH的清除能力远高于维生素C,当浓度为50 μg/mL时,桦褶孔菌挥发油对·OH的清除率为(42.98 ± 2.79)%,而此时维生素C的清除率仅有(7.33 ± 0.90)%。随着样品浓度的增加,桦褶孔菌挥发油对·OH的清除率明显低于维生素C。当浓度为500 μg/mL时,桦褶孔菌挥发油的清除率为(65.58 ± 4.84)%,低于相同浓度的维生素C(99.59 ± 0.20%)。由表2可知,桦褶孔菌挥发油清除·OH的EC50值为(185.26 ± 5.22)μg/mL,高于维生素C的EC50(71.96 ± 4.28)μg/mL。
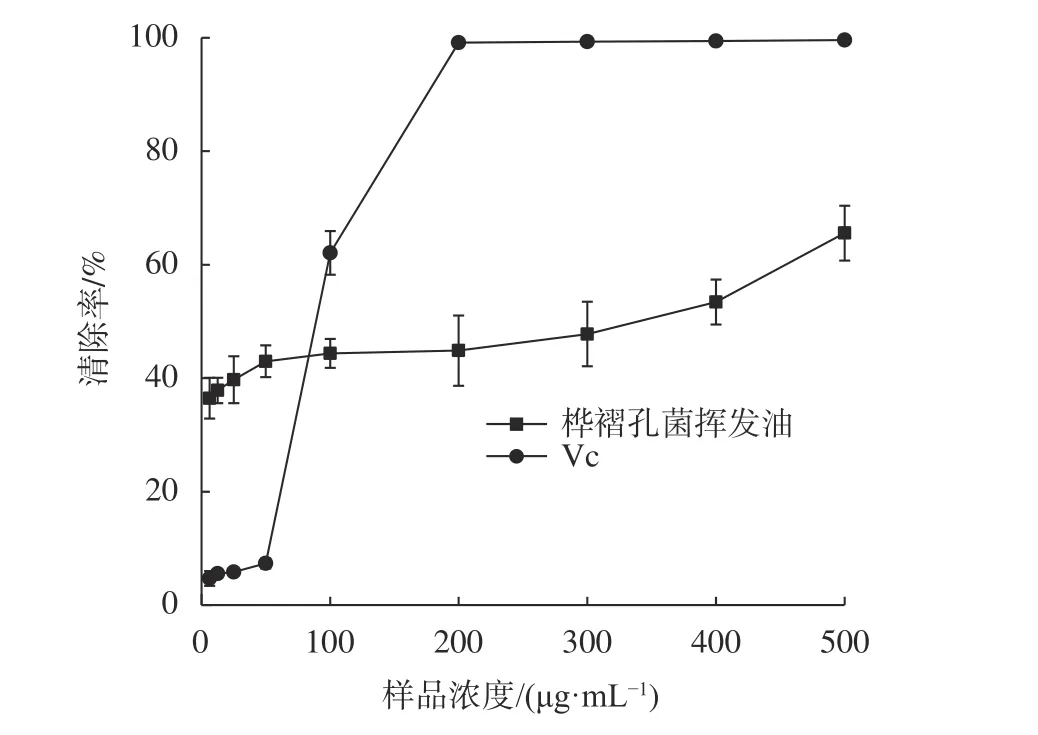
图3 桦褶孔菌挥发油对·OH的清除效果影响Fig. 3 Hydroxyl radical scavenging capacity of volatile oils from L. betulina
2.2.4 桦褶孔菌挥发油对ABTS+·的清除作用
由图4可知,桦褶孔菌挥发油对ABTS+·的清除率为2.94%~47.70%,且清除能力随浓度的增加而增大。在6.25~25 μg/mL范围内,桦褶孔菌挥发油和维生素C对ABTS+·的清除率相差不大,但浓度在50~500 μg/mL的增长过程中,维生素C对ABTS+·的清除率明显高于桦褶孔菌挥发油。从对ABTS+·的EC50值来看,桦褶孔菌挥发油的EC50为(687.63 ± 6.53)μg/mL,远高于Vc的EC50值(45.93 ± 3.83)μg/mL。
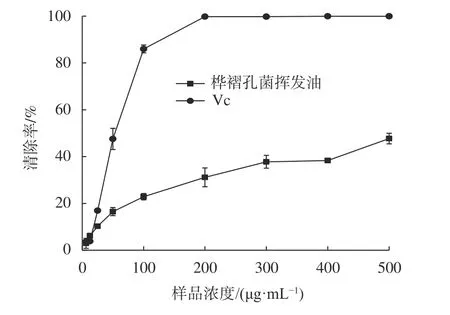
图4 桦褶孔菌挥发油对ABTS+·的清除作用Fig. 4 ABTS+· free radical scavenging capacity of volatile oils from L. betulina
2.3 桦褶孔菌挥发油的抑菌活性
由表3可知,桦褶孔菌挥发油对6种细菌均具有一定的抑菌效果,尤其对枯草芽孢杆菌的MIC值达到3.91 μg/mL。桦褶孔菌挥发油对6种细菌的抑制强度大小为 枯草芽孢杆菌>变形杆菌=大肠杆菌>四联球菌>铜绿假单胞菌=金黄色葡萄球菌金黄亚种。

表3 桦褶孔菌挥发油抑菌实验结果Table 3 Antibacterial test results of volatile oil from L. betulina
3 结论与讨论
本研究首次用GC−MS从桦褶孔菌挥发油中鉴定出31种化合物,包括19种烃类化合物、5种酯类化合物、2种脂肪酸类化合物、2种芳香族化合物、1种酚类化合物、1种烯烃类化合物和1种醚类化合物。亚油酸是挥发油中含量最高的,达到12.9%,其余含量较多的化合物为二十四烷(6.4%)、抗坏血酸二棕榈酸酯(4.5%)、9(11)−脱氢麦角甾醇苯甲酸酯(3.2%)、二十烷(2.3%)、二十一烷(2.3%)、2,4−二叔丁基苯酚(2.2%)、二(6−甲基庚基)邻苯二甲酸酯(1.8%)、3,6−二羟基胆烷酸(1.7%)、4−硝基苯基壬醚(1.6%)、2,6,10,14−四甲基十八烷(1.5%)、5−(2−甲基丙基)壬烷(1.4%)、5−丁基−壬烷(1.4%)、四十四烷(1.4%)、2−甲基十七烷(1.4%)、2,2−二甲基癸烷(1.3%)和2−苯−2−丁烯(1.2%)。
桦褶孔菌挥发油的抗氧化实验结果证明,其对DPPH·、O2−·、·OH和ABTS+·均具有较强的清除能力,且清除率与挥发油浓度间较好呈量效关系;桦褶孔菌挥发油对4种自由基清除率的EC50值分别为(115.81 ± 4.75)、(40.72 ± 3.71)、(185.26 ±5.22)、(687.63 ± 6.53)μg/mL,其中桦褶孔菌挥发油和维生素C对O2−·清除率的EC50值(5.39 ±1.69)μg/mL接近,远低于瞿麦挥发油和马尾松松针挥发油的EC50值。此外,抑菌实验结果也表明桦褶孔菌挥发油对多种细菌均具有较好的抑制效果,尤其对枯草芽孢杆菌的抑菌效果最佳(MIC仅为3.91 μg/mL)。研究结果表明桦褶孔菌挥发油具有作为天然抗氧化剂和抑菌剂的潜力,同时也为桦褶孔菌资源的综合开发与利用提供了数据支持。
