氮肥对镉胁迫下龙葵叶绿素含量和叶绿素荧光特性的影响
2021-12-11唐星林刘光正
唐星林 刘 斌 刘光正 王 莉 严 晶
(江西省林业科学院,江西 南昌 330032)
土壤重金属污染是我国面临的主要环境问题之一[1]。《全国土壤污染状况调查公报》[2]显示我国土壤总的点位超标率为16.1%,其中,镉(Cd)的点位超标率高达7.0%。土壤Cd易被植物吸收,并通过食物链传递给人或者动物,严重威胁着人类的健康[3]。Cd是植物非必需元素,其生物毒性很强[4]。研究表明,Cd胁迫会损害植物器官,抑制植物生长[5]。植物体内Cd过量积累会破坏生物膜[6],影响植物体内各种酶的活性[7]。Cd胁迫还会导致植物叶绿素含量、光系统Ⅱ(PSⅡ)量子转化效率、电子传递速率等降低,光合作用受到抑制,最终导致植物生物量下降[8]。氮素是植物生长所必需的大量元素。研究表明,Cd胁迫会减少植物对氮、磷等营养元素的吸收[9],而增施氮肥可以增强植物对Cd胁迫的抗性[10]。研究表明:合理施用氮肥能有效提高Cd胁迫下植物叶绿素含量,保护叶绿体结构,防止叶片出现失绿症[11-13];以增大PSⅡ反应中心光化学效率和电子传递速率[14-15],增强光合作用;进而缓解Cd对植物的毒害,提高植物生物量和Cd积累量[16]。此外,人们发现Cd胁迫下低中氮处理能有效提高叶绿素含量和PSⅡ实际光化学量子产量,但高氮处理没有显著的促进作用[17]。这说明氮肥对Cd胁迫的缓解作用还与氮肥施用浓度有关。
龙葵(Solanum nigrum)为茄科(Solanaceae)茄属(Solanum)多年生草本植物,是我国发现的Cd超积累植物,具有生物量大、适于刈割等特性,是实施土壤重金属植物修复的优良材料[18]。研究表明,氮肥对Cd胁迫下龙葵生长、抗氧化系统和Cd积累等均有显著促进作用[16,19]。光合生理是植物最重要的生理活动之一,研究施氮对Cd胁迫下龙葵光合生理的影响,可以更好地揭示氮肥在植物缓解Cd毒害过程中的作用。但Cd胁迫下施氮对龙葵叶绿素含量和PSⅡ功能的影响仍不清楚。叶绿素荧光参数可以反映逆境胁迫下叶片PSⅡ功能的改变情况,是研究植物光合生理特性与逆境胁迫关系的内在探针[20]。捕光色素分子内禀特性决定了叶片对光能的吸收、激发和转换等过程,可以反映叶片对光能的吸收与利用,同一植物在不同环境条件下具有不同的内禀特性[21]。为此,本研究以龙葵为试验材料,分析不同浓度氮添加对Cd胁迫下龙葵叶绿素含量、叶绿素荧光特性和捕光色素分子内禀特性等的影响,得出适宜的氮肥施用浓度,为进一步利用龙葵修复Cd污染土壤提供参考依据。
1 材料与方法
1.1 供试土壤
供试土壤为黄壤,取自江西省林业科学院试验基地,取土深度为0~20 cm。土壤风干、磨碎并过5 mm筛。将黄壤和泥炭按质量比1∶1均匀混合成试验种植土,其基本理化性质为pH值5.75、水解性氮53.7 mg/kg、有效磷95.0 mg/kg、速效钾110.0 mg/kg、有机质75.58 mg/kg。
1.2 试验设计
试验在江西省林业科学院科研大棚内进行。参考江西省农用土壤Cd污染现状[22]和魏朵花等[15]的研究进行Cd胁迫和施氮处理,采用完全随机区组试验设计,共设置5个处理(见表1)。其中,Cd浓度以Cd2+计。按设定浓度将重金属Cd2+以CdCl2·2H2O形式拌入种植土,并施入不同浓度的CO(NH2)2,充分混匀,平衡18 d后装入塑料花盆(上口径18 cm、下口径13 cm、高15 cm)。2019年5月28号,将饱满的龙葵种子用10 g/L KNO3溶液浸泡24 h,超纯水冲洗干净,播种于育苗穴盘中,育苗基质为泥炭,放置于江西省林业科学院科研大棚(28°45′N, 115°49′E)。待幼苗长出5片真叶后(萌发后20 d),选择长势一致的幼苗移栽到塑料花盆中进行试验处理,单株定植,每个处理重复6盆。在盆下放置塑料托盘,将渗漏液倒回盆中,防止污染物和营养物质损失。进行日常养护管理,试验期间不追施任何肥料。

表1 试验设计Table 1 Experimantal design mg/kg
1.3 试验方法
1.3.1 叶片色素含量的测定
叶绿素荧光参数测定结束后,取植物叶片,擦拭干净,采用打孔法测定叶片色素含量[23]。
1.3.2 叶绿素荧光参数测定
叶绿素荧光参数采用便携式脉冲调制叶绿素荧光仪PAM−2500(Walz,德国)测定。在Cd胁迫和施氮处理35 d后选取植株顶部生长旺盛的全展叶,测定其荧光诱导动力学参数。先将叶片暗适应30 min以上,打开测量光(小于1 μmol/(m2·s))测定初始荧光(Fo),再在饱和脉冲(脉冲强度为10 000 μmol/(m2·s),脉冲时间0.8 s)激发下测定最大荧光(Fm)。随后,叶片在光化光(光强为1 160 μmol/(m2·s))照射5 min以上,采用内置程序将光化光光合有效辐射(PAR)梯度设置为1 160、1 663、785、619、363、271、141、101、64、31、6 μmol/(m2·s),测定光下稳态荧光(Fs)、光下最大荧光(Fm′)和光下最小荧光(Fo′),每个光化光梯度照射30 s。计算参数:PSⅡ最大光化学量子产量(Fv/Fm)、PSⅡ有效光化学量子产量(Fv′/Fm′)、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)和电子传递速率(ETR)、天线热耗散(D)、光化学反应耗散(PH)和非光化学反应耗散(E)[24-25]。每个处理随机选择3株进行测定。
1.3.3 光合电子流对光响应的机理模型模拟
利用光合电子流机理模型拟合龙葵光合电子流对光响应的曲线,得出初始斜率(a)、最大电子传递速率(ETRmax)和饱和光强(PARsat),以及描述捕光色素分子物理特性的参数(捕光色素分子数(N0)、处于最低激发态的捕光色素分子数(Nk)、捕光色素分子本征光能吸收截面(σik)、捕光色素分子有效光能吸收截面(σik′)),模型的拟合效果用决定系数(R2)表示[26-27]。
1.4 分析方法
光合电子流对光的响应曲线基于光合计算平台(http://photosynthetic.sinaapp.com/)进行处理。采用单因素方差分析和Tukey HSD法对试验数据进行方差分析和差异显著性检验(P<0.05)。数据处理和作图由R语言(R−3.5.1)完成。图和表中的数据为平均值±标准误差。
2 结果与分析
2.1 不同施氮量对Cd胁迫下龙葵叶片色素含量的影响
由表2可知,与CK相比,Cd胁迫下龙葵叶绿素a、叶绿素b、类胡萝卜素含量和N0无显著变化,但均有下降趋势。Cd胁迫下龙葵σik显著大于CK(P<0.05)。与CdN0相比,CdN1、CdN2和CdN3龙葵叶绿素a含量分别显著增大了52.5%、87.6%和102.2%(P<0.05),叶绿素b含量分别显著增大了60.5%、92.0%和105.8%(P<0.05),类胡萝卜素含量分别显著增大了53.2%、83.3%和91.6%(P<0.05),N0分别显著增大了68.9%、137.4%和94.5%,σik分别显著减少了37.3%、52.1%和58.7%(P<0.05)。龙葵叶绿素a、叶绿素b、类胡萝卜素含量、N0、σik在CdN2与CdN3处理间无显著差异。这说明Cd胁迫下增施氮肥对龙葵叶片色素含量和捕光色素分子数有显著的促进作用。

表2 氮肥对Cd胁迫下龙葵叶片色素含量的影响Table 2 Effects of nitrogen supply on pigment contents of S. nigrum under cadmium stress
2.2 氮肥对Cd胁迫下龙葵叶绿素荧光参数的影响
表3中光下叶绿素荧光参数均采用1 663 μmol/(m2·s) PAR下测定的数据。与CK相比,Cd胁迫下龙葵Fv/Fm、Fv′/Fm′和ETR无显著变化,但均有下降趋势。CdN2、CdN3处理下龙葵Fv/Fm、Fv′/Fm′显著大于CdN0(P<0.05),NPQ显著小于CdN0(P<0.05)。CdN3处理下龙葵qP显著大于CdN0(P<0.05)。不同处理间ETR的大小顺序为CdN3>CdN2>CdN1>CdN0、CK(P<0.05)。Cd龙葵Fv/Fm、Fv′/Fm′、qP、NPQ在CdN2与CdN3处理间(或CdN1与CdN0处理间)均无显著差异。

表3 氮肥对Cd胁迫下龙葵叶绿素荧光参数的影响Table 3 Effects of nitrogen supply on chlorophyll fluorescence parameters of S. nigrum under cadmium stress
2.3 氮肥对Cd胁迫下龙葵快速光曲线的影响
由图1可知,不同处理下龙葵叶片ETR随PAR的增大而逐渐增大。当PAR<800 μmol/(m2·s)时,ETR几乎呈线性增加,当PAR>800 μmol/(m2·s)时,ETR呈缓慢增大。当PAR<141 μmol/(m2·s)时,不同处理间ETR差异不显著。当PAR>141 μmol/(m2·s)时,Cd胁迫下施氮处理ETR显著大于CK和CdN0处理(P<0.05)。
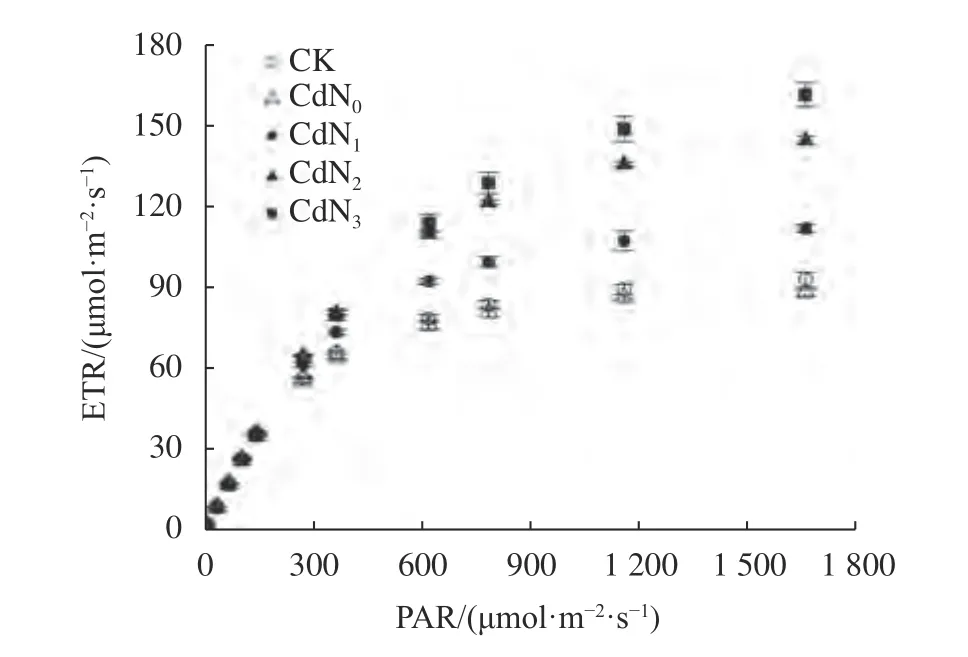
图1 Cd胁迫下增施氮肥龙葵ETR光响应曲线Fig. 1 Light-response curves of ETR in S. nigrum under cadmium stress by supplement nitrogen
由表4可知,龙葵a、ETRmax和PARsat在不同处理间均存在显著差异(P<0.05)。与CK相比,Cd胁迫下龙葵ETRmax和PARsat无显著变化,但均有所减小。不同处理间a的大小顺序为CK、CdN0、CdN1>CdN2>CdN3,ETRmax的大小顺序为CdN3>CdN2>CdN1>CdN0、CK。CdN3的PARsat显著大于CdN0(P<0.05)。

表4 氮肥对Cd胁迫下龙葵叶片a、ETRmax和PARsat光合参数的影响Table 4 Effects of nitrogen supply on a, ETRmax, and PARsat of S. nigrum under cadmium stress
2.4 氮肥对Cd胁迫下龙葵捕光色素分子内禀特性的影响
由图2可知,随PAR的增大,不同处理下龙葵叶片Nk逐渐增大,σik′逐渐减小。与CK相比,Cd胁迫下Nk有增大趋势,σik′有减小趋势。Cd胁迫下增施氮肥导致Nk增大,σik′减小。CdN2的Nk高于CdN1、CdN3。CdN3的σik′低于CdN1、CdN2。
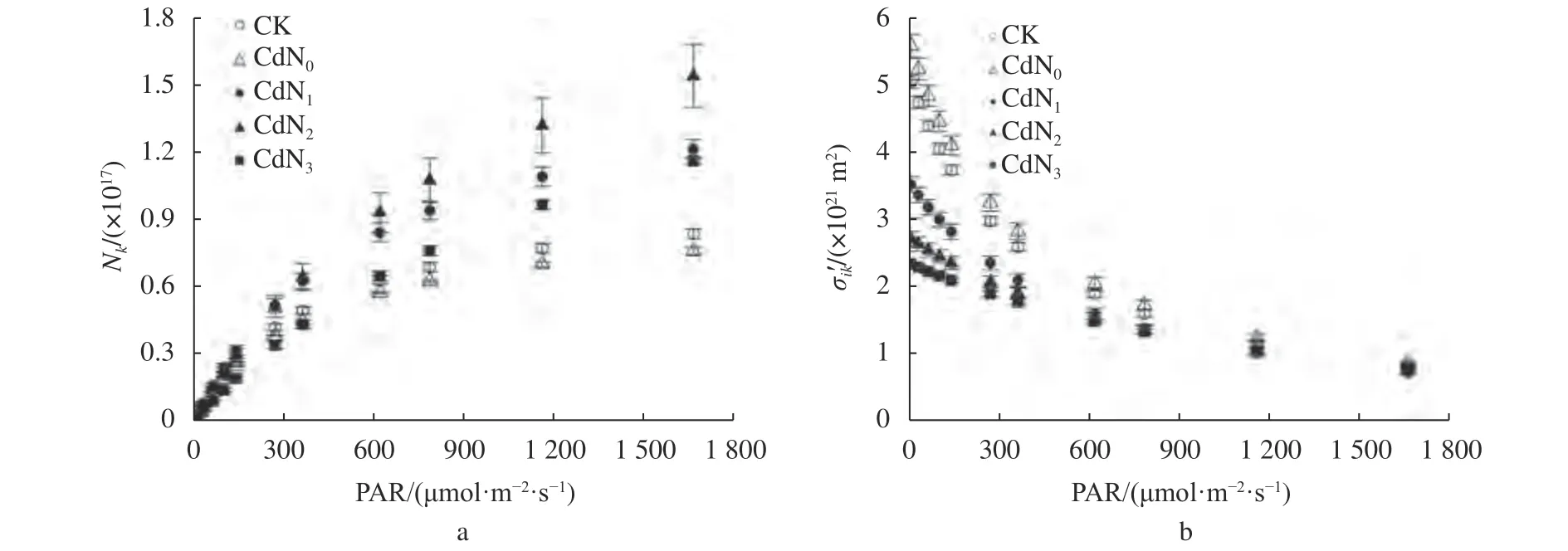
图2 Cd胁迫下增施氮肥龙葵叶片Nk和σik′的光响应曲线Fig. 2 Light-response curves of Nk and σik′ for S. nigrum under cadmium stress by supplement nitrogen
2.5 叶片吸收光能的分配
由图3可知,随着PAR的增加,不同处理龙葵叶片D和E分别从(26.8%~30.3%)、(0.6%~3.4%)增加到(40.2%~53.7%)、(33.7%~39.3%),PH从(12.6%~23.2%)减小到(69.0%~70.2%)。PAR≤363 μmol/(m2·s)时不同处理下龙葵叶片吸收光能的分配均表现为PH>D>E,当PAR≥1 160 μmol/(m2·s)时表现为D>E>PH。当PAR=619 μmol/(m2·s)时,CK、CdN0和CdN1处理表现为D>PH>E,CdN2和CdN3处理为PH>D>E。
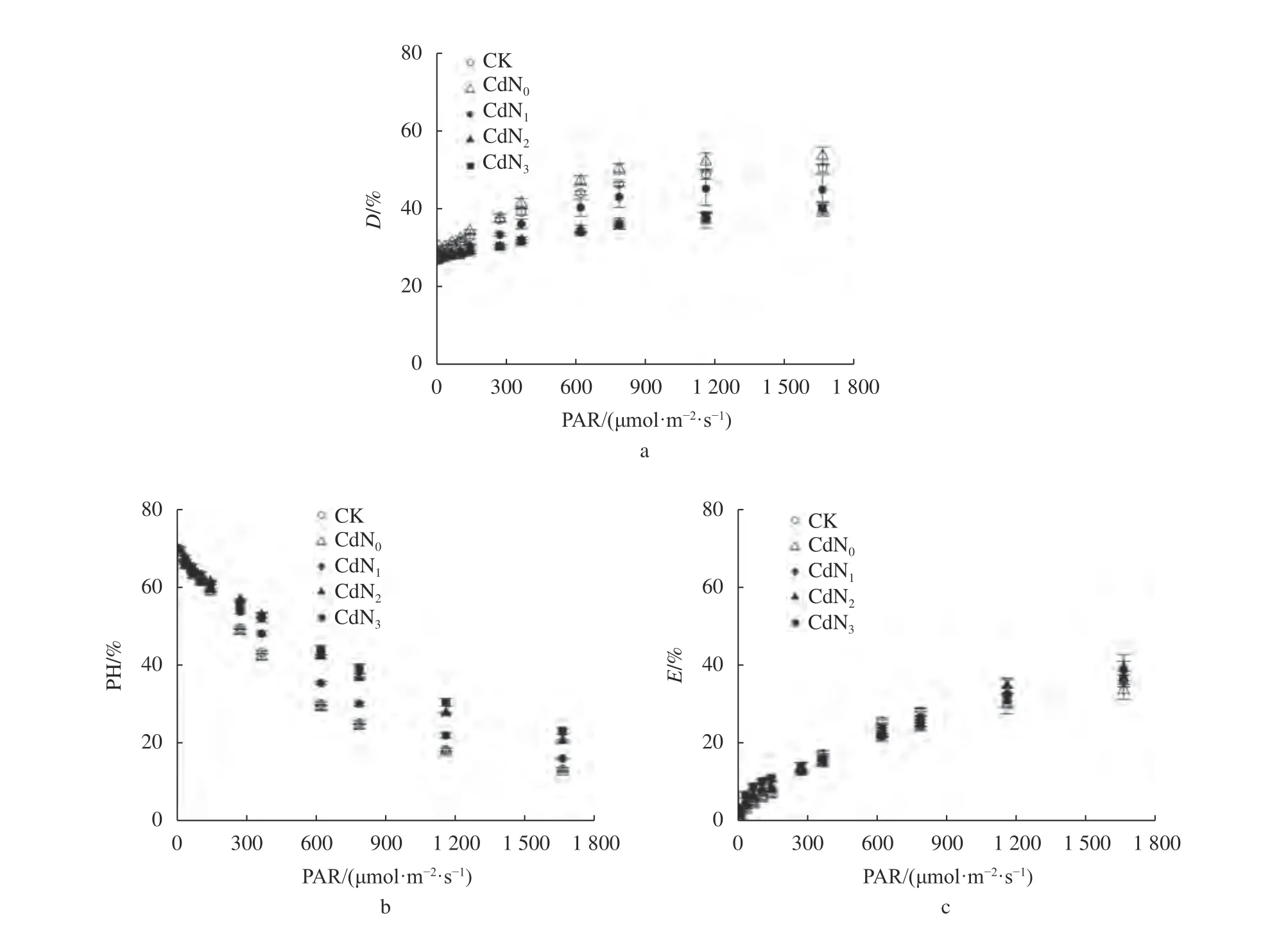
图3 Cd胁迫下增施氮肥龙葵叶片D、PH和E的光响应变化Fig. 3 Light-response curves of thermal energy dissipation, photochemical reaction and non-photochemical energy dissipation in S. nigrum under cadmium stress by supplement nitrogen
表5所示为饱和光强下龙葵叶片吸收光能的分配情况。在1 663 μmol/(m2·s) PAR下,龙葵叶片吸收的光能有40.0%~53.7%用于天线热耗散,12.6%~23.2%用于光化学反应,33.7%~39.3%用于非光化学反应。在1 663 μmol/(m2·s) PAR下,龙葵D和PH在不同处理间差异显著(P<0.05),E无显著差异。与CK相比,Cd胁迫下龙葵D、PH和E无显著变化,但D有增大趋势,PH和E有减小趋势。CdN2、CdN3处理下龙葵D显著小于CdN0(P<0.05)。不同处理间PH的大小顺序为CdN3>CdN2>CdN1>CdN0、CK(P<0.05)。
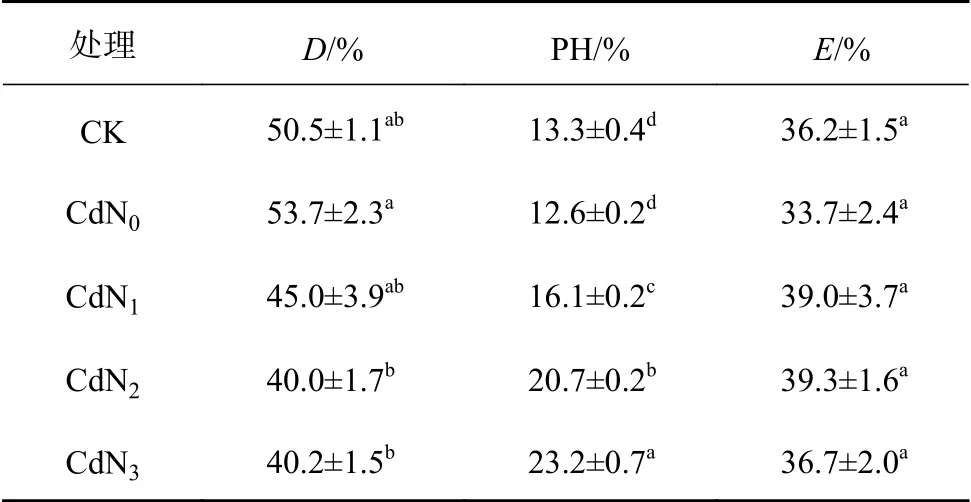
表 5 氮肥对Cd胁迫下龙葵叶片吸收光能分配的影响Table 5 Effects of nitrogen supply on distribution of absorbed light energy in S. nigrum under cadmium stress
3 结论与讨论
光合色素是叶片进行光合作用所必需的物质,主要包括叶绿素和类胡萝卜素。其中,叶绿素在光能的吸收、传递和转化过程中起主导作用,类胡萝卜素则参与光能捕获和光破坏防御过程[28]。重金属胁迫会抑制叶片光合色素的合成,进而影响植物光合作用[29]。本研究发现Cd胁迫下龙葵叶绿素和类胡萝卜素含量均呈现下降趋势,这与苍耳(Xanthium sibiricum)[30]和洋常春藤(Hedera helix)[20]等植物的研究结果类似。对Cd胁迫导致叶片色素含量下降的原因,主要有3种观点:一是Cd胁迫影响Fe、Zn、Mg等营养元素的吸收,Cd2+取代叶绿素中的Mg2+而导致叶绿素破坏[31-32];二是Cd胁迫抑制叶绿素合成酶活性,增大叶绿素降解酶活性[33-34];三是Cd抑制了叶绿素合成前体物氨基乙酰丙酸(ALA)的合成[32]。研究表明,Cd胁迫下增施氮肥后,龙葵叶绿素和类胡萝卜素含量显著增加,这与结缕草(Zoysia japonica)[16]和小麦(Triticum aestivum)[12]等植物的研究结果一致。氮素能有效促进叶片色素的合成[35],这可以平衡Cd胁迫对叶片色素的抑制作用。张帆等认为Cd胁迫下增施氮肥可以解除Cd对叶绿素合成的抑制[13]。这说明增施氮肥可能通过促进叶绿素合成来提高龙葵的抗Cd能力。
PSⅡ反应中心是一个对重金属胁迫比较敏感的光合机构[36],叶绿素荧光参数可以反映重金属胁迫对PSⅡ光合活性及电子传递等功能的影响[37]。有研究表明,Cd胁迫会抑制叶片PSⅡ光化学功能[38],而氮素有助于提高PSⅡ的光化学活性[39]。Fv/Fm可以反映植物是否受到逆境胁迫。本研究表明,Cd胁迫下龙葵叶片Fv/Fm呈下降趋势,说明龙葵受到一定程度的Cd胁迫。而Cd胁迫下增施氮肥使得龙葵Fv/Fm显著增大,这说明施氮可以有效缓解Cd对龙葵的胁迫作用。Fv′/Fm′反映开放的PSⅡ反应中心原初光能捕获效率,NPQ反映PSⅡ天线色素吸收的光能以热能形式耗散的部分,对光合机构起保护作用[25]。本研究发现Cd胁迫下龙葵叶片Fv′/Fm′、ETR下降,NPQ增大,说明Cd胁迫下龙葵叶片PSⅡ光合反应中心实际量子产量下降,PSⅡ向PSI的电子传递受阻,使得同化力(NADPH和ATP)形成受阻,PSⅡ过剩光能增加,非光化学淬灭保护机制发挥作用,这与紫花香薷(Elsholtzia argyi)[40]和结缕草[16]等植物的研究结果一致。而Cd胁迫下增施氮肥后龙葵Fv′/Fm′、ETR上升,NPQ减小,说明氮肥能有效缓解Cd胁迫对PSⅡ功能的影响,提高叶片光能捕获效率和电子传递速率,增加同化力(NADPH和ATP)的形成,为固碳反应提供更多的能量,进而增强对Cd毒害的抵抗能力。
叶片的光能吸收能力同时受N0、σik和σik′的影响,其中,光能吸收截面反映捕光色素分子吸收光子的能力[26]。叶片捕光色素分子在吸收光能后会从基态跃迁到激发态,激发态的捕光色素分子通过光化学反应、叶绿素荧光和热能等3种方式退回基态[41]。因此,处于激发态的捕光色素分子越多,处于基态的捕光色素分子就越少,不利于叶片光能的吸收[26]。本研究发现Cd胁迫下龙葵N0、Nk减小,σik、σik′增大,说明Cd胁迫下龙葵在捕光色素分子总数下降的情况下,可以通过增大捕光色素分子光子吸收能力和处于基态的捕光色素分子的比例来提高植物对光能的吸收。而Cd胁迫下增施氮肥使得龙葵N0、Nk增大,σik和σik′减小。这可能是由于Cd胁迫下施氮使得捕光色素分子总数增大,植物通过减小其捕光色素分子光能吸收能力和处于基态的捕光色素分子数的比例,以防止叶片吸收过量光能。叶片吸收光能的3个耗散途径为D、PH和E[21]。D是指植物用于光合生化反应的能量。其余过剩的光能主要通过PH和E来消耗,防止其对光合机构的破坏[42]。有研究表明,Cd胁迫使得桢楠幼树E增大,D和PH减少[42]。本研究发现Cd胁迫下龙葵D有增大趋势,PH和E有减小趋势,而增施氮肥后D显著减小,PH显著增大。其中,光化学耗散能量增大可能与叶绿素含量、Fv′/Fm′和ETR等的增大有关,说明Cd胁迫下增施氮肥有利于提高叶片吸收光能用于光化学反应的比例,增大叶片吸收光能的利用效率。
综上所述,增施氮肥有助于提高Cd胁迫下龙葵叶片叶绿素含量、捕光色素分子总数、Fv/Fm、Fv′/Fm′、ETR、Nk和PH等光合生理指标,缓解Cd胁迫对PSⅡ功能和吸收光能分配的影响,进而增强龙葵对Cd胁迫的抗性,而且施加300 mg/kg CO(NH2)2对Cd胁迫下龙葵叶绿素合成和PSⅡ功能的促进作用大于施加150 mg/kg CO(NH2)2,但与施加450 mg/kg CO(NH2)2无明显差异,因此,300~450 mg/kg CO(NH2)2是合适的施氮浓度,为进一步揭示氮肥对Cd胁迫下龙葵光合生理的影响机制及Cd污染土壤的治理实践提供参考。
