嘉宝果果皮多酚提取工艺优化及生物活性测定
2021-12-09林宝妹邱珊莲吴妙鸿张帅李海明洪佳敏
林宝妹 邱珊莲 吴妙鸿 张帅 李海明 洪佳敏

摘要:以嘉宝果果皮为原料,在单因素试验的基础上采用L9(34)正交试验设计,优化嘉宝果果皮多酚提取工艺,并测定提取物清除·OH、DPPH·和ABTS+自由基的能力以及体外对α-葡萄糖苷酶和α-淀粉酶的抑制活性。结果表明,嘉宝果果皮多酚提取的最佳工艺为乙醇体积分数70%、时间50 min、温度70 ℃、料液比1 g ∶50 mL,此条件下嘉宝果果皮多酚的提取率可达10.10%。优化提取后的嘉宝果果皮提取物对·OH、DPPH·和ABTS+自由基的EC50值分别为0.506、0.052、0.437 mg/mL,对α-葡萄糖苷酶和α-淀粉酶的IC50值分別为0.003、1.348 mg/mL,说明嘉宝果果皮具有良好的抗氧化及体外降糖活性,可作为功能活性成分开发应用。
关键词:多酚;嘉宝果;正交试验;抗氧化;降糖活性
中图分类号: S663.901;TS255.36 文献标志码: A
文章编号:1002-1302(2021)21-0191-05
收稿日期:2021-03-22
基金项目:福建省公益类科研院所专项(编号:2019R1030-4);福建省自然科学基金(编号:2020J01141638)。
作者简介:林宝妹(1988—),女,福建漳州人,硕士,助理研究员,主要从事天然产物化学研究。E-mail:yogobm@qq.com。
通信作者:邱珊莲,博士,副研究员,主要从事天然产物化学研究。E-mail:slqiu79@163.com。
嘉宝果(Myrciaria cauliflora)为桃金娘科常绿灌木,是巴西当地一种常见的可食用浆果,年产量可达5 000 t,目前在福建、广东、广西等多省均有种植[1-2]。嘉宝果果实富含蛋白质、糖类、脂肪、纤维、灰分等多种营养成分以及锌、锰、铜等矿质元素及微量元素,营养价值较高[1,3]。嘉宝果果皮呈紫黑色,含有多种多酚类化合物如花青素(飞燕草素-3-O-葡萄糖苷和矢车菊素-3-O-葡萄糖苷)、鞣花酸、芸香苷、没食子酸、杨梅苷、槲皮素和异槲皮素等[4-5],具有多种生物活性如抗氧化[6]、降血脂[7]、降血糖[8]、抗炎[9]等。研究表明,嘉宝果果皮的生物活性与多酚含量呈显著正相关,即多酚含量越高,相应的生物活性越强。Lamas等研究发现,嘉宝果果皮提取物可通过增加前列腺组织中健康上皮组织的面积、减少分化腺癌灶数量、缓解上皮萎缩、降低纤维肌性组织层厚度从而减轻老龄化小鼠前列腺组织损伤,且该活性随提取液中花青素、鞣花酸、芸香苷等多酚含量的增加而增强[4]。嘉宝果果皮提取物按照不同剂量灌胃处理高脂饮食小鼠 60 d,结果发现,嘉宝果果皮提取物呈剂量依赖性地降低高脂饮食小鼠体质量、改善血脂异常(总胆固醇和低密度脂蛋白含量降低、高密度脂蛋白含量升高)、改善糖耐量,减轻胰岛素抵抗,从而改善前驱糖尿病和非酒精性脂肪肝病症的高血糖和脂质代谢紊乱症状[10]。邱珊莲等研究发现,嘉宝果果皮清除DPPH·、ABTS+、·OH等自由基的能力以及体外抑制α-葡萄糖苷酶活性与果皮提取物的总多酚含量呈显著正相关(P<0.05)[8]。但是,多数关于嘉宝果果皮生理活性的研究采用果皮冻干粉直接添加或者简单浸提的处理方法[6-7,11],极少对果皮多酚的提取工艺进行优化。本研究在单因素试验的基础上采用正交试验对嘉宝果果皮浸提工艺进行优化,并测定了果皮提取物的抗氧化和体外降糖活性,以期为嘉宝果果皮多酚提取物的加工利用提供理论参考。
1 材料与方法
1.1 试验材料
嘉宝果成熟果实采自福建省农业科学院亚热带农业研究所国家闽台特色作物种质资源圃,供试品种为沙巴。
1.2 仪器与设备
L5S紫外可见分光光度计(上海仪电分析仪器有限公司,中国),iMARK酶标仪(Bio-Rad,美国),HH·S21-8-S型恒温水浴锅(上海新苗医疗器械制造有限公司,中国),WBL2521H型粉碎机(佛山美的集团,中国),MIKRO-22R冷冻高速离心机(Hettich,德国),GZX-9246MBE型电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂,中国)。
1.3 试验方法
1.3.1 嘉宝果果皮制备 嘉宝果成熟果实除去籽和果肉,将果皮置于60 ℃热风干燥箱中烘干至恒质量,粉碎后过40目筛,备用。
1.3.2 总多酚含量测定 采用福林酚法测定提取物中的总多酚含量[12]。以没食子酸为标准品,配制质量浓度范围为0.01、0.02、0.04、0.06、0.08 mg/mL的标液、0.1 mol/L的福林酚试剂和7.5%碳酸钠溶液备用。依次取0.5 mL标液或样品、2.5 mL 福林酚试剂和2.0 mL 碳酸钠溶液,混匀后于45 ℃恒温水浴锅中水浴15 min,结束后于765 nm波长处测定吸光度,以没食子酸质量浓度为x值,吸光度为y值绘制回归曲线。嘉宝果果皮多酚提取率用每克干燥果皮中所含没食子酸的质量分数进行计算,单位为%。
1.3.3 单因素试验 称取适量果皮粉末于50 mL圆底离心管中,采用热浸提的方法,选取不同乙醇体积分数(40%、50%、60%、70%、80%、90%)、不同料液比(1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50、1 ∶60,单位g ∶mL)、不同提取温度(30、40、50、60、70、80 ℃)、不同提取时间(20、30、40、50、60 min)等因素进行试验,分析各因素对多酚提取率的影响。
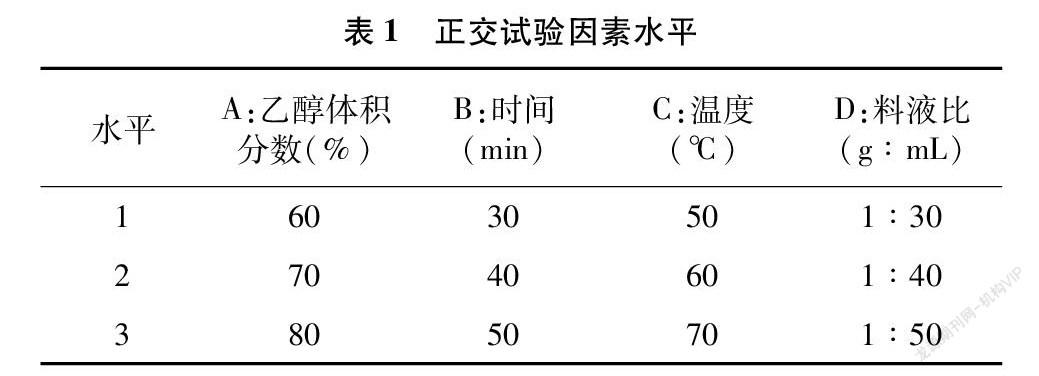
1.3.4 正交试验 在单因素试验的基础上,以乙醇体积分数、料液比、时间和温度为试验考查因素,以总多酚提取率为评价指标,设计L9(34)正交试验(表1),优化多酚提取工艺。
1.3.5 抗氧化试验 参照林宝妹等的方法[13],以抗坏血酸为对照品,测定果皮多酚提取物对 DPPH·、ABTS+和·OH等3种自由基的清除能力,以各类自由基的半数清除浓度(EC50值)表示。果皮多酚质量浓度以单位体积提取液所含原材料质量计,单位为mg/mL。
1.3.6 体外降糖试验 参照林宝妹等的方法[14],建立体外消化酶反应体系,以阿卡波糖为对照品,测定果皮多酚提取物对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用,并稍作修改。
1.3.6.1 α-葡萄糖苷酶抑制作用 配制 0.4 U/mL α-葡萄糖苷酶、3.0 mmol/L PNPG和0.2 mol/L 碳酸钠溶液备用。取10 μL适当稀释的样品和10 μL α-葡萄糖苷酶加入96孔板,混匀后,37 ℃反应 10 min,再加入50 μL PNPG继续反应 20 min,最后加入100 μL 碳酸钠溶液终止反应,测定在405 nm波长处的吸光度(D1),并测定对照组(未加样品)吸光度(D2)和溶剂对照组吸光度(D3)。按照公式(1)计算α-葡萄糖苷酶活性抑制率,并通过绘制回归曲线计算酶活性被抑制50%时的多酚提取物及阿卡波糖质量浓度(IC50值)。果皮多酚提取物质量浓度以单位体积提取物所含原材料质量计,单位为mg/mL。
α-葡萄糖苷酶抑制率=[(D2-D1)/(D2-D3)]×100%。(1)
1.3.6.2 α-淀粉酶抑制作用 配制0.25 mg/mL α-淀粉酶和0.5%淀粉溶液备用。取200 μL适当稀释的样品和100 μL α-淀粉酶于玻璃试管中混匀并于25 ℃恒温水浴5 min,再加入200 μL 淀粉溶液作为反应底物,混匀后继续水浴10 min,再加入 0.4 mL DNS,立即沸水浴5 min,自然冷却至室温后加入5 mL超纯水稀释,于540 nm 处测吸光度(D1),并测定对照组(未加样品)吸光度(D2)和溶剂对照组吸光度(D3)。按照“1.3.6.1”节方法计算多酚提取物及阿卡波糖对α-淀粉酶的IC50值。
1.3.7 数据处理 利用Excel软件统计各参数的平均值和标准误差并作图,采用DPS软件进行统计检验分析。
2 结果与分析
2.1 总多酚标准曲线
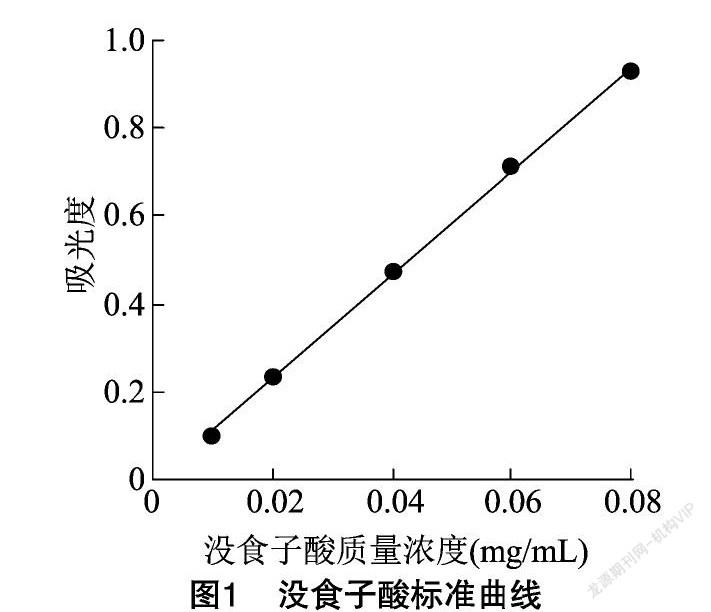
以没食子酸为标准品,在试验所设质量浓度范围内测得吸光度并建立回归方程:y=11.824x-0.008(r2=0.999 2),其中y为吸光度,x为没食子酸质量浓度(图1)。没食子酸在试验所设质量浓度范围内与吸光度有良好的线性关系。
2.2 单因素试验结果
2.2.1 乙醇体积分数对总多酚提取率的影响 由图2可知,随着乙醇体积分数的增加,果皮总多酚提取率呈先上升后下降趋势。当乙醇体积分数为40%~70%时,果皮总多酚提取率逐渐上升,于乙醇体积分数70%时达到最大提取率8.40%;当乙醇体积分数70%~90%时,果皮总多酚提取率迅速下降,低至4.25%,约为最大提取率的一半。研究表明,嘉寶果果皮提取物总多酚主要存在于乙酸乙酯部位和正丁醇部位[15],果皮多酚具有一定的极性,根据相似相容原理,70%乙醇可能与果皮多酚极性最接近,总多酚的溶出量最多[16]。因此,选择70%为最佳乙醇体积分数。
2.2.2 料液比对总多酚提取率的影响 以70%乙醇为提取溶剂,考察料液比对总多酚提取率的影响。由图3可知,当溶剂使用量从10 mL/g增加至 40 mL/g 时,果皮多酚的提取率从7.34%上升至最大8.44%;继续增加溶剂使用量,果皮多酚的提取率呈不断下降趋势。提取所用溶剂对果皮多酚的溶解度有限,增加溶剂用量可在一定程度上增加果皮多酚的溶出,料液比1 g ∶40 mL时可能已经达到溶剂对果皮多酚的溶出极限,继续增加提取溶剂一方面造成溶剂浪费,另一方面可能会溶出其他非酚类杂质而降低多酚纯度,或与已经溶出的多酚结合从而降低提取率[17]。因此,选择1 g ∶40 mL为最佳料液比。
2.2.3 温度对总多酚提取率的影响 由图4可知,在设定的提取温度范围内,随着温度上升,果皮多酚提取率呈先上升后下降趋势,在30~60 ℃温度范围内,果皮多酚提取率呈近直线升高,至60 ℃温度处,提取率达最大值9.21%,继续提高温度,果皮多酚提取率逐渐趋于平稳并有下降趋势。这可能是因为升高温度可在一定范围内提高溶剂的溶解度,增加果皮多酚的溶出,从而提高提取率;其次,温度升高,分子运动加快,促进酚类物质的溶出,在一定的提取时间内溶出的果皮多酚增加,提取率上升[18]。但是当温度上升至80 ℃时,果皮多酚提取率反而下降,这可能是因为温度过高导致溶剂挥发,从而使溶剂量减少,同时温度过高也容易造成多酚氧化,二者均可造成提取率降低[19]。因此,选择60 ℃为最佳温度。
2.2.4 时间对总多酚提取率的影响 由图5可知,当提取时间从20 min延长至40 min时,果皮多酚的提取率逐渐上升,在40 min时达到最高,继续增加提取时间,提取率反而逐渐降低。在试验范围内,果皮多酚提取率随时间呈先上升后下降趋势,可能是因为在多酚溶出速率一定的条件下,延长提取时间可增加多酚溶出量,提高提取率;但当多酚溶出达到平衡后,因为多酚结构的不稳定性,长时间浸提可能会破坏多酚结构,从而降低提取率[20]。因此,选择40 min为最佳提取时间。
2.3 正交试验结果
根据单因素试验结果,并结合正交试验法,对提取工艺进行优化,结果见表2。由极差结果可知,各因素对果皮多酚提取率的影响从大到小依次为温度>乙醇体积分数>时间>料液比,果皮多酚的最佳提取工艺为A2B3C3D3,即乙醇体积分数70%,时间50 min,温度70 ℃,料液比1 g ∶50 mL。对极差结果得出的最佳提取工艺进行验证,经过3次平行试验,在最佳提取工艺条件下,果皮多酚的平均得率为10.10%,高于正交试验中各试验的提取率,说明最佳工艺合理。
以极差值最小的D因素为空白方差,进行方差分析和显著性检验,进一步分析各因素对果皮多酚提取率的影响。由表3可知,乙醇体积分数和温度显著影响果皮多酚的提取效果(P<0.05)。
2.4 抗氧化活性
由表4可知,在試验所设质量浓度范围内,果皮多酚提取物对DPPH·、ABTS+、·OH等3种自由基的清除作用与提取物质量浓度呈良好的对数曲线关系。比较果皮多酚提取物对3种不同自由基的EC50值发现,果皮多酚提取物对DPPH·自由基的清除能力最强,对·OH自由基的清除能力最弱,该结果与苦菜多酚[21]、紫果西番莲叶多酚[22]、牛肝菌多酚提取物[23]等提取物相似,对DPPH·自由基的清除能力均高于·OH自由基。这可能是因为不同自由基反应机理不同导致同一抗氧化剂对不同自由基清除活性存在差异[15]。研究表明,·OH自由基是人体内高活性的氧自由基,清除体内多余的氧自由基可以延缓衰老,减少疾病及其并发症发生[24]。通过比较果皮多酚提取物与抗坏血酸对3种自由基的EC50值发现,抗坏血酸对DPPH·和ABTS+等2种自由基的清除能力虽然高于果皮多酚提取物,但是对·OH自由基的清除能力则远低于果皮多酚提取物。此外果皮多酚提取物虽对以上3种自由基清除能力各有不同,但EC50值均低于 10 mg/mL,说明其具有良好的抗氧化活性[18]。
2.5 体外降糖活性
由表5可知,在试验所设质量浓度范围内,果皮多酚提取物对α-葡萄糖苷酶和α-淀粉酶活性的抑制作用与提取物质量浓度呈良好的对数曲线关系。结果表明,果皮多酚对α-葡萄糖苷酶的IC50值(0.003 mg/mL)远低于阿卡波糖(12.158 mg/mL),IC50值越低,抑制活性越强,说明果皮多酚提取物对α-葡萄糖苷酶具有极好的抑制作用,是一种理想的α-葡萄糖苷酶抑制剂。与阿卡波糖相比,果皮多酚提取物对α-淀粉酶的抑制作用较弱,其IC50值约为阿卡波糖的7.5倍,说明果皮多酚提取物对以上2种消化酶的抑制作用具有选择性。该试验结果与多种植物提取物不同,例如苦丁茶多酚对α-葡萄糖苷酶和α-淀粉酶的IC50值分别为1.15、1.31 mg/mL[25],白豆提取物为5.9、4.2 mg/mL[26],枣核多酚提取物为6.16、9.81 mg/mL[27],这些植物提取物对以上2种消化酶的IC50值较为接近,即对这2种酶的抑制选择性较差。而嘉宝果果皮多酚提取物可以在选择性抑制α-葡萄糖苷酶时对α-淀粉酶无抑制作用,该特性可用于开发选择性α-葡萄糖苷酶抑制剂。
3 结论
本研究以沙巴品种嘉宝果果皮为原料,通过单因素和正交试验,采用乙醇热浸提的方法提取嘉宝果果皮总多酚,优化后的嘉宝果果皮多酚提取工艺为乙醇体积分数70%、时间50 min、温度70 ℃、料液比1 g ∶50 mL,在此条件下,果皮总多酚的提取率可达到10.10%。各因素对果皮总多酚提取率的影响作用大小表现为温度>乙醇体积分数>时间>料液比。优化提取后的嘉宝果果皮多酚提取物具有良好的抗氧化活性,其对羟自由基的清除能力高于抗坏血酸,具有天然抗氧化剂开发价值;同时嘉宝果果皮多酚提取物具有一定的α-葡萄糖苷酶和α-淀粉酶活性抑制作用,并且其对α-葡萄糖苷酶的抑制作用具有选择性,具有辅助降血糖药开发价值。
参考文献:
[1]唐 丽,袁婷婷,钟秋平. 嘉宝果营养成分分析[J]. 经济林研究,2014,32(2):120-124.
[2]Massa N M L,Menezes F N D D,de Albuquerque T M R,et al. Effects of digested jabuticaba [Myrciaria jaboticaba (Vell.) Berg] by-product on growth and metabolism of Lactobacillus and Bifidobacterium indicate prebiotic properties[J]. LWT,2020,131:109766-109773.
[3]Alezandro M R,Dube P,Desjardins Y,et al. Comparative study of chemical and phenolic compositions of two species of jaboticaba:Myrciaria jaboticaba (Vell.) Berg and Myrciaria cauliflora (Mart.) O. Berg[J]. Food Research International,2013,54(1):468-477.
[4]Lamas C A,Kido L A,Montico F,et al. A jaboticaba extract prevents prostatic damage associated with aging and high-fat diet intake[J]. Food and Function,2020,11(2):1547-1559.
[5]Zhao D K,Shi Y N,Petrova V,et al. Jaboticabin and related polyphenols from jaboticaba (Myrciaria cauliflora) with anti-inflammatory activity for chronic obstructive pulmonary disease[J]. Journal of Agricultural and Food Chemistry,2019,67(5):1513-1520.
[6]Araújo C R R,de Mello Silva T,Lopes M,et al. Total antioxidant capacity,total phenolic content and mineral elements in the fruit peel of Myrciaria cauliflora[J]. Brazilian Journal of Food Technology,2013,16(4):301-309.
[7]Lenquiste S A,de Almeida Lamas C,da Silva Marineli R,et al. Jaboticaba peel powder and jaboticaba peel aqueous extract reduces obesity,insulin resistance and hepatic fat accumulation in rats[J]. Food Research International,2019,120:880-887.
[8]邱珊莲,林宝妹,洪佳敏,等. 树葡萄植株不同部位醇提物抗氧化及抑制α-葡萄糖苷酶活性的比较研究[J]. 果树学报,2018,35(3):311-318.
[9]da Silva-Maia J K,BatistaG,Cazarin C B B,et al. Aqueous extract of Brazilian berry (Myrciaria jaboticaba) peel improves inflammatory parameters and modulates Lactobacillus and Bifidobacterium in rats with induced-colitis[J]. Nutrients,2019,11(11):2776-2788.
[10]Lamas C A,Lenquiste S A,Baseggio A M,et al. Jaboticaba extract prevents prediabetes and liver steatosis in high-fat-fed aging mice[J]. Journal of Functional Foods,2018,47:434-446.
[11]Lamas C A,Kido L A,Hermes T A,et al. Brazilian berry extract (Myrciaria jaboticaba):a promising therapy to minimize prostatic inflammation and oxidative stress[J]. The Prostate,2020,80(11):859-871.
[12]Tohidi B,Rahimmalek M,Arzani A. Essential oil composition,total phenolic,flavonoid contents,and antioxidant activity of Thymus species collected from different regions of Iran[J]. Food Chemistry,2017,220:153-161.
[13]林寶妹,张 帅,洪佳敏,等. 马齿苋不同溶剂提取物的抗氧化活性[J]. 食品工业,2020,41(3):141-145.
[14]林宝妹,洪佳敏,邱珊莲,等. 嘉宝果果皮提取物体外降糖活性研究[J]. 南方农业学报,2020,51(2):376-384.
[15]林宝妹,洪佳敏,邱珊莲,等. 嘉宝果果皮提取物不同极性部位抗氧化活性研究[J]. 江苏农业科学,2020,48(1):179-183,188.
[16]郭 蒙,石慧丽,杨 华,等. 星宿菜总多酚提取工艺优化及抗氧化活性[J]. 粮食与油脂,2021,34(2):113-117.
[17]王彦博,石 燕,袁毅君. 麦积山野生刺五加多酚与黄酮的超声辅助提取与体外抗氧化活性的研究[J]. 天然产物研究与开发,2019,31(12):2153-2162.
[18]李 月,纪乃茹,李 健,等. 红毛藻多酚提取工艺优化及抗氧化活性[J]. 食品工业科技,2021,42(7):156-161.
[19]Ghitescu R E,Volf I,Carausu C,et al. Optimization of ultrasound-assisted extraction of polyphenols from spruce wood bark[J]. Ultrasonics Sonochemistry,2015,22:535-541.
[20]罗 兰,李欢欢,汪 芳,等. 响应面法和正交实验法优化天山岩黄芪多酚提取纯化工艺[J]. 食品安全质量检测学报,2020,11(10):3156-3163.
[21]王红玉,焦林宏,赵 芳,等. 超声辅助提取盐碱地苦菜多酚及其抗氧化活性研究[J]. 粮食与油脂,2020,33(7):74-78.
[22]贺银菊,张旋俊,杨再波,等. 响应面优化紫果西番莲叶多酚超声辅助提取工艺及其抗氧化活性[J]. 食品工业科技,2021,42(1):211-216,226.
[23]Guo L,Tan D C,Bao R J,et al. Purification and antioxidant activities of polyphenols from Boletus edulis Bull.:Fr[J]. Journal of Food Measurement and Characterization,2020,14(2):649-657.
[24]张 蕊,仝媛媛,陈 龙,等. 天然来源的抗氧化剂的临床应用及研究进展[J]. 山东化工,2020,49(22):48-52.
[25]尹国利,赵 露,邹成梅,等. 超声波辅助提取苦丁茶多酚及其抗氧化与降糖活性研究[J]. 食品研究与开发,2020,41(17):48-55.
[26]袁 娟,卫 娜,徐 勇,等. 白豆提取物对α-淀粉酶和α-葡萄糖苷酶活性研究[J]. 食品与发酵科技,2014,50(3):12-15.
[27]刘杰超,张春岭,刘 慧,等. 超临界CO2萃取枣核多酚工艺优化及其生物活性[J]. 食品科学,2013,34(22):64-69.
