一株降解纤维素的低温放线菌Streptomyces azureus及产酶条件优化
2021-12-09刘中珊徐赫男李冲伟
李 婷,王 玥,刘中珊,刘 奇,徐赫男,李冲伟
(1黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150080;2黑龙江大学生命科学学院黑龙江省寒地生态修复与资源利用重点实验室,哈尔滨 150500;3哈尔滨华美亿丰复合材料有限公司,哈尔滨 150500)
0 引言
堆肥发酵作为农业废弃物规范化、集中化和资源化利用的主要途径之一,因其具有成本低、有机物降解快、无害化程度高等优势,在国内外农业废弃物处理方面得到广泛应用[1]。在中国北方地区,由于低温持续时间较长(4~6个月),导致腐熟过程无法快速启动和有效发酵,降低了堆肥材料的代谢和反应速度,堆肥效果受到抑制[2-3]。有研究表明,堆体温度低于20℃,大多数微生物的新陈代谢减慢,堆肥周期延长;环境温度≤15℃,堆肥过程难以自发进行[4]。早在1985年,Strom等[5]发现微生物对堆肥启动有着重要作用,在堆肥中添加微生物可以使低温堆肥启动困难的现象得到缓解。Yousif等[6]在低温堆肥中接种了低温纤维素降解真菌,提高了低温堆肥的启动温度,取得了非常好的效果。堆肥过程产生的大部分热量主要来自微生物对有机物的酶解作用[7]。Xie等[8]研究表明低温菌株能促进堆肥过程快速通过启动期,对堆肥过程中温度的升高、酶活性的提高和有机质的降解均有积极作用。也有研究表明,与接种中温微生物相比,低温微生物的添加提高了堆肥的甲烷产量和挥发性固体的去除率[9-10]。目前为止,在堆肥中添加的启动菌大多数是细菌和真菌,对放线菌的研究较少。放线菌是堆肥过程中重要的一类微生物,虽然它们生长速度较慢,但具有耐温、对极端环境适应性强、易于基因改造等优点。同时,在堆肥的高温阶段,放线菌可以形成孢子以抵抗恶劣环境[11]。有研究发现,接种放线菌不仅改变了堆肥过程的微生物群落结构,还使得纤维素、木质素和半纤维素的降解效率得到了有效提高,这是由于其提高了纤维素酶、木聚糖酶和漆酶的活性,并能使得木质素过氧化物酶及锰过氧化物酶等关键酶活性增强[12-13]。筛选有效的低温纤维素降解菌株,不仅能加快堆肥腐熟进程,而且能够将资源利用效率最大化,对环境的可持续发展具有重要意义。
本研究从红松混交林凋落物层采集土壤,采用稻秆粉培养基富集,通过刚果红平板染色和3`5-二硝基水杨酸法(DNS法)筛选高效降解纤维素的放线菌,通过生理生化试验和16S rDNA基因序列对菌株进行鉴定,采用响应面法对菌株的产酶能力进行优化。
1 材料与方法
1.1 样品采集
土壤样品,采集于哈尔滨东亚之窗公园落叶阔叶红松混交林,采集时间2019年10月9日,样品采集后保存在-80℃冰箱中备用。
1.2 培养基及配方
秸秆粉培养基、羧甲基纤维素钠培养基、LB固体培养基、高氏一号培养基、液体发酵产酶培养基配制参考吴静、沈大春等[14-15]的方法。
1.3 低温纤维素降解菌的分离与筛选
称取8.0 g土样与3.0 g秸秆粉,加入100 mL蒸馏水,160 r/min振荡10天。
取培养的富集液1 mL进行稀释,将10-3,10-4,10-5和10-6稀释液依次于高氏一号培养基上进行涂布,于15℃培养箱中培养2天,挑取单菌落,纯化培养。
将纯化后长势较好的单一菌落挑出,经CMC固体培养基培养时间2~3天后,利用刚果红染色液(1 mg/mL)进行覆盖染色15 min,弃上层染色液,并利用NaCl洗脱液(1 mol/L)洗脱15 min,弃掉洗脱液,可得到未被着色的透明圈,分别记录透明圈直径(D)与菌落直径(d),每个实验重复3次。
1.4 纤维素酶活力测定
纤维素酶活力测定采用DNS法,参照国标GB-T 35808—2018。
1.5 生理生化试验
将高效降解纤维素的放线菌菌株T23-B,经LB培养基振荡培养72 h,取菌液1 mL梯度稀释后依次涂布于秸秆粉培养基,37℃恒温培养72 h得到单菌落,观察并记录菌落形状、透明度、隆起形状、颜色、边缘、表面以及革兰氏染色。
1.6 分子鉴定
菌株T23-B进行纯培养,利用CTAB法提取总DNA,PCR扩增并测序。引物为通用引物,正向引物为27F(5’AGAGTTTGATCCTGGCTCAG-3’),反向引物为 1492R(5’TACGGCTACCTTGTACGACTT-3’)。PCR反应体系(共25 μL):DNA(70 ng/μL)模板1 μL;dNTP Mixture(2.5 mmol/L)12.5 μL;27F(20 μmol/L)1 μL;1492R(20 μmol/L)1 μL;补 足 ddH2O 到25 μL[16]。将所得产物经试剂盒纯化,送至哈尔滨奥恒生物科技有限公司测序。
1.7 纤维素酶活力单因素实验
选取温度15、20、25、30、35、40℃,时间24、48、72、96、120 h,培养液pH 5、6、7、8、9,氮源种类(硫酸铵、牛肉膏、蛋白胨、酵母浸粉、硝酸钾、硝酸钠、酵母膏),碳源种类(蔗糖、纤维素、可溶性淀粉、CMC-Na、甘露醇),氮源浓度2、4、6、8、10 g/L,碳源浓度5、10、15、20、25 g/L单因素,考察不同单因素对纤维素酶活力的影响。
1.8 响应面优化试验
结合单因素试验结果,响应值(Y)采用纤维素酶活力,进行Box-Behnken试验设计。选取pH(A)、氮源浓度(B)、碳源浓度(C)3个变量设计响应面试验,具体因素与水平设计见表1。

表1 Box-Behnken设计因素水平表
1.9 统计分析
使用Design Experts 8.0软件绘制响应面图,使用SPSS 22.0软件对数据进行统计分析,使用MEGA7.0软件采用邻接法构建系统发育树。
2 结果与分析
2.1 纤维素降解菌的筛选
利用CMC琼脂平板培养24 h,经染色脱色后菌落周围形成纤维素-溶剂区的透明圈,通过透明圈直径(D)与菌落直径(d)比值初步鉴定纤维素酶活。结果如表2所示,从凋落物层土壤中初步筛选出了7株D/d比值大于3的放线菌菌株,其中T23-B的比值最大为5.40,T23-B透明圈的结果如图1所示。T23-B菌株的纤维素酶活力最高为28.34 U/mL,选择该菌株进一步鉴定。
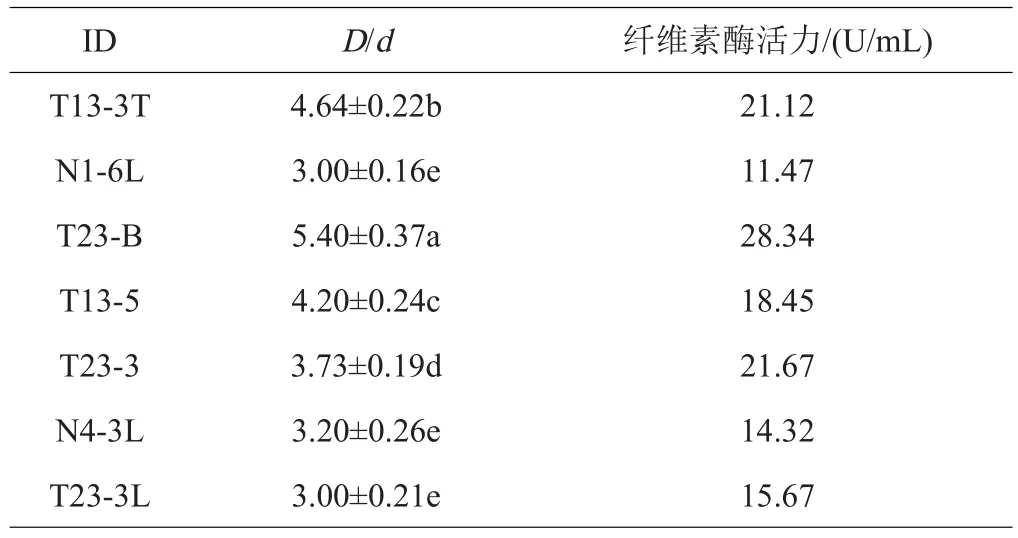
表2 透明圈大小和CMC酶的活性

图1 T23-B菌落透明圈
2.2 T23-B生理生化指标及分子鉴定
菌株T23-B菌落呈圆形,不透明,表面粗糙,具有褶皱,边沿不平整,淡蓝绿色。生理生化鉴定表明,该菌为革兰氏阳性菌,明胶液化和V-P实验显阳性,生理生化具体特征见表3。

表3 T23-B菌株的生理生化特性
T23-B菌株经PCR扩增后DNA片段均为单片段,每单片长度约为1500 bp。PCR产物进行测序,得到全长1407 bp基因序列,与电泳结果一致(图2)。16S rRNA基因序列与核糖体数据库比对T23-B菌株与远青链霉菌(Streptomyces azureus)菌的同源性为99%,系统进化树由MEGA7.0进行聚类并构建,如图3所示。

图2 T23-B菌株电泳图

图3 T23-B菌株的系统发育树
2.3 T23-B产酶条件优化
2.3.1 产酶条件单因素优化 选择最佳温度、最佳培养时间及最佳pH对菌株T23-B的产酶条件进行单因素优化,结果如图4(a-c),温度低于25℃,酶活力随着生物量的增长而增大,25℃菌株最大生物量,菌株的生物量及酶活均随温度的升高下降,当温度达到35℃,酶活力升至最高,为28.77 U/mL(P<0.01),96 h时酶活力趋于平缓为40.3 U/mL(P<0.01);当pH 5.0时酶活力最高为32.5 U/mL(P<0.01)。
选取7种不同的氮源,探究氮源对纤维素酶活的影响,如图4d所示,以酵母浸粉为氮源时,最高酶活力可达到81.9 U/mL(P<0.01),明显高于其他氮源种类。以酵母浸粉为氮源,进一步考察不同氮源含量对纤维素酶活产量的影响,如图4e所示,酵母浸粉含量为8 g/L时,酶活力可达到92.7 U/mL,因此选择8 g/L作为最佳氮源含量。
选取5种不同的碳源,考察不同碳源对纤维素酶活产量的影响,如图4f所示,甘露醇以为唯一碳源时,酶活力达到75.6 U/mL(P<0.01),显著高于其他碳源种类,因此选择甘露醇作为最适碳源。以甘露醇为唯一碳源,考察不同碳源含量对对纤维素酶活产量的影响,如图4g所示,甘露醇含量为15 g/L时,菌株T23-B产纤维素酶能力最强,酶活力达到109.7 U/mL,因此15 g/L作为最佳碳源含量。
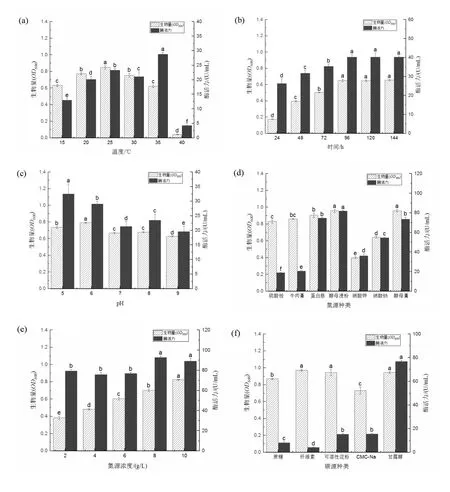

图4 T23-B产酶条件的优化
2.3.2 产酶条件响应面优化 为了进一步优化菌株T23-B的产酶条件,以单因素试验结果为基础,纤维素酶活力为响应评价指标,选取pH、氮源浓度和碳源浓度作为主要影响因素,进行Box-Behnken实验,实验设计与结果如表4所示。回归模型方差分析P(Pr>F)<0.0001,模型效应极显著,模型失拟项的显著性水平P=0.8840>0.05,表明模型失拟不显著。回归方程的相关系数R2=0.9922,R2Adj=0.9821,变异系数为1.72%表明该模型与实际试验拟合程度较好,实验误差较小方程拟合良好,变异几率低。二次回归拟合方程(1)。

表4 Box-Behnken试验结果

式中y为预测值,A、B和C分别为pH、氮源浓度和碳源浓度。
以各因素对试验结果的影响程度为:B(氮源浓度)>C(碳源浓度)>A(pH),利用响应面拟合方程得到3个关键因素的拟合值分别为:pH 5.2,氮源浓度为7.8 g/L,碳源浓度为15.6 g/L。该拟合值条件下模型的预测酶活力最大,为120.5 U/mL。在该拟合值条件下进行培养,测定纤维素酶活为123.43 U/mL,与响应面的预测酶活一致。
3 讨论
森林凋落物层土壤中的多种纤维素分解菌,是非常宝贵的微生物资源。本研究从落叶阔叶红松混交林凋落物层土壤中分离出1株产纤维素酶活力较强的低温放线菌菌株,命名为T23-B,通过生理生化和分子生
物学鉴定结果可知,T23-B菌株为远青链霉菌(Streptomyces azureus),其同源性为100%。1959年,Kelly等[17]首次发现并命名了远青链霉菌(Streptomyces azureus),并另有学者发现该菌株可产硫化氢,蛋白水解作用强,淀粉水解实验呈阳性,与本实验结果一致[18]。有研究指出该菌株属于Streptomyces cyaneus集群,能够生产硫链丝菌素,具有一定抗菌活性,尤其能够抗多种条件致病菌,是一种较好的硫肽类抗生素[19-21]。有研究表明,当外界条件变得恶劣时,放线菌能够以孢子的形式存在,相较于其他细菌和真菌,对温度和pH的耐受性较高,并且接种链霉菌可以使堆肥的温度显著提升,加快整个堆肥发酵周期[22-23]。链霉菌属能够高效分泌大量稳定性高和底物特异性强的纤维素酶,可被用来生产酶制剂和抗生素等,或用于造纸污水处理等行业,链霉菌属微生物分泌的纤维素酶耐受温度在40~50℃,耐受pH 5~12,其稳定性在放线菌
中最好[24]。在自然堆肥过程中,链霉菌属为堆肥中后期的优势菌属,使堆体微生物的代谢活性得以提高,增强堆肥中蛋白酶、蔗糖酶的活性,同时,链霉菌属的抗菌活性成为堆肥无害处理的重要因素[25]。以往研究对低温降解纤维素菌株较少,本次研究结合寒地堆肥条件,筛选对低温耐受性较强的可降解纤维素的放线菌菌株,获得T23-B菌株,其可承受0~40℃及pH 4.5~7.0环境条件,并在此条件内能保持代谢和酶活性[26-27],因此,T23-B菌株属于耐冷微生物。

图5 两因素交互影响纤维素酶活力响应面图
该菌株最适氮源为8 g/L酵母浸粉,最适碳源为15 g/L甘露醇。酵母浸粉能提供微生物生长必需的优质氮源,并且有机氮源相较于无机氮源具有更为充足的维生素、氨基酸和一些生长因子,因此,酵母浸粉可促进纤维素降解菌产生纤维素酶,这与前人的报道一致[28-30]。该菌株属好气性链霉菌属,最适转速为160r/min,是由于转速的提高有益于培养基的氧气含量的增加,从而促进好氧微生物的生长,但转速过大时产生的剪切力会对菌体造成损伤。随着培养时间的增加,菌体生物量逐渐增加,96 h生物量趋于平缓,而酶活力在前24 h迅速升高,随后酶活力上升变慢,96 h趋于平缓,与生物量变化趋势一致。pH 6时生物量达到最大,而酶活在pH 5时达到最大,这可能是由于酶活受pH影响显著,或者是pH影响菌株产纤维素酶的能力。pH 5~9的生物量可达最适pH生长量的80%以上,说明T23-B菌株生长对pH不敏感。菌株T23-B可在15℃下生长,在30℃生长效果最好,当温度达40℃时,酶活力急剧下降,可能是温度超出了该菌株的生长温度。菌株纤维素酶产量受温度影响较大,温度会影响菌体生长速度及营养消耗,影响膜内外物质,如水分、有机物、各种离子等的交换和吸收[31]。低温菌会采取适应策略,在较低温度范围内保持活性[32]。本研究证明T23-B在15~40℃均有产纤维素酶能力,在15℃时可保持44.9%的最高酶活力,由于链霉菌属是堆肥中后期的优势菌种,且对环境适应能力强,能够满足低温堆肥条件,可见,该菌株在低温堆肥将具有非常好的应用前景。
本研究仅对该菌株的纤维素酶活力进行测定及优化,未实际作用于秸秆以及未对秸秆的纤维素结构进行观察和进一步分析。由于堆肥过程相对复杂,微生物相互作用受外界条件影响较大,该菌株是否对堆肥过程中的有益微生物产生抑制作用,在堆肥实际应用的作用效果有待进一步探索。应进行大田试验,测定该菌株制备的有机肥施用后是否对土壤中全氮、有效磷、速效钾等土壤肥力指标及土壤微生物群落产生影响。
4 结论
从红松混交林凋落物层筛选到1株低温纤维素降解菌——远青链霉菌(Streptomyces azureus)。单因素试验表明,T23-B最适培养时间为96 h,最适pH 6.0,最适温度在30℃,最适转速160 r/min。响应面分析表明,T23-B最适产酶条件为pH 5.2、96 h、35℃、甘露糖15.6 g/L,酵母浸粉7.8 g/L,在最适产酶条件下纤维素酶活力为123.43 U/mL,较优化前提高了4.4倍。Streptomyces azureus是一株低温产纤维素酶的放线菌,在北方冬季低温堆肥发酵中将具有非常好的应用价值,对提高农业废弃物资源利用和保护寒地生态环境具有重要意义。
