木芙蓉花期不同阶段主要器官内源激素含量的变化*
2021-12-09朱章顺王强锋李芹马娇夏中梅侯勇王海涛胡凤科徐远超
朱章顺,王强锋,李芹,马娇,夏中梅,侯勇,王海涛,胡凤科,徐远超
(1.成都市植物园,四川 成都 610083;2.四川省农业科学院 生物技术核技术研究所,四川 成都 610066;3.四川省兰月科技有限公司,四川 成都 610207)
木芙蓉(HibiscusmutabilisLinn)为锦葵科(Malvaceae)木槿属(Hibiscus)落叶灌木或小乔木植物,为我国长久栽培的城市绿化及观赏植物,广泛分布于四川、云南、湖南、广西、广东等地。四川成都有着最悠久的木芙蓉花栽培历史,“蓉城”由此而来。芙蓉花是成都的象征,1983年5月26日成都市人大把芙蓉花定为市花,银杏为市树,每年农历九月初九为市花市树节[1]。木芙蓉花期较长,花期不一致导致不同花朵先后开放不整齐,对木芙蓉观赏性和整体美化效果造成不利影响。内源激素是一类重要的植物生长调节物质,与花的生长发育密切相关,多种内源激素的相互作用共同调控植物的花期。
植物内源激素是微量的、自然产生的物质,目前,已分离鉴定了生长素(IAA)、赤霉素(GA)、细胞分裂素(CTK)、乙烯(ETH)、脱落酸(ABA)、油菜素内酯(BR)、水杨酸(SA)和茉莉酸(JA)等不同的植物激素[2-3]。内源激素通过复杂的信号转导途径参与调节植物各个生理过程,植物激素信号之间存在相互作用,具有复杂的网络关系,其含量的多少及比例对植物正常生命活动有重要影响[3-6]。蜜柑(CitrusunshiuMarc.)叶片中较高浓度的GA3抑制花芽分化,高IAA和ABA含量促进了花芽形成[7]。忍冬(LonicerajaponicaThunb.)花高水平IAA、低水平ABA、高IAA/ABA、ZR(玉米素核苷)/ABA、IAA/GA3及低ABA/GA3、ZR/IAA是影响忍冬‘特蕾1号’大白期时长的主要因素[8]。在白魔芋(Amorphophallusblume)花芽形态分化时期,较高浓度的IAA、GA3和ZT(玉米素)在雌蕊成熟过程中起促进作用,在同一过程中,高浓度的ABA/IAA,ABA/ZT和ABA/GA3均不利于雄蕊的成熟,高浓度ABA是抑制雄蕊成熟的关键因子[9]。在苹果(Malussieversii)中,ZR、ZR/GA3分别与短枝比例呈正相关,GA3与花序数量呈负相关,苹果幼树开花相关指标分别与细根中的IAA、ZR、GA3、IAA/ZR呈正相关,内源激素在地上部成花与地下部根系生长过程中具有重要调节作用[10]。目前,国内外未见木芙蓉内源激素相关报道。由于内源激素在植物体内含量极低,结构复杂,存在很多相互共存的干扰成分,并且容易受光照、温度和酸碱度的影响导致变性[11]。因此,对内源激素的高效提取、内源激素检测的精度和准确度要求较高。目前,高效液相色谱法(HPLC)、气相色谱法(GC)和质谱法(MS)以其分离效率高、检出限低、耗时少、样品量少等优点,已成为植物激素的重要分析方法[11-12]。
内源激素是影响植物开花的重要因子,木芙蓉的花具有二次盛开的特性,即木芙蓉顶端的花蕾经过一段时间的发育后再次集中开放,内源激素对其开花过程可能具有独特的调节作用。现阶段,木芙蓉开花特性受内源激素调控机理的研究还不完善,花期调控技术有待提升。本文研究了木芙蓉花期不同阶段,即花芽分化期、花芽分化后期、花蕾期、初花期、盛花期、盛花末期、二次盛花期和末花期的叶、花中内源激素水平、动态变化规律、比例关系等,可为后期通过非自然的方式调控木芙蓉花期,提高木芙蓉观赏性提供理论支撑。
1 材料和方法
1.1 研究区概况
研究区位于成都市植物园苗圃基地,该地区属中亚热带湿润季风气候区,无霜期较长,四季分明,冬春少雨,夏秋多雨,雨量充沛,年平均降水量为900~1 300 mm,年平均气温在16 ℃左右,木芙蓉栽植土壤为黄壤。
1.2 试验材料与试验设计
以木芙蓉品种‘锦绣紫’为试验材料,根据不同花期采集木芙蓉叶片、花蕾、盛开花和衰败花样品保存为鲜样,测定IAA、ABA、GA3、CTK和ETH的含量。分别于木芙蓉花芽分化期(2019-05-13)、花芽分化后期(2019-05-30)、花蕾期(2019-06-11)、初花期(2019-07-05)、盛花期(2019-07-26)、盛花末期(2019-09-09)、二次盛花期(2019-09-30)、末花期(2019-11-13)随机采集9株木芙蓉叶片、花蕾、盛开花和衰败花,各器官样品采集后立即放入液氮冷冻,放入冰盒,带回实验室进行内源激素提取与收集,多余样品置于-80 ℃冰箱中留存备用。
采样时期作如下定义:花芽分化期指木芙蓉植株枝梢顶端有5~6片真叶,能见明显叶芽,花芽肉眼不可辩认的时期;花芽分化后期指木芙蓉植株枝梢顶端花芽肉眼可辨认的时期;花蕾期指木芙蓉花蕾最大横径约1 cm、花柄长度约3 cm以上的时期;初花期指木芙蓉整株有三分之一左右花蕾开放的时期;盛花期指木芙蓉整株有二分之一左右的花蕾开放的时期;盛花末期指木芙蓉植株整株有三分之二以上的花蕾已开放的时期;二次盛花期指木芙蓉植株顶端花蕾经过发育后开放二分之一的时期;末花期指花蕾全部开放的时期。
其中:采集的花蕾是指花蕾横径1~2 cm、花柄长度3 cm以上,花蕾未破的形态;盛开花指开放当天,花瓣呈向外展开形态的花朵;衰败花指花朵开放24~48 h,花瓣呈萎蔫状态的花朵。由于木芙蓉花盛开后次日就萎蔫衰败,因此在初花期也有衰败花样品;在末花期花蕾已全部开放,无花蕾的样品。
1.3 试验方法与处理
1.3.1 高效液相色谱法测定IAA、GA3、ABA、CTK含量
以甲醇+磷酸缓冲液或水为流动相,使用C18的不锈钢反向柱和紫外检测器,对样品中的IAA、GA3、ABA、CTK进行高效液相色谱分离和测定,外标法定量。
(1)标准样品溶液制备及定量工作曲线建立
少量甲醇溶解IAA、GA3、ABA、CTK,用酸性流动相配制浓度为3 mg/L的IAA、GA3和ABA溶液,用中性流动相配制3 mg/L的CTK溶液。上述溶液进一步稀释成系列标准溶液用于检测,最终标准曲线相关系数R2>0.99方可使用。
(2)样品溶液的制备
参考文献方法[13-15]并作适当改进。取适量的叶片或花,快速机械破碎,准确称取样品约20 g于已加入0.5 g三水合二乙基二硫代氨基甲酸钠(抗氧剂)烧杯中,再加50 mL预冷甲醇(上述过程10 s内完成),搅拌均匀,超声破碎2 min,盖上表面皿在4 ℃下冰箱中避光浸提过夜;倾倒上清液,再加50 mL预冷80%甲醇继续浸提2 h;连续收集3次浸提液,先过滤浸提液再过滤残渣,少量80%甲醇多次清洗,过滤于烧瓶中(约200 mL);40 ℃条件下减压浓缩至20 mL左右(尽量去除甲醇);将浓缩样品无损转移到分液漏斗中,加入与样品体积1︰1的石油醚和0.05 g的聚乙烯吡咯烷酮萃取;重复一次,水相加入与水相体积1︰1的石油醚萃取;水相经C18小柱(型号:LC-C18 SPE Cartridge,500 mg,3 mL)固液分离,收集滤液。用1 mol/L柠檬酸将滤液pH调至2~3,用20 mL乙酸乙酯萃取两次,分别收集两次萃取后的乙酸乙酯(40 mL) 和最后一次的水相(20 mL);水相用pH=9氨-氯化铵调至pH=6左右,定容至25 mL,过0.45 μm滤膜用于测定CTK;乙酸乙酯相再用20 mL且 pH=10氨-氯化铵缓冲液萃取2次,收集2次水相40 mL,水相重复上面操作调酸,乙酸乙酯萃取两次,收集乙酸乙酯相,用氮吹仪吹干,甲醇溶解,棕色容量瓶定容至5 mL,过0.45 μm有机滤膜用于测定IAA、ABA和GA3。
(3)高效液相色谱操作条件
IAA含量测定条件:流动相为甲醇︰磷酸水溶液(35︰65),波长280 nm;GA3含量测定条件:流动相为甲醇︰磷酸水溶液(35︰65),波长210 nm;ABA含量测定条件:流动相为甲醇︰磷酸水溶液(50︰50),波长254 nm;CTK含量测定条件:流动相为甲醇︰水(30︰70),检测波长280 nm。
(4)回收率测定
在设定的色谱条件下,配制3种不同浓度的植物激素标准液,通过液相保留时间和峰面积,分析植物激素的重现性和再现性。
采样添加标样法测定回收率[12],在最佳纯化及色谱分析条件下,向测试样品中加入4种植物内源激素各1 mg,测定加标后样品激素含量,5次重复,计算加标回收率和相对标准偏差。
(5)IAA、GA3、ABA、CTK含量计算
式中:A1为标样溶液中,目标物峰面积的平均值;A2为试样溶液中,目标物峰面积的平均值;m1为标样的质量(g);m2为试样的质量(g);P为标样中目标物的质量分数(%);D为稀释倍数关系。
1.3.2 气谱法测定ETH含量
(1)样品处理及乙烯收集
称取适量样品(15 ~20 g),放入玻璃瓶中,塞好橡皮塞,用封口膜将缝隙密封,在25 ℃室内,存放20 h。轻摇玻璃容器,将注射器内空气彻底排除,用排水法收集玻璃容器内体积30 mL,转移至铝箔采样袋中。
(2)气相色谱条件
北分瑞利,3420A气相色谱仪;氢离子火焰检测器(FID),检测器150 ℃;30 m毛细管柱,柱温60 ℃;进样口60 ℃;燃气氢气流速40 mL/min,空气流速400 mL/min,载气氮气流速50 mL/min。顶空进样针进5 μL样品,重复测定3次。
(3)乙烯标准曲线绘制
配制浓度为0.002、0.004、0.008、0.012、0.016 mL/L的5个标准气体样品,绘制乙烯标准曲线。
(4)乙烯含量计算
乙烯浓度(mL/L)=(样品平均峰高/标准乙烯平均峰高)×标准浓度
乙烯含量以单位时间内单位质量的木芙蓉样品乙烯释放量计,单位为:mL/(h·g)。
1.4 数据处理与分析
采用Excel 2013进行数据统计,Origin 9.0进行图表制作。
2 结果与分析
2.1 木芙蓉内源激素测定方法可行性
2.1.1 IAA、GA3、ABA、CTK测定谱图及回收率
根据上述条件,IAA、GA3、ABA、CTK提取效果较好,样品色谱图和标样色谱图一致,木芙蓉样品谱图见图1。

图1 木芙蓉内源激素IAA(A)、GA3(B)、ABA(C)、CTK(D)高效液相色谱图
4种激素的平均回收率为82.72%~105.58%(表1)。说明精确性良好,本方法的可靠性较高。

表1 内源激素IAA、GA3、ABA、CTK的峰保留时间和平均回收率
2.1.2 木芙蓉内源激素乙烯测定
上述方法操作简便、灵敏度高,乙烯标准曲线y=384.3x-76.43,R2=0.999;本操作条件能快速准确地测定木芙蓉内源乙烯释放量,其峰保留时间0.84 min。
2.2 花期不同阶段木芙蓉叶、花中内源激素含量
花期不同阶段木芙蓉叶、花中内源激素含量测定结果见图2。
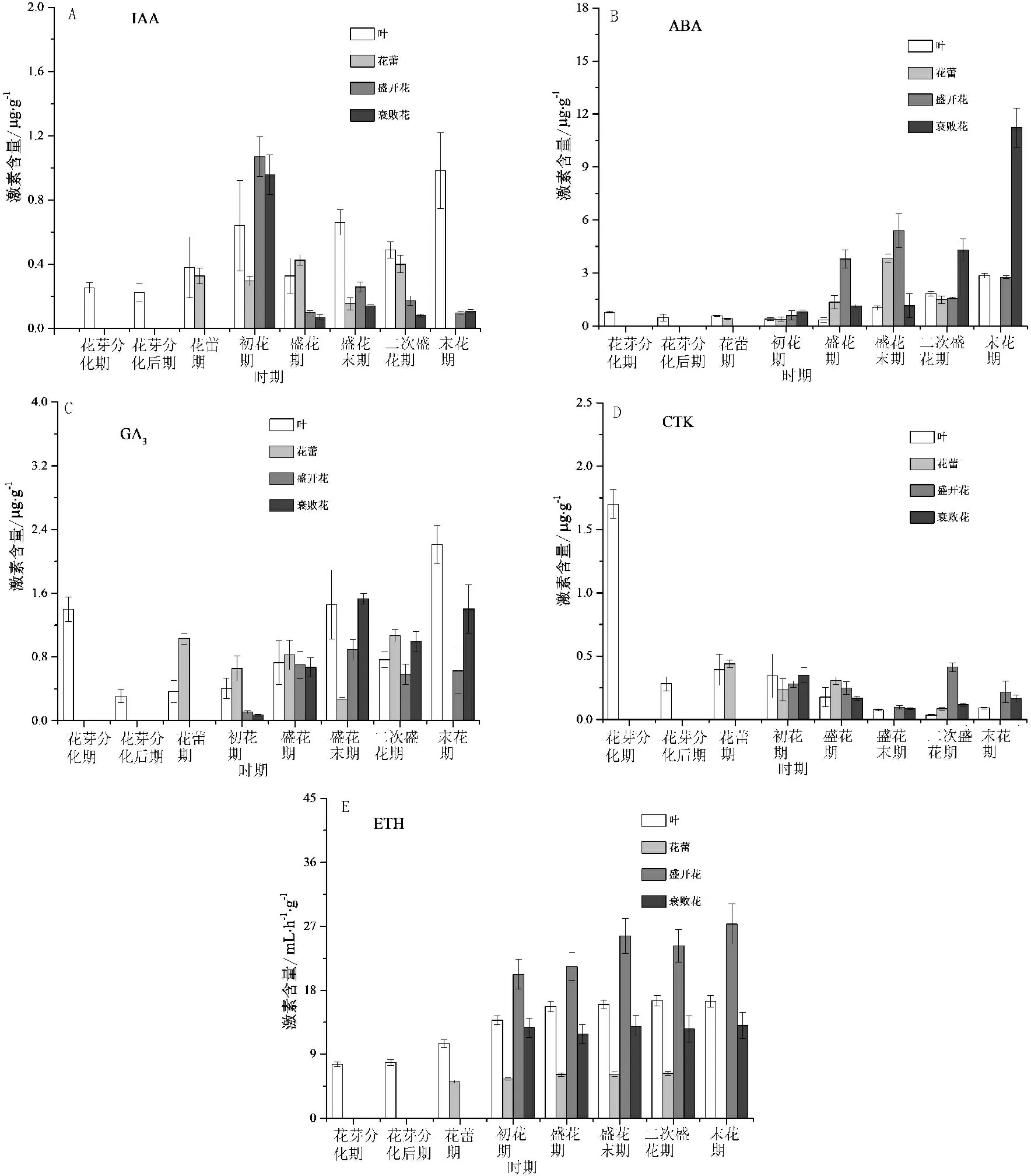
图2 花期不同阶段木芙蓉叶、花中内源激素含量变化
叶、花中IAA含量在花期不同阶段差异较大(图2A)。由花芽分化期到初花期,叶中IAA含量呈逐渐升高的趋势;由初花期到末花期,叶片中IAA含量呈“W”型变化趋势,在盛花期和二次盛花期相对较低;花蕾中则表现为相反的趋势,在盛花期和二次盛花期含量相对较高;盛开花和衰败花中IAA含量在初花期含量最高,其后大幅减少,盛开花中IAA含量降低76%~91%,衰败花中降低85%~93%。可见,初花期叶、花中IAA较丰富,主要分布在已开放的花朵中,后期主要分布在叶片和花蕾中。
叶、花中ABA含量整体表现为逐渐增加的趋势,叶、花中增幅不同(图2B)。叶片和衰败花中ABA含量在末花期达到峰值,ABA含量分别是初花期的7.34、13.79倍;花蕾和盛开花中ABA含量先增加后降低,在盛花末期时含量较高。可见,在木芙蓉花朵由开放到衰败的过程中,ABA在叶、花中逐渐累积,在盛花期和盛花末期主要累积在盛开花中,第二次盛花至末花期主要累积在衰败花中。
叶、花中GA3含量的变化呈现明显的差异(图2C)。从花芽分化期到初花期,叶中GA3含量降低,花芽分化期最高;从初花期到末花期,叶中GA3含量呈“~”型变化趋势,在盛花末期和末花期含量相对较高;花蕾中GA3含量在盛花期和二次盛花期相对较高;盛开花和衰败花中GA3含量初花期极低,其后大量增加,与叶中GA3相似,在盛花末期和末花期含量相对较高。
叶、花中CTK含量的变化特征不同(图2D)。叶中CTK含量花芽分化期最高,随后大幅降低;花蕾中CTK含量盛花期最高,盛花末期几乎未检测到CTK,二次盛花期CTK含量升高;盛开花中CTK含量随花朵衰败有明显的降低,盛花末期和末花期CTK含量远低于盛花期,其中二次盛花期含量最高;衰败花中CTK含量整体表现为逐渐降低的趋势,在初花期最高。可见,在开花早期阶段(初花期和盛花期),叶、花中CTK含量丰富,随花朵衰败CTK含量明显降低。
叶、花中ETH含量变化趋势较一致,ETH含量缓慢升高,从初花期到末花期变幅较小(图2E)。
2.3 花期不同阶段木芙蓉叶、花中内源激素间比例关系
不同阶段木芙蓉叶、花中内源激素间比例关系见图3。
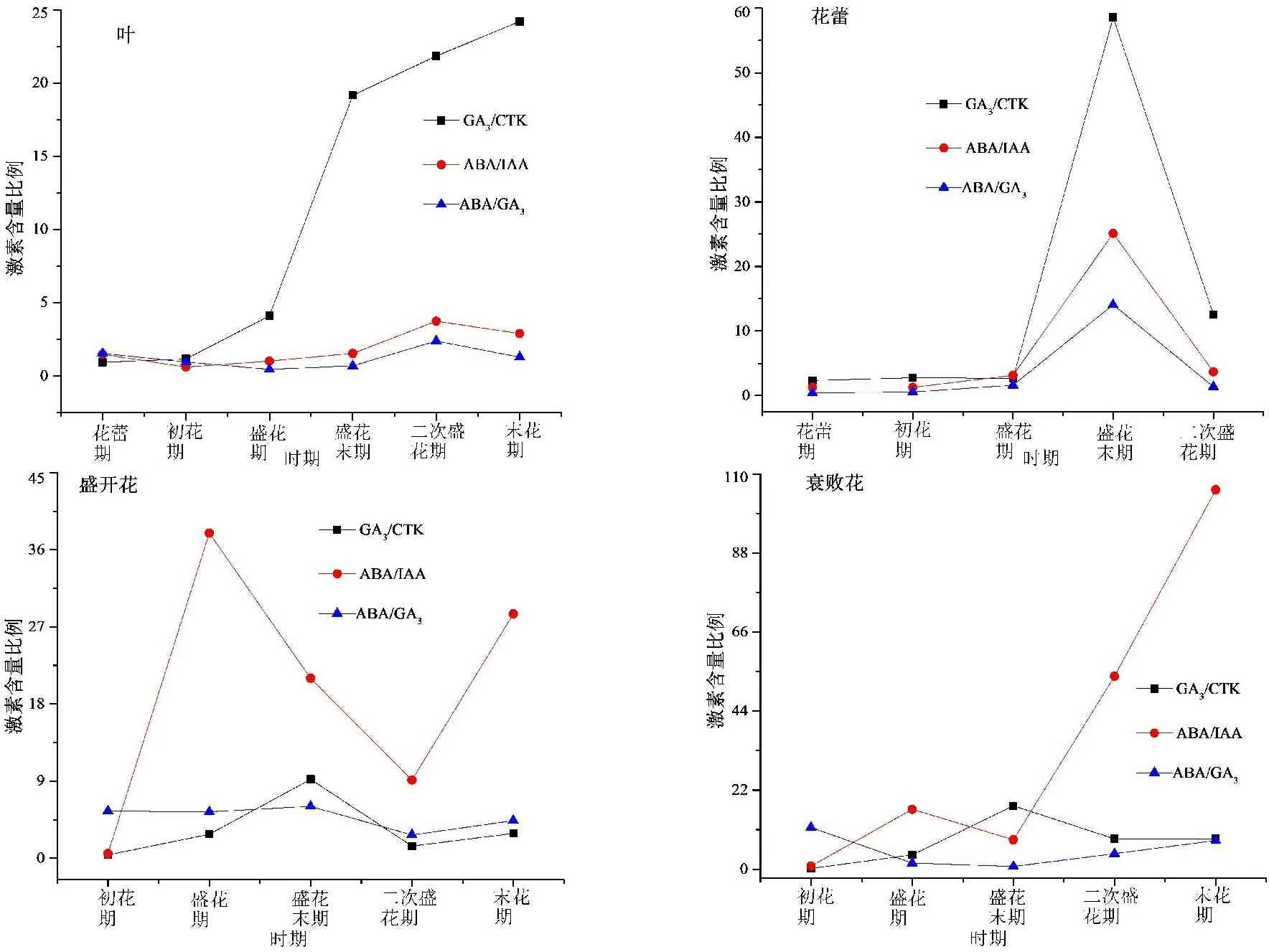
图3 花期不同阶段木芙蓉叶、花中内源激素间比例关系
由图3可知,初花期以后,叶片中GA3/CTK比值呈快速上升趋势,盛开花中GA3/CTK比值逐渐升高,在盛花末期到达峰值,随后呈下降趋势;盛花期,盛开花和衰败花中ABA/IAA比值较高;与其他时期相比,盛花末期花蕾中GA3/CTK、ABA/GA3和ABA/IAA值较高。
3 讨论与结论
内源激素是调节花芽分化的关键,植物的不同内源激素平衡状态影响花芽分化。本试验发现,木芙蓉花芽分化期叶片中的GA3、CTK、ABA含量较高。其他植物,如香舌兰(VanillaplanifoliaAmes)在花芽分化过程中,生长素(IAA)具有促进花芽分化的作用,玉米素核苷(ZR)和赤霉素(GA)具有抑制花芽分化的作用,脱落酸(ABA)具有先促后抑的作用,低水平的GA/ZR对花芽形成具有促进作用[16]。因此,木芙蓉花芽分化期叶片中较高含量的GA3、CTK,叶片中较低水平的GA3/CTK,有利于促进木芙蓉花芽分化;相对较高水平的ABA抑制了茎尖的营养生长,从而与IAA、GA3和CTK相互作用,使茎尖由营养生长转入生殖生长,促进花芽分化。
木芙蓉‘锦绣紫’品种相对于其他品种而言,衰败花在盛花期不易掉落,而在末花期衰败花较易掉落。从内源激素来看,在木芙蓉‘锦绣紫’的盛花期,叶片和衰败花中ABA含量处于相对较低水平,在二次盛花期和末花期,叶片和衰败花中ABA含量均处于高水平。已有研究表明,植物的衰老过程受多种内源激素的共同参与,通过外源茉莉酸甲酯诱导银杏(GinkgobilobaL.)叶片衰老过程中,内源性ABA水平显著增加,而CTK、GA和IAA的含量和未经处理的自然衰老叶片相比变化不大,各种激素信号,特别是ABA在调控叶的衰老过程中发生作用[17-18]。因此,在木芙蓉‘锦绣紫’的整个开花周期中,二次盛花期和末花期阶段,植株叶片才进入衰老过程,此时衰败花中较高的ABA含量会加快其掉落。
在木芙蓉整个开花时期,盛开花中ETH含量高于衰败花。已有研究表明,在许多植物物种中,花的衰老是由气体激素乙烯(ETH)促进和细胞分裂素(CTK)类激素抑制[19],ABA含量升高不影响开花时间和开花表型[20]。因此,盛开花中ETH快速产生,可能是盛开花维持时间较短的主要原因。但本研究中乙烯含量为各器官在离体条件下收集测定,不一定反映活体状态下真实的乙烯释放水平,其乙烯的变化特征还需进一步探讨。
部分木芙蓉品种有二次盛花的现象[21],结合本研究发现,两次开花过程的内源激素水平差异较大,主要表现在ABA含量上。叶片中GA3含量从盛花期到盛花末期表现为升高,二次盛花期时GA3含量降低,在末花期时其含量升高,IAA与GA3趋势基本一致,但ABA含量从盛花期快速升高持续到末花期。花蕾在初花期以后,其ABA含量逐渐升高,到盛花末期达到峰值后降低,两次盛花期的花蕾中ABA水平差异不大。而盛开花中,其ABA含量在盛花期和盛花末期高于二次盛花期和末花期。从开花到衰败的过程中,叶中IAA、GA3、ABA、ETH含量升高,仅CTK降低;花蕾中IAA、GA3、CTK含量降低,ABA和ETH升高;盛开花和衰败花中IAA和CTK含量降低,GA3、ABA、ETH升高。因本研究是对木芙蓉花期内源激素的首次探究,对木芙蓉花期的界定亦无可参考依据,实际采样过程中按照其开花表现分成盛花期和二次盛花期,从内源激素水平分析,叶片在盛花末期以后才进入衰老过程,二次盛花期过程中内源激素的影响较为复杂。
综上所述,在花芽分化期,木芙蓉叶片中较高含量的GA3、CTK、ABA可促进花芽分化。在木芙蓉二次盛花期,叶、花中内源激素水平随花期波动变化,ABA含量变幅最大,ETH含量较为稳定。GA3、ABA、ETH含量增加可促进木芙蓉开花,加速花朵的衰败。今后,可在花芽分化前期外源补充GA3、CTK和ABA等激素,研究其是否提前花芽分化,在花蕾期补充IAA和GA3,研究其是否提前开花,在盛花期补充ABA,观察其残花是否容易掉落;同时结合转录组等技术研究植物激素对花期的调控机理,以期为木芙蓉花期调控技术提供更充分、更深入的理论依据。
