miR-134靶向基质金属蛋白酶1对喉癌细胞的增殖、凋亡、侵袭和迁移的影响*
2021-12-09陈艳丹岑瑞祥龚国清
陈艳丹,岑瑞祥,曹 炜,龚国清,彭 聪
[鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)耳鼻咽喉头颈外科,湖北黄石 435000]
喉癌是一种常见的头颈部恶性肿瘤,2014年我国喉癌发病2.34万例(男性2.08万例,女性0.26万例),其中死亡1.32万例(男性1.15万例,女性0.17万例)[1]。由此可见,喉癌具有好发于男性、病死率高的特点。导致喉癌患者死亡的主要原因是局部复发和远处转移,目前对喉癌细胞远处侵袭转移的分子机制尚不清楚。基质金属蛋白酶家族(MMPs)被认为是细胞外基质形成、重塑、细胞分化及成型等的重要调控介质,与肿瘤细胞增殖、侵袭、转移和血管形成密切相关[2]。高通量测序分析显示,基质金属蛋白酶1(MMP1)在喉癌组织中普遍高表达[3],但其具体调控机制未明。CHEN等[4]报道miR-134靶向负调控MMP1和MMP3抑制骨肉瘤细胞的侵袭和转移,提示miR-134可能是MMP1表达的调控机制之一。因此,本研究探讨miR-134靶向MMP1对喉癌细胞的增殖、凋亡、侵袭和迁移的影响,以期为喉癌的诊治提供新的分子靶点。
1 材料与方法
1.1 试剂及仪器
喉癌细胞系Hep-2和HEK293T细胞购自中国科学院上海生命科学研究院细胞资源中心;RPMI-1640培养基、胎牛血清、1%青霉素-链霉素混合液(双抗)和胰蛋白酶购自美国Gibco公司;脂质体lipfectamine 2000(Lip2000)和TRIzol购自美国Invitrogen公司;CCK-8细胞增殖检测试剂盒购自日本同仁株式会社化学研究所;AnnexinⅤ-FITC/碘化丙锭(PI)双染细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;Western blot全套试剂购自碧云天生物技术研究所;兔抗人MMP1单克隆抗体及鼠抗人GAPDH单克隆抗体(一抗)和辣根过氧化物酶标记的羊抗兔IgG(二抗)均购自英国Abcam公司;miR-134 mimics、antagomir和WT MMP1 3′-UTR、Mut MMP1 3′-UTR质粒购自上海吉凯生物科技公司。双荧光素酶报告检测试剂盒购自美国GeneCopoeia公司。
1.2 方法
1.2.1细胞培养及转染
Hep-2细胞用含10%胎牛血清和1%双抗的RPMI-1640完全培养液,置于37 ℃、5% CO2培养箱中进行培养,每2~3天常规传代1次。转染实验分为miR-134 mimics组、miR-134 antagomir组和空白对照组,严格按照试剂盒说明书进行转染。
1.2.2双荧光素酶报告基因实验
借助miRNA靶基因预测数据库Targetscans,发现MMP1可作为miR-134的靶基因。为了验证预测的MMP1是否为miR-134的目标靶基因,以及miR-134对MMP1蛋白表达的影响,进行双荧光素酶报告基因实验。按转染试剂说明书分别将miR-134 mimics或mimics-NC与WT MMP1 3′-UTR和Mut MMP1 3′-UTR荧光素酶载体共转染HEK293T细胞,转染48 h后,检测上述细胞的相对荧光强度。
1.2.3CCK-8法检测细胞增殖活性
收集转染后的细胞,调整细胞浓度为1×105/mL,取100 μL细胞悬液接种于96孔板的1孔,做5个副孔。待细胞融合度达70%~80%时,向每孔中加入10 μL CCK-8试剂,置于培养箱中继续培养2~3 h,间断观察颜色变化,在波长450 nm处测量各孔的光密度值,以RPMI-1640培养基为空白对照组。
1.2.4流式细胞术检测细胞凋亡
收集转染48 h后的细胞,用预冷的PBS洗2次;加入300 μL的1×Binding Buffer重悬细胞,5 μL Annexin V-FITC摇匀,室温,避光孵育15 min。随后加入5 μL PI染色,混匀。然后再加入100 μL 1×Binding Buffer,上机检测细胞的凋亡率。
1.2.5Western blot检测MMP1蛋白表达
消化、收集细胞,RIPA提取细胞总蛋白,BCA法测定蛋白浓度。10% SDS-PAGE分离蛋白,将分离后的蛋白转移至PVDF膜上;然后用含5%脱脂奶粉的TBST封闭液室温封闭2 h;加入一抗[兔抗人MMP1和GAPDH单克隆抗体(体积稀释比例均为1∶800)],置于摇床上,4 ℃过夜,TBST洗膜3次;加入二抗[羊抗鼠IgG(体积稀释比例为1∶1 200)]常温条件下反应1 h,再用TBST洗膜3次,每次10 min;显影,采用Image J测定条带光密度,重复3次。
1.2.6Transwell法检测细胞迁移和侵袭能力
细胞迁移能力:将转染48 h后的细胞制成悬液,密度为1×104/mL。取100 μL细胞悬液加入Transwell小室上室,将600 μL完全培养基加入小室下室,培养24 h,甲醛固定,0.1%结晶紫染色,洗涤,拍照,高倍镜下随机取6个视野计数,取其均值,重复实验3次。细胞侵袭能力:将 Martrigel基质胶按 1∶6稀释后包被Transwell小室,4 ℃风干,37 ℃温育凝固,其余步骤同上述细胞迁移能力检测。
1.3 统计学处理
2 结 果
2.1 验证实验
转染miR-134 mimics的HEK293T细胞中,WT MMP1 3′-UTR报告载体的荧光素酶活性明显降低,与转染mimics-NC相比下降55.3%(P<0.01);而miR-134 mimics 对Mut MMP1 3′-UTR报告载体的荧光素酶活性无明显作用,见图1。双荧光素酶报告基因实验结果与数据库结果一致,miR-134能和MMP1的3′-UTR端结合。
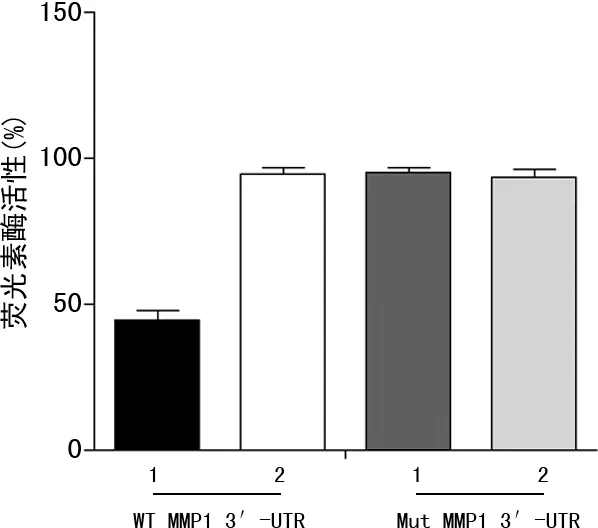
1:miR-134 mimics;2:mimics-NC。
2.2 miR-134对喉癌细胞增殖和凋亡的影响
miR-134 mimics 组细胞在转染后24 h的细胞活力明显低于空白对照组(P<0.01),而miR-134 antagomir组明显高于空白对照组(P<0.05),见图2。与空白对照组凋亡率[(4.32±0.36)%]比较,miR-134 mimics组[(12.02±0.45)%]明显增加(P<0.01),而miR-134 antagomir组[(2.31±0.26)%]明显降低(P<0.05),见图3。
2.3 miR-134对喉癌细胞侵袭和迁移的影响
与空白对照组比较,miR-134 mimics组的细胞侵袭和迁移能力明显减弱(P<0.05),miR-134 antagomir组的细胞侵袭和迁移能力明显增强(P<0.05),见图4。
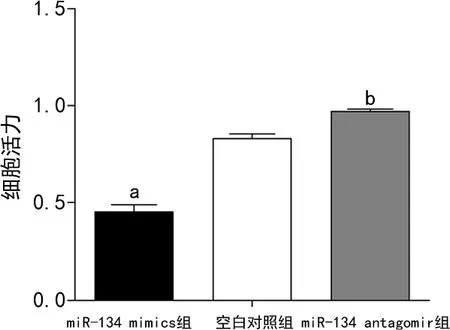
a:P<0.01,b:P<0.05,与空白对照组比较。
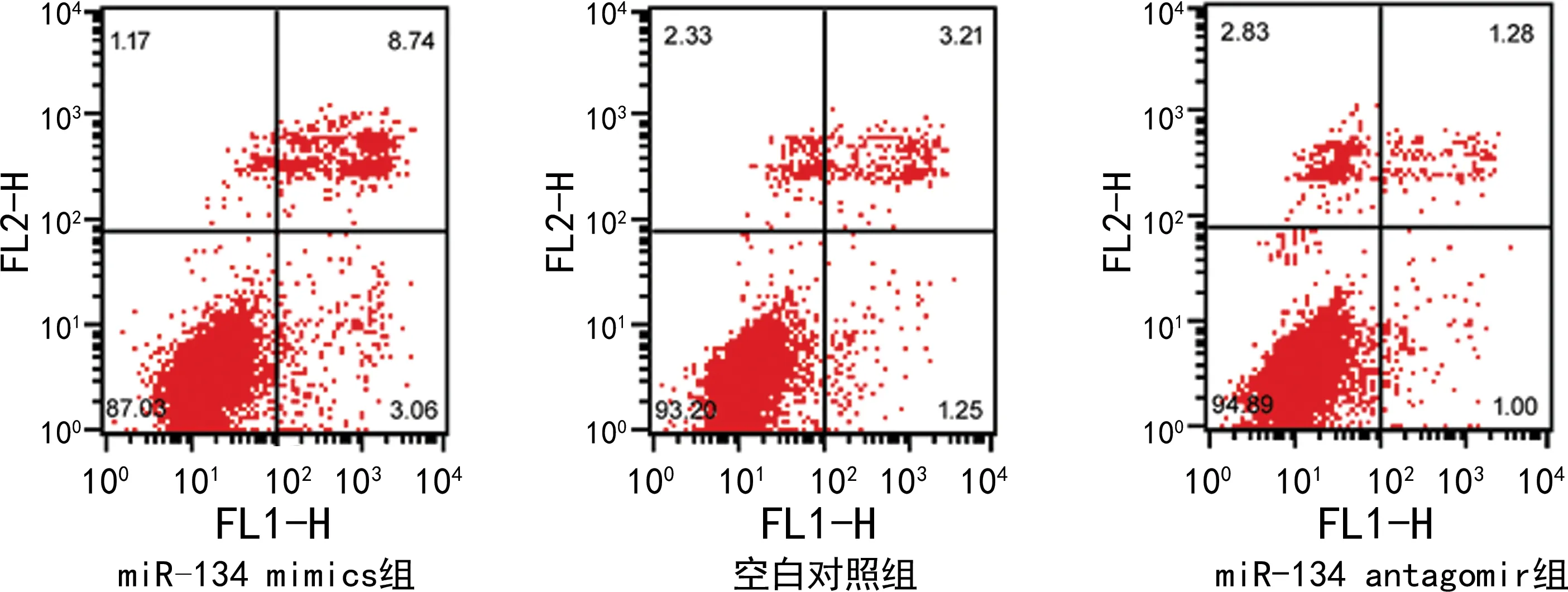
图3 各组喉癌细胞凋亡情况
2.4 miR-134对MMP1蛋白表达的影响
与空白对照组MMP1蛋白表达比较,miR-134 mimics组明显降低(P<0.05),而miR-134 antagomir组明显升高(P<0.05),见图5。
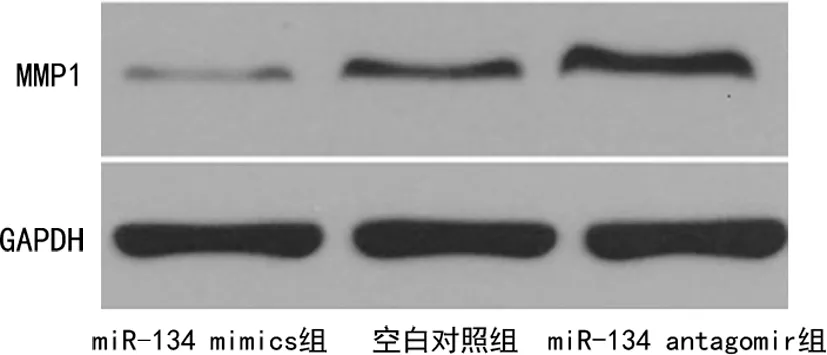
图5 各组MMP1蛋白表达情况
3 讨 论
肿瘤的发生、发展、浸润和转移是多种因素参与,多步骤,肿瘤细胞自身与机体内外界复杂连续相互作用的结果,其调控网络十分复杂。miRNAs是一类22~25 nt大小的非编码单链RNA,靶向结合miRNA的3′UTR,导致其降解和(或)抑制翻译,抑制靶基因蛋白表达。研究证据显示,miRNAs是一种可促进癌症发生或者抑制癌症发生的基因调节关键因子,在控制细胞增殖、分化、凋亡、侵袭及迁移等生物学过程中发挥着重要的作用[5]。miR-134位于染色体14q32,在维甲酸诱导的小鼠胚胎干细胞分化过程中表达上调,调控干细胞相关转录因子的编码序列,诱导小鼠胚胎干细胞的转录和形态学改变,从而产生新的表型[6]。越来越多的证据表明,miR-134通过多种方式参与头颈鳞状细胞癌发生、发展的调控过程,如miR-134靶向WWOX基因影响头颈鳞癌细胞系(OECM-1、SAS和HSC-3)体外致癌性、肿瘤发生和转移[7],miR-134靶向PDCD7降低上皮钙黏蛋白表达,加速口腔癌进展[8]。CHEN等[4]研究显示,miR-134在体内外靶向MMP1抑制骨肉瘤细胞侵袭和转移,这与本研究中的双荧光素酶报告实验结果一致,表明miR-134是MMP1转录过程中的调控因子之一。
在正常情况下,细胞外基质和细胞基底膜都受严格控制,在维持正常结构和生长进程中发挥着重要的作用。细胞外基质和细胞基质膜中MMPs的降解与恶性肿瘤的形成、生长、黏附、浸润和转移密不可分,这一过程是肿瘤细胞向周围组织转移的重要分子事件[9]。研究表明,MMPs蛋白表达异常与多种肿瘤晚期转移有关,如肺癌[10]、结直肠癌[11]、乳腺癌[12]等。MMP1位于11q22.3,是MMPs的重要成员之一,它可以降解Ⅰ型、Ⅱ型和Ⅲ型间质胶原蛋白,为癌细胞侵入基质屏障和通过组织间质迁移扫清障碍[13]。差异表达分析显示,MMP1在喉癌癌灶组织中高表达,与肿瘤生存率呈显著负相关[3,14],但MMP1在喉癌中的生物学作用不清。本研究表明,过表达miR-134,下调MMP1蛋白表达,减少细胞增殖活性,抑制侵袭和迁移,增加细胞凋亡率,这与miR-134/MMP1在骨肉瘤细胞中发挥的效应一致[4]。MMP1促进肿瘤发生的病理机制可能在于通过分解Ⅰ型胶原,参与肿瘤的侵袭和转移[15]。
本研究对miR-134/MMP1在喉癌细胞中的作用进行了初步研究,然而存在以下不足之处:(1)未用临床标本验证已发表文献MMP1在喉癌组织的高表达,且仅取1种喉癌细胞系进行了研究,今后应开展临床研究和扩大细胞系,以验证本研究结论和明确临床意义;(2)miR-134/MMP1介导喉癌发生、发展的具体机制仍不清楚,后续应加强研究。
综上所述,本研究发现miR-134是MMP1表达调控机制之一,miR-134/MMP1调控喉癌细胞基本生物学行为,为阐明其调控的分子机制提供了重要的证据,且为其防治提供了潜在的分子靶点。
