新城疫病毒山西分离株的分离鉴定及毒力分析
2021-12-09刘华栋李婷婷丁树荣陆冰洋王彩先
刘华栋,李婷婷,唐 娟,丁树荣,陆冰洋,王彩先
(山西农业大学动物医学学院,山西太原030032)
新城疫(newcastle disease,ND)是由新城疫病毒(newcastle disease virus,NDV)感染引起的一种传染性疾病,以高发病率和高病死率为特征,严重危害养鸡业的发展。因疫苗的研制及应用,新城疫的流行和传播受到控制。但NDV也通过不断地变异,使得疫苗的保护力不足,导致鸡群发病率有所升高[1]。
NDV基因组可编码6种结构蛋白,分别是NP核蛋白、F融合蛋白、M基质蛋白、P磷蛋白、HN血凝素-神经氨酸酶和L聚合酶,其中F融合蛋白与NDV的致病性和免疫应答过程具有相关性,在其中起重要作用[2]。本研究从山西省不同养殖场分离鉴定了4株病毒,对其F基因序列进行研究,确定分离到的病毒均为基因Ⅱ型弱毒株,并进行了生物学毒力测定和动物回归试验。以期确定山西地区当前NDV流行毒株的基因型以及毒力强弱,为本病的防控和病原的净化提供参考。
1 材料与方法
1.1 病料来源
病料采集于山西地区不同养殖场。采用灭菌生理盐水将棉签浸湿,在发病鸡的喉头和泄殖腔内旋转轻触,将得到的咽肛拭子置于1.5 mL灭菌离心管,加入含有50%甘油的生理盐水,标记,保存。无菌取病死鸡的肝、脾、肺等器官,置于一次性封口袋中并标记,-20℃保存。
1.2 试剂与培养基
新城疫病毒通用型RT-PCR检测试剂盒、RNA提取试剂盒,均购自北京世纪元亨动物防疫技术有限公司;M-MuLV First Strand cDNA Synthesis Kit M-MuLV第一链cDNA合成试剂盒(BS249)、6×DNA Loading Dye、Marker、DreamTaq DNA聚合酶、PCR产物纯化回收试剂盒(SK1131)、蔗糖、琼脂糖、琼脂粉、营养琼脂、阿氏液,均购自生工生物工程(上海)股份有限公司;PrimeScript™RT reagent Kit with gDNA Eraser试剂盒购自TaKaRa公司;SPF蛋购自北京勃林格殷格翰维通生物技术有限公司;鲜血琼脂培养基购自青岛日水科技有限公司。
引物序列合成和PCR产物测序由生工生物工程(上海)股份有限公司完成。
1.3 试验动物
1日龄、2周龄、60日龄的雏鸡,均由SPF蛋孵化,饲养于试验动物房。
1.4 试验方法
1.4.1 PCR鉴定
取少许肺、肝、脾等组织混合,称取1 g,剪碎后混匀,取0.05 g进行无菌研磨,边加入生理盐水1.5 mL,继续研磨成匀浆后转至新的1.5 mL灭菌离心管中8 000 r/min离心2 min,离心完成后取100µL上清液转移至新的1.5 mL灭菌离心管中。采用新城疫病毒通用型RT-PCR检测试剂盒提取病毒RNA,进行PCR扩增。
PCR采用的扩增体系为:1.2µL酶混合液、2µL RNA模板、16.8µL RT-PCR反应液,总体积为20µL。
PCR扩 增 程 序 为:42℃、45 min;94℃、3 min;94℃、30 s,55℃、30 s,72℃、30 s,以上步骤循环35次;72℃终延伸7 min,结束反应。PCR产物经1%琼脂糖凝胶电泳观察。
1.4.2 病毒分离培养
无菌取发病鸡和病死鸡体内肝脏、脾脏、肺脏等组织,3次冻融后加入PBS溶液研磨,置于4℃低温经10 000 r/min离心15 min后取上清,将其转入另一灭菌离心管中,加入双抗(青霉素10 000 IU/mL、链霉素10 g/L),37℃感作作用1 h;使用0.22 µm滤膜过滤,尿囊腔接种10日龄SPF鸡胚5枚,每枚蛋接种0.2 mL滤液。
蛋保存于孵化箱内,每隔6 h照蛋1次,将24 h内死亡的鸡胚弃去,死亡鸡胚4℃保存过夜;鸡胚尿囊液收集到无菌器皿,观察死亡鸡胚情况。采用血凝试验检测尿囊液中有无凝集现象。1.4.3F基因扩增
1.4.3.1 引物设计
F基因序列参照NCBI上已发表的序列,应用Primer Premier设计引物,可扩增F基因中位于94~457之间的区段,长度为363 bp。
序列为F-F:5'-TTGATGGCAGGCCTCTTGC-3';FR:5'-GGAGGATGTTGGCAGCAT-3'。
1.4.3.2 RNA提取参照RNA提取试剂盒说明书从1.4.2中收获的鸡胚尿囊液中提取新城疫病毒RAN。
1.4.3.3 反转录
参照M-MuLV First Strand cDNA Synthesis Kit M-MuLV第一链cDNA合成试剂盒说明书,将提取的新城疫RNA反转录为cDNA。
反转录反应体系(总体积为20µL):RNA溶液10µL、Prime Script RT Enzyme MixⅠ1 µL、RT Primer Mix 1µL、5×Prime Script Buffer 4µL、RNase Free dH2O 4µL。
反转录反应程序:37℃、15 min;85℃、5 s;完成后置于4℃保存。
1.4.3.4 PCR扩增
PCR扩增体系(总体积为100 µL):10×DreamTaq Buffer 10 µL、dNTP(10 mmol/L)6 µL、Template 20 µL、Taq酶(5 U/µL)0.5 µL、Mgcl26 µL、上下游引物各2 µL(25µmol/L)、超纯水加至100µL,进行RCR扩增。
PCR扩增程序为:98℃预变性5 min;98℃变性10 s,55℃退火30 s,72℃延伸90 s,以上步骤循环35次;72℃延伸10 min,4℃保存。
PCR产物经1%琼脂糖凝胶电泳观察,切取目的片段进行PCR产物回收,按照回收试剂盒说明书操作。
1.4.4 序列分析
使用软件DNAStar,DNAMAN将测序的F基因的序列片段与GenBank中发表的NDV参考毒株相应片段序列进行氨基酸序列比对、同源性分析和遗传进化分析。
1.4.5 生物学毒力测定
对4株NDV分离株进行毒力测定,检测平均鸡胚致死时间(MDT)、静脉致病指数(IVPI)、脑内致病指数(ICPI)等3个指数。参照OIE标准[3]方法进行操作。
1.4.6 动物回归试验
取25只15日龄非免疫雏鸡,应用HI方法采血测定ND抗体。取结果为阴性的雏鸡作为试验组采用滴鼻点眼的方式滴入第三代鸡胚尿囊液,对照组滴入灭菌生理盐水,0.1 mL/只。8只雏鸡分别滴入4株病毒的鸡胚尿囊液,2只雏鸡滴入生理盐水作为对照。经过2 w的隔离饲养,观察并记录试验选用雏鸡的发病情况,从发病鸡体内分离病毒并进行PCR鉴定。
2 结果与分析
2.1 PCR鉴定结果(见图1)
由图1可知,4份病料均扩增362 bp的条带。
2.2 病毒分离培养结果
24 h后死亡的鸡胚及96 h未死亡的鸡胚经4℃过夜,鸡胚多呈现周身发红、出血。未死亡鸡胚头颈部出血明显,并存在不同程度的水肿。通过血凝试验可知,尿囊液能够凝集10 mL/L的鸡红细胞,凝集价在1~4 log2之间。
2.3 F基因扩增结果(见图2)
由图2可知,采集的4份病料均扩增363 bp的条带。
2.4 序列分析结果(见图3、图4)
由测序结果可知,4株NDV分离株的112~117位的氨基酸序列均为GRQGRL,与标准的弱毒株具有相同的序列,并非强毒株应有的RRQKRF序列。第101位、121位氨基酸序列为R和I,也与弱毒株相同,这些位点均为区分强弱毒株的位点。结果表明,4株NDV山西分离株均为弱毒株。毒株F基因的亲缘关系和同源性见图3、图4。
由图3可知,4株NDV山西分离株均与Clone30、La Sota、VG/GA株等位置接近,处于同一个分支,即具有最近的亲缘关系,与基因Ⅶd型毒株的亲缘关系最远。
由图4可知,本研究分离到的4株NDV山西分离株相互之间具有较高的同源性。与其他毒株的同源性中,以与Clone30、La Sota以及VG/GA株的同源性最高。
2.5 NDV分离株毒力测定结果(见表1)
由表1可知,MDT指数最高的是SX-1和SX-4,均为120.00;IVPI指数中SX-4最高,为0.6;ICPI指数均为0;由此判定分离到的4株NDV均为弱毒株。
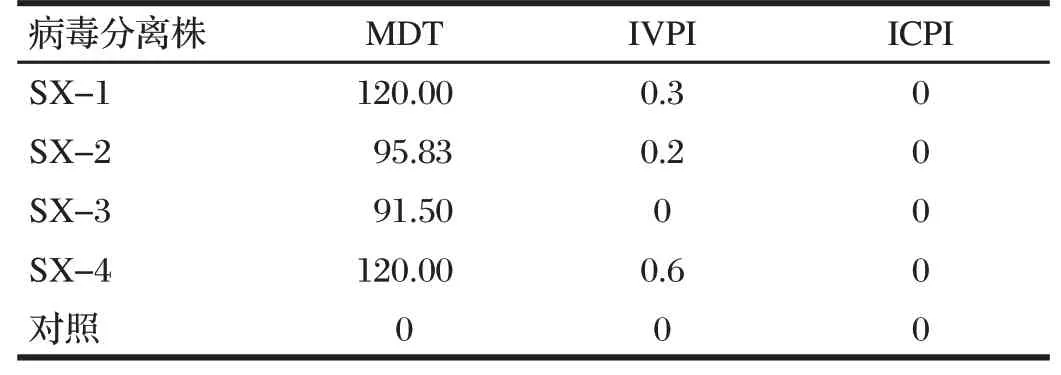
表1 NDV分离株毒力测定结果Tab.1 Result of virulence of NDV isolates
2.6 动物回归试验结果
雏鸡在攻毒后第4 d开始出现发病,表现为精神沉郁、食欲减退,个别雏鸡粪便呈黄绿色,但未出现病鸡死亡。对发病鸡进行剖检,腺胃乳头上有散在的点状出血;十二指肠黏膜上有出血点,双侧盲肠扁桃体均肿大出血。采集内脏进行PCR检测,均可以检测到NDV。
3 讨论
通过PCR鉴定,确定所采集的病料中含有NDV。针对不同鸡场采集的病料中分离的NDV分别接种鸡胚尿囊液培养,分离出4株NDV病毒,对其F基因进行扩增和测序,发现均与Clone30、La Sota以及VG/GA株等弱毒株同源性最高,且具有较高的亲缘关系,可知本次分离到的毒株为弱毒株,属于基因Ⅱ型。生物学试验结果也表明,该NDV病毒毒株为弱毒株。对分离NDV进行动物回归试验,结果表明其具有明显的致病性,虽然其与Clone30、La Sota等疫苗株具有较高的同源性,但并非疫苗株。
基因Ⅶ型已经成为我国NDV流行的主要优势基因型[4]。全国各地纷纷报道了该地区分离到的NDV为基因Ⅶ型强毒株。张贺楠等[5]于2016年在山东分离到NDV强毒株,属于基因Ⅶd型。朱小甫等[6]从陕西省渭南市分离到NDV强毒株,属于基因Ⅶ型。胡北侠等[7]甚至从蛋鸡输卵管积液中分离到基因Ⅶ型NDV强毒株。山西也有分离到基因Ⅶd型NDV的相关报道[8]。而本次从山西地区分离到的病毒均为基因Ⅱ型弱毒株。说明在山西地区同时存在NDV基因在Ⅱ型弱毒株的流行。
当前的弱毒疫苗毒株均为基因Ⅱ型,本次分离株均与疫苗株同属基因Ⅱ型,主要位点氨基酸序列一致,应不存在保护力不足的问题。而本次采样的养鸡场均免疫过新城疫疫苗,说明这些鸡场免疫失败。常见免疫失败的原因有疫苗质量、运输和保存、种类的选择不当、剂量不足或过量和接种途径不当等[9]。经过与这些养殖场主进行沟通和交流,发现在这些养鸡场中均存在一些免疫失败的因素。
本次分离病毒的发病鸡均为混合感染,未表现出新城疫的临床症状,最初怀疑其他疾病,但剖检可见疑似新城疫的病变,并从中分离到新城疫病毒。由此推断,非典型新城疫的感染可能普遍存在,在临床诊断中不可忽视,一旦确诊要及时进行大剂量疫苗紧急接种[10]。
4 结论
从山西地区分离到4株NDV,通过基因序列分析鉴定NDV均为基因Ⅱ型弱毒株,生物学毒力试验证实分离毒株均为弱毒株。经动物回归试验确定本次分离的NDV均有致病性,表明在山西地区存在NDV弱毒株的流行,应在养殖中加以预防。
