具有溶镉功能根际促生菌的筛选及强化龙葵富集镉的效果
2021-12-08杜东霞雷平吴民熙王震刘惠知
杜东霞 雷平 吴民熙 王震 刘惠知
摘要:从重金属污染土壤中分离到1株具有溶镉和促生长双重特性的耐镉根际促生长菌,经形态特征和系统发育分析,该菌株初步鉴定为惠州芽孢杆菌(Bacillus huizhouensis sp.),命名为DN14,该菌株具有溶镉、溶磷、产铁载体、产吲哚乙酸和固氮的多种性能。盆栽试验表明,当菌株DN14的接种量为 80 mL/盆时,龙葵的促生长效果最显著,株高增加28.8%,地上部生物量增加40%,地下部生物量增加50%。龙葵根、茎及叶中的镉含量也均出现明显的增加,其中根部镉含量增加与对照相比差异显著(P<0.05),可达42.5%,茎和叶中镉含量分别提高 32.7%和27.9%。植物-微生物联合修复技术是一种很有前途的重金属污染土壤生态环保修复技术,不仅可以显著提高植物修复效率,而且可以改良土壤,为重金属污染土壤的生态修复治理提供一种新途径。
关键词:镉;促生长菌;铁载体;植物修复;龙葵
中图分类号: S182;X53 文献标志码: A
文章编号:1002-1302(2021)22-0241-06
收稿日期:2021-05-25
基金项目:湖南省重点研发项目(编号:2019NK2192)。
作者简介:杜东霞(1980—),女,山东菏泽人,硕士,高级工程师,主要从事农用微生物基础与应用研究。E-mail:xiaxia414@126.com。
通信作者:刘惠知,硕士,研究员级高级工程师,主要从事农用生物基础与应用研究。E-mail:719641546@qq.com。
近年来,我国土壤环境问题日益凸显,据2014年国家环境保护部和国土资源部发布的全国土壤污染状况调查公报,全国近160万km2土地受到重金属污染,其中镉(Cd)的点位超标率高达7.0%[1]。湖南省是全国最大的稻米产区之一,素有“鱼米之乡”的美誉,但同时湖南省也是镉污染最严重的地区之一[2]。因此,亟需针对镉污染农田土壤开展修复技术研究。
目前,国内重金属污染土壤治理技术,如化学沉淀、膜过滤、离子交换、电动力学技术等可用于从土壤中去除镉,但这些方法通常存在成本高昂、副效应多、打破土壤生态结构等突出问题,因此并不适合用来治理大面积的中轻度重金属污染耕地[3-4]。近年来,由于微生物所具备的促生长、镉吸附和镉活化能力,及其作为修复载体的低成本和环境友好的性能,越来越受到研究者的广泛关注[5-6]。
目前,发现的镉超富集植物已有 60 余种,如东南景天、龙葵、宝山堇菜、蒲公英等,国内常用的镉超累积植物主要是东南景天和龙葵[7-9]。植物修复技术在修复镉污染土壤中具有成本低廉、技术简单、就地修复等优势,但已发现的重金属超富集植物多为草本科,其共同特点是富集效率高,但生物量较小,同时受外部环境条件的影响,富集效果不甚理想[10]。为解决这一弊端,开展了植物-微生物联合修复技术,相关研究表明,促生菌可通过产生长素(ZAA)、产铁载体、溶磷解钾等作用促进植物生长;微生物还可通过产有机酸、分泌胞外酶和产胞外多糖等作用改变根际土壤酸碱性及镉在土壤中的存在形态等,进而提高植物对镉污染土壤的修复效率[11-14]。基于此,笔者所在课题组筛选了1株集耐镉、溶镉、产IAA、产铁载体、溶磷和固氮等功能于一身的功能菌株,以此寻求突破植物修复技术的發展瓶颈。
1 材料与方法
1.1 供试材料
1.1.1 培养基
LB培养基、Ashby培养基、CAS培养基、孟加拉红(PKO)培养基(无机磷)、MSA培养基[15-17]。
1.1.2 主要试剂
氯化镉(CdCl2·2.5H2O,分析纯),国药集团化学试剂有限公司生产;碳酸镉(CdCO3,分析纯),上海麦克林生化科技有限公司生产;Salkowski 试剂、钼锑抗显色剂和二硝基酚指示剂,均购自国药集团化学试剂有限公司。
1.2 测定分析方法
1.2.1 供试土壤样品采集
土壤样品为湖南省某镉重度污染区龙葵的根际土壤,抖落植物根系表面松散的土壤,采集紧密附着在根系表面的土(根际土),将其装入预先准备好的无菌袋中密封,迅速带回实验室置于4 ℃冰箱保存。用于盆栽的土壤为采自0~20 cm深的耕作层土壤,将其除杂、风干、粉碎、过10目筛后充分混合,土壤的理化性质见表1。
1.2.2 耐镉根际促生菌的分离
称取10 g镉重度污染区根际土壤样品,迅速放入盛有90 mL LB液体培养基的250 mL锥形瓶中(添加玻璃珠),于 30 ℃、180 r/min振荡培养1 h,静置30 min。用10倍梯度稀释法将土壤悬浮液依次稀释至10-1、10-2、10-3和 10-4,选择 10-3和 10-4稀释液分别涂布在镉含量为50 mg/L的初筛固体培养基上,30 ℃倒置培养,待菌落长出后,选择菌落和形态差异较大的菌株依次划线接种到镉浓度更高(100、150、200 mg/L)的固体培养基上培养,根据菌株生长情况,逐步淘汰抗镉能力差且生长慢的菌株。挑选耐镉能力强的优异菌株,并将其单菌落在固体培养基上划线3 次以上进行纯化,斜面4 ℃保藏用于后续试验。
1.2.3 根际耐镉促生菌的促生性能测定
(1)溶磷能力定性定量测定:分别采用透明圈法和钼锑比色法定性定量测定菌株的溶磷能力,参照文献[15]。
(2)产铁载体定性定量测定:分别采用CAS平板法和630 nm相对吸光度测定法测定菌株产铁载体的能力,参照文献[16]。
(3)产吲哚乙酸(IAA)能力定性定量测定:分别采用微孔板比色法和530 nm相对吸光度测定法测定菌株产吲哚乙酸的能力,参照文献[18]。
(4)固氮能力测定:采用点板方法测定菌株的固氮能力,参照文献[19]。
1.2.4 菌株耐镉能力测定
配制镉浓度分别为 20~200 mg/L的LB液体培养基试管并灭菌,镉的浓度梯度设置为20 mg/L,菌液的接种量为2%,每个处理3个重复。试管接种后于30 ℃,140 r/min,振荡培养24 h,并测定试管中细菌培养液的D600 nm,通过比较细菌在不同镉浓度液体培养基中的生长状况初步判断细菌的耐镉能力。根据初步判断的结果,再以10 mg/L的镉浓度梯度递增或递减来获得细菌对镉的最低抑制浓度和致死浓度。
1.2.5 菌株活化碳酸镉能力测定
配制2瓶 100 mL 的LB 液体培养基并加入碳酸镉粉末(0.1 g/L;Cd 浓度:65.19 mg/L),其中1瓶接种细菌(按2%的接种量),另1瓶不加菌液作为对照,于30 ℃,180 r/min振荡培养2 d,离心收集上清,并过0.22 μm滤膜,滤液用ICP-MS测定溶液镉浓度。每个处理3个重复。菌株对碳酸镉活化率的计算公式如下:
活化率=上清液Cd2+浓度/初始Cd浓度×100%。
1.2.6 菌株对Cd2+的吸附试验
配制镉离子起始浓度分别为20、40、60、80、100、120 mg/L的 LB 液体培养基,并按2%的接种量接种菌株,于30 ℃,180 r/min振荡培养2 d,高速离心收集上清,利用ICP-MS测定上清液中的镉含量,每份样品设 3 个重复。
1.2.7 菌株 16S rDNA 的 PCR 扩增和系统发育分析
利用细菌DNA抽提试剂盒抽提菌株的基因组 DNA。依照细菌 16S rDNA 中的保守区设计并合成引物。引物序列如下:27-F:5′-GAGAGTTTGATCCTGGCTCAG-3′;1492-R:5′-AAGGAGGTGATCCARCCGCA-3′。
PCR 扩增和产物纯化参照文献[20],PCR 产物测序由生工生物工程(上海)股份有限公司完成。将测序后的序列与 GenBank数据中已有的16S rDNA 序列进行相似性分析,利用MEGA7.0 构建系统发育树。
1.2.8 盆栽试验
盆栽试验是2020年在湖南省微生物研究院实验大楼楼顶日光温室内进行,盆栽土壤风干后过10目筛,采用180 cm×260 cm的灰盆,每盆装2.5 kg土壤。设置6个处理,包括菌株DN14接种量分别为20、40、60、80、100 mL/盆的处理,以及不接菌的空白对照(CK),各处理设置3个平行。
将龙葵种子用去离子水冲洗 3 遍,然后用过氧化氢(5%)浸泡 30 min,再用去离子水反复冲洗 3 遍,常温晾干后备用。在大培养皿中铺上经无菌水润湿的滤纸,再将龙葵种子均匀地分散其上,置于恒温培养箱中在 28 ℃下催芽2 d。待种子露白后再将其转入蛭石盘中,并保持湿润,每孔放置 2 粒种子。待幼苗长至 6~7张叶时,移栽至预先装好土的花盆中。待龙葵幼苗在花盆中生长 10 d 后,开始施加菌液。将菌株DN14活化培养后,于8 000 r/min离心 5 min 收集菌体,将得到的菌体用无菌水重悬至菌体浓度约为1×108 CFU/mL,即得到待处理菌体悬液。分别在龙葵植株的根际接种20、40、60、80、100 mL(菌体悬液浓度约为1×108 CFU/mL)5个处理,每个处理3 次重复,同时设定添加相同体积无菌水的空白对照处理。
1.2.9 龙葵生长指标测定
龙葵生长后期,测量龙葵株高,用不锈钢剪刀将龙葵根、茎、叶分离并分别称质量,105 ℃杀青10 min,70 ℃烘干至恒质量,并分别测定根、茎、叶的干质量。
1.2.10 龙葵Cd含量测定
将烘干后龙葵样品的根、茎、叶分别粉碎后,用 HNO3-H2O2 (3 ∶1,体积比)法消化,消解后的样品用去离子水稀释,采用 ICP-MS法测定样品内镉含量。
1.3 数据处理
用Excel 2010统计数据,用SPSS 20.0进行单因素方差分析和多重比较(α=0.05),用 OriginPro 8.0绘图,所有数据均为3次试验平均值。
2 结果与分析
2.1 耐镉促生菌的分离筛选及分子生物学鉴定
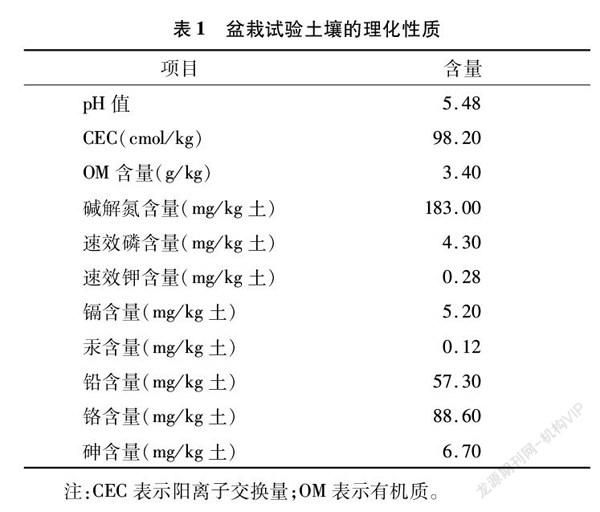
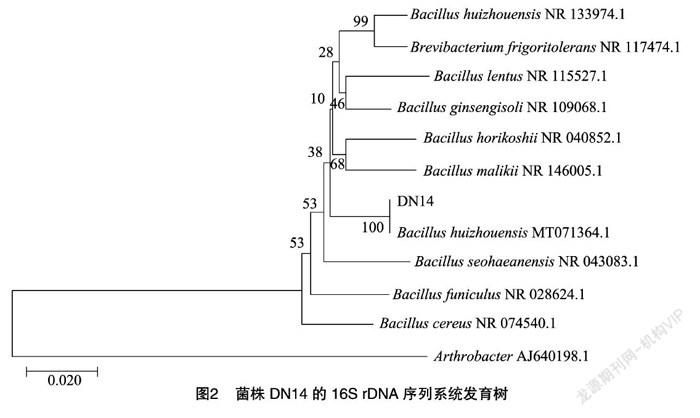
采用梯度浓度稀释法从重金属污染土壤中分离筛选出6株耐镉细菌。其中菌株DN14对镉的耐受性最高,可在镉浓度为100 mg/L的培养基平板上生长,且生长速度较快。促生长定性试验表明,该菌株同时具有产吲哚乙酸IAA、产铁载体和溶磷能力(图1),并且该菌株可在Ashby无氮琼脂平板上旺盛生长。BLAST分析表明,菌株DN14 与惠州芽孢杆菌(Bacillus huizhouensis,MT071364.1)的16S rDNA序列相似度达到99%。对菌株DN14的16S rDNA序列用MEGA7.0分析软件构建系统发育树(图2),初步鉴定菌株DN14为惠州芽孢杆菌(Bacillus huizhouensis sp.)。
2.2 产IAA能力定量
菌株DN14产IAA定量试验结果表明,该菌株产生IAA的能力较强,平均产生水平在(8.8±0.3) mg/L。IAA是植物体中普遍存在的生长素类物质,说明DN14具有潛在的促进根系生长的能力。
2.3 产铁载体能力定量
菌株DN14产铁载体定量试验结果表明,该菌株产生铁载体的能力较强,产铁载体活性高达(38.4±1.5)%,说明DN14能通过较强的产铁载体能力螯合铁元素促进植物生长。
2.4 溶磷能力定量
菌株DN14溶磷能力定量试验结果表明,该菌株溶磷能力较强,溶磷能力为(29.2±2.0) mg/L,说明该菌株可通过分泌低分子有机酸,降低pH值使难溶磷或不溶磷转换为植物易于吸收的有效态磷,进而促进植物磷元素吸收。
2.5 菌株的 Cd 耐受性和活化性能
菌株DN14在Cd2+浓度为100 mg/L左右时生长受到明显抑制,其最低致死浓度为170 mg/L。由此可见,细菌DN14对Cd2+具有较高的耐受性(图3)。
从表2可见,未接种菌株 DN14对照的培养液pH值为6.64±0.38,接种菌株DN14 的培养液 pH值为4.24±0.09,降低了2.4。与不接菌对照相比,接种 DN14菌株的培养液中有效镉含量增加了229.9倍,大大增加了溶液中的有效镉含量。
2.6 菌株对Cd2+的吸附性
从图4可以看出,溶液不同初始 Cd2+浓度对菌株DN14镉吸附能力有显著的影响。在Cd2+浓度为20 mg/L时,镉的吸附率达到最高,为65%,随着 Cd2+浓度的增加,菌株的吸附率呈线性降低。
2.7 菌株处理对龙葵生长指标的影响
从图5可以看出,相对不接种菌株的空白对照,当菌株DN14的接种量分别为20、40、60、80、100 mL/盆时,株高相应增加了 11.1%、15.5%、22.2%、28.8%、26.7%。当菌株DN14的接种量为80 mL/盆时,对龙葵株高的促生长效果最显著。
相对不接种菌株的空白对照,当菌株DN14的
接种量分别为20、40、60、80、100 mL/盆时,地上生物量相应增加了13.3%、23.3%、33.3%、40.0%、33.3%(图6-A)。地下生物量相应增加了25.0%、25.0%、12.5%、50.0%、25.0%(图6-B)。当菌株DN14的接种量为 80 mL/盆时,龙葵的地上生物量增加最明显,可达40%;地下生物量也增加最明显,高达50%。试验结果进一步表明,菌株DN14的接种量为80 mL/盆(菌液浓度约为 1×108 CFU/mL)时,对龙葵的促生长效果最明显。
2.8 接种菌株DN14对龙葵富集镉的影响
从图7可以看出,相对不接种菌株的空白对照,当菌株DN14的接种量为 80 mL/盆时,龙葵根、茎及叶中的镉含量均出现明显的增加。其中根部镉含量增加效果与对照相比差异显著(P<0.05),可达42.5%,茎和叶中镉含量分别提高 32.7%和27.9%。
从表3可以看出,相对不接种菌株的空白对照,接种菌株DN14植株的地上部和地下部的镉富集量均有增加,其中地下部镉含量增加达到显著水平,可达42.6%,镉富集总量增加了9.1 μg/株;地上部镉富集量提高了30.2%,镉富集总量增加了49.0 μg/株。
3 结论与讨论
利用镉超积累植物的高富集能力将土壤中的镉拔除是一种重要的土壤修复治理技术,近年来受到广泛关注。随着研究的不断深入,研究者们发现,植物-微生物联合修复技术作为一种新的技术途径,在镉污染土壤的修复治理中应用越来越广泛。它不仅可以改善单独植物修复中长期存在的
修复周期长、植株生物量小等疑难问题,而且可以改良土壤,大幅提高修复效率[21]。
根际促生菌在土壤中发挥促生功能主要包括2个方面,一是通过生物固氮、解磷、解钾、产铁载体等作用有效促进植物对土壤中营养元素的吸收;二是通过产生长素(indole-3-acetic acid,简称IAA)、赤霉素(gibberellins acid,简称GA)等调节植物生长[22-24]。本研究在菌株筛选过程中,也是主要从促进植物营养吸收和植物生长发育这2个方面着手,考察了与此相关的4项指标,即定性定量测定菌株的溶磷、产铁载体和产IAA的能力,定性测定了菌株的固氮能力,筛选到的6株促生效果好的菌株中,DN14效果最明显,兼具溶磷、产铁载体、产IAA和固氮能力,而且该菌株可在镉浓度为100 mg/L的培养基平板上正常生长。通过在镉胁迫下的盆栽试验,菌株DN14可显著促进龙葵株高的生长,地上部和地下部干物质积累。本研究结果表明,接种菌株DN14促进了龙葵在镉污染环境中的生长,而且由于促生菌株作用下缓解了镉胁迫对龙葵的毒害作用。
龙葵植株镉富集能力测定分析结果表明,无论是龙葵的地上部分还是地下部分,接种菌株DN14处理根、茎和叶中的镉含量均有所提升,其中根部镉富集能力达到了显著水平(P<0.05),可达42.5%,茎和叶中镉含量也分别提高 32.7%和27.9%。这可能是由于菌株DN14对土壤中镉的活化作用,也可能是由于接种菌株DN14大幅提高了植株的生物量,带动了龙葵对土壤镉的吸收。在接种菌株DN14的处理中地下部镉含量显著增加,转移系数有所减小,可能是由于菌株DN14促进了植物地下部镉的富集,但抑制了镉向地上部迁移,使茎叶镉含量降低,从而减轻了镉对龙葵地上部的毒害。
综上所述,接种菌株DN14可明显促进龙葵的生长发育和提高龙葵植株的镉吸收总量,说明依据根际促生菌株与宿主植物的有利共生关系,利用优良镉抗性促生菌株强化超富集植物龙葵的镉吸收效率是切实可行的。 但菌株DN14促进龙葵的生长还受到外界环境因素(温度、水分、肥料、土壤理化性质等) 的影响,如研究不同镉污染水平下菌株DN14的次生代谢产物、微生物群落结构组成及微生物酶活性的差异,不同酸碱性土壤条件下镉存在的形态差异,因此本研究还有待在大田条件下进行验证。
农田的镉污染涉及面积较广、治理困难而且治理周期长,在实际操作中更易于采用“边修复、边生产”的修复模式,既要确保农民种田的收益,又要不断去除土壤中的鎘,确保食品安全[25]。本研究筛选获得的菌株DN14具有优良的促生性能,可利用镉超富集植物与经济作物(如油菜、棉花等)间作,间作模式既可强化龙葵富集镉,又促进了经济作物的生长发育,这种龙葵-微生物联合修复技术在农田土壤的镉污染修复中具有较强的可操作性和实用性,为制备田间生态兼具溶镉促生功能菌剂奠定了基础。
本研究篩选了1株兼具溶镉和促生长双重功能的菌株,经生理生化和分子生物学鉴定为惠州芽孢杆菌(Bacillus huizhouensis sp.),耐镉浓度达到100 mg/L。经定性和定量试验测定,该菌株具有显著的溶磷、产铁载体和产IAA能力,经定性试验测定,该菌株还具有固氮能力,并且对土壤中不溶性镉的活化能力突出。有望应用于重金属污染农田的植物-微生物联合修复中,进而提高土壤中镉的生物有效性和解决超累积植物矮小、生长缓慢、生物量低、实际应用价值低等制约植物修复技术发展的瓶颈问题。
参考文献:
[1]Yang W J,Wang S L,Zhou H,et al. Combined amendment reduces soil Cd availability and rice Cd accumulation in three consecutive rice planting seasons[J]. Journal of Environmental Sciences,2022,111(1):141-152.
[2]Liu Y L,Tie B Q,Li Y,et al. Inoculation of soil with cadmium-resistant bacterium Delftia sp.B9 reduces cadmium accumulation in rice (Oryza sativa L.) grains[J]. Ecotoxicology and Environmental Safety,2018,163:223-229.
[3]Vijayaraghavan K,Yun Y S.Bacterial biosorbents and biosorption[J]. Biotechnology Advances,2008,26(3):266-291.
[4]zdemir S,Kilinc E,Poli A,et al. Biosorption of Cd,Cu,Ni,Mn and Zn from aqueous solutions by thermophilic bacteria,Geobacillus toebii sub. sp. decanicus and Geobacillus thermoleovorans sub. sp.stromboliensis:Equilibrium,kinetic and thermodynamic studies[J]. Chemical Engineering Journal,2009,152(1):195-206.
[5]Ren G M,Jin Y,Zhang C M,et al. Characteristics of Bacillus sp. PZ-1 and its biosorption to Pb(Ⅱ)[J]. Ecotoxicology and Environmental Safety,2015,117:141-148.
[6]Jin Z M,Deng S Q,Wen Y C,et al. Application of Simplicillium chinense for Cd and Pb biosorption and enhancing heavy metal phytoremediation of soils[J]. Science of the Total Environment,2019,697:134148.
[7]Yang X E,Long X X,Ye H B,et al. Cadmium tolerance and hyperaccumulation in a new Zn-hyperaccumulating plant species (Sedum alfredii Hance)[J]. Plant and Soil,2004,259(1):181-189.
[8]Sun R L,Zhou Q X,Jin C X. Cadmium accumulation in relation to organic acids in leaves of Solanum nigrum L. as a newly found cadmium hyperaccumulator[J]. Plant and Soil,2006,285(1/2):125-134.
[9]Xu J,Sun J H,Du L G,et al. Comparative transcriptome analysis of cadmium responses in Solanum nigrum and Solanum torvum[J]. New Phytologist,2012,196(1):110-124.
[10]Ali H,Khan E,Sajad M A. Phytoremediation of heavy metals-Concepts and applications[J]. Chemosphere,2013,91(7):869-881.
[11]Glick B R.Using soil bacteria to facilitate phytoremediation[J]. Biotechnology Advances,2010,28(3):367-374.
[12]Ansari M I,Malik A. Biosorption of nickel and cadmium by metal resistant bacterial isolates from agricultural soil irrigated with industrial wastewater[J]. Bioresource Technology,2007,98(16):3149-3153.
[13]Nies D H. Microbial heavy-metal resistance[J]. Applied Microbiology and Biotechnology,1999,51(6):730-750.
[14]Roane T M,Kellogg S T. Characterization of bacterial communities in heavy metal contaminated soils[J]. Canadian Journal of Microbiology,1996,42(6):593-603.
[15]梁留陽,赵一通,张琳琳,等. 烟株根围土壤解磷巨大芽孢杆菌的鉴定及其解磷能力研究[J]. 土壤通报,2020,51(6):1461-1466.
[16]Schwyn B,Neilands J B.Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry,1987,160(1):47-56.
[17]赵龙飞,徐亚军,常佳丽,等. 具ACC脱氨酶活性大豆根瘤内生菌的筛选、抗性及促生作用[J]. 微生物学报,2016,56(6):1009-1021.
[18]Gordon S A,Weber R P.Colorimetric estimation of indoleacetic acid[J]. Plant Physiology,1951,26(1):192-195.
[19]陆依琳,赵晴雨,彭 学. 2株固氮菌的分离与鉴定[J]. 江苏农业科学,2020,48(16):298-302.
[20]Zeng X X,Tagn J X,Jiang P,et al. Isolation,characterization and extraction of mer gene of Hg2+ resisting strain D2[J]. Transactions of Nonferrous Metals Society of China,2010,20(3):507-512.
[21]魏树和,周启星,王 新. 超积累植物龙葵及其对镉的富集特征[J]. 环境科学,2005,26(3):167-171.
[22]Goswami D,Thakker J N,Dhandhukia P C.Portraying mechanics of plant growth promoting rhizobacteria (PGPR):a review[J]. Cogent Food & Agriculture,2016,2(1):1127500.
[23]Vessey J K.Plant growth promoting rhizobacteria as biofertilizers[J]. Plant and Soil,2003,255(2):571-586.
[24]Martínez-Viveros O,Jorquera M A,Crowley D E,et al. Mechanisms and practical considerations involved in plant growth promotion by rhizobacteria[J]. Journal of Soil Science and Plant Nutrition,2010,10(3):293-319
[25]Shan S P,Guo Z H,Lei P,et al. Increased biomass and reduced tissue cadmium accumulation in rice via indigenous Citrobacter sp. XT1-2-2 and its mechanisms[J]. Science of the Total Environment,2020,708:135224.
