柑橘黄龙病亚洲种RPA快速检测方法的建立
2021-12-08宋晓兵彭埃天黄峰汤亚飞崔一平凌金锋
宋晓兵 彭埃天 黄峰 汤亚飞 崔一平 凌金锋


摘要:黄龙病是世界柑橘产业的毁灭性病害,引起柑橘黄龙病的病原分为亚洲种、非洲种和美洲种共3个种,目前我国柑橘黄龙病均由亚洲种引起,建立一套快速检测技术对我国柑橘黄龙病的防控具有重要意义。本研究根据柑橘黄龙病亚洲种16S rDNA基因序列设计引物,建立了基于重组酶聚合酶等温扩增(RPA)的检测方法,并评价了该方法的灵敏度和检测准确性。结果表明,本研究所建立的柑橘黄龙病亚洲种RPA快速检测方法特异性强、灵敏度高、操作过程简便,检测灵敏度比常规PCR提高10倍,为基层农技人员开展柑橘黄龙病的快速检测提供了一种新方法。
关键词:柑橘;柑橘黄龙病亚洲种;RPA;快速检测
中图分类号: S436.661.1+9 文献标志码: A
文章编号:1002-1302(2021)22-0137-04
收稿日期:2021-02-20
基金项目:国家重点研发计划(编号:2018YFD0201500、2017YFD0202000);广东省现代农业产业技术体系创新团队建设项目(编号:2020KJ108);广东省现代农业产业共性关键技术研发创新团队建设项目(编号:2020KJ134)。
作者简介:宋晓兵(1980—),男,山东胶南人,博士,副研究员,主要从事柑橘病害防控技术研究。E-mail:xbsong@126.com。
通信作者:彭埃天,研究员,主要从事果树病害防控技术研究。E-mail:pengait@163.com。
柑橘黄龙病是一种影响全球的毁灭性病害,具有暴发性强、发展迅速、危害严重等特点,柑橘黄龙病正在全世界柑橘产区不断扩散蔓延,尤其在亚洲、非洲、美洲等地区泛滥成灾[1-3]。华南柑橘产区是柑橘黄龙病的重度流行区,柑橘黄龙病发生流行持续时间长、发病范围广、发病率高,是造成柑橘寿命缩短、产量降低、生产成本提高、经济损失惨重的重要因素,严重制约了柑橘产业的健康发展[4-5]。
目前,柑橘黄龙病普遍认为是由局限于韧皮部的候选韧皮部杆菌(Candidatus Liberibacter spp.)侵染引起[6],但至今未获得一致认可的纯培养[7-8]。根据病原的热敏性、传播媒介、保守序列特征等可以将其分为3个种,包括亚洲种、非洲种和美洲种[9-10]。基于柑橘黄龙病菌16S rDNA的同源性分析结果表明,侵染我国柑橘的黄龙病病菌均为亚洲种,通过序列测定与多重比对分析也表明在不同的地域病原菌没有较大的分子变异[11-12]。
带病苗木、带菌接穗和田间病株是柑橘黄龙病的初侵染源,目前开发一种高效、精准、低成本、操作简便的黄龙病病原检測技术,依然是基层科研单位、广大柑橘种植企业、柑橘育苗企业的迫切需求。重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术是一种等温核酸扩增技术,目前已应用于医学病原物的快速诊断、转基因作物检测、植物病害的病原检测等[13-16]。本研究拟研发一种用于检测柑橘黄龙病亚洲种的RPA引物及其检测方法,以期为柑橘种苗的黄龙病早期检测、田间疑似黄龙病树的检测确诊、普及基层科研单位的检测能力提供技术支持,对早期预警柑橘产区黄龙病的扩散蔓延具有重要意义。
1 材料与方法
1.1 试验材料
供试植物:感染柑橘黄龙病的阳性植株由广东省植物保护新技术重点实验室提供,健康样品采自笔者所在实验室网室内种植的柑橘(砂糖橘),待测样品采自田间疑似感染黄龙病的柑橘(广东怀集砂糖橘2株、德庆贡柑2株)。
试验试剂:AxyPrep Multisource Genomic DNA Miniprep Kit试剂盒购自北京全式金生物技术有限公司,TwistAmp Basic RPA试剂盒购自英国TwistDx公司,Premix TaqTM和DNA片段纯化试剂盒购自宝生物工程(大连)有限公司。
1.2 试验方法
1.2.1 引物设计
本研究中RPA引物设计原则见www.twistdx.co.uk网站TwistAmp反应试剂盒说明附录中的引物设计部分,通过在线软件https://primer3.ut.ee/设计引物。基于柑橘黄龙病亚洲种(GenBank序列登录号:AY192576.1)的16S rDNA序列设计引物HLBas-F/HLBas-R,基于柑橘黄龙病亚洲种(GenBank序列登录号:AY842429.1)的OMP序列设计引物OMP-F1/OMP-R1、OMP-F2/OMP-R2,引物由生工生物工程(上海)股份有限公司合成(表1)。
1.2.2 总DNA提取
取适量的供试植物新鲜叶片,采用植物DNA提取试剂盒抽提其总DNA。具体操作按照试剂盒厂商说明书的步骤进行。提取的植物总DNA沉淀溶解于50 μL TE缓冲液中,保存于 -20 ℃ 冰箱,备用。
1.2.3 RPA反应
以柑橘黄龙病阳性植株总DNA为模板,利用设计的RPA引物HLBas-F/HLBas-R、OMP-F1/OMP-R1、OMP-F2/OMP-R2进行扩增。按照TwistAmp Basic RPA试剂盒的说明配制RPA反应体系(50 μL):向0.2 mL的TwistAmp反应管中加入Rehy-dration Buffer 29.5 μL、10 μmol/L上下游引物各2 μL、模板DNA 2 μL、280 mmol/L醋酸镁2.5 μL、不含RNA酶的水12 μL。在40 ℃温度下,分别反应20、30、40、50、60 min;反应结束后,用纯化试剂盒对RPA产物进行纯化回收,取纯化后的RPA产物10 μL于1.0% 琼脂糖凝胶电泳中检测20 min,通过凝胶成像系统观察电泳结果,确定最佳反应时间。
1.2.4 常规PCR
以柑橘黄龙病阳性植株总DNA为模板,利用设计的引物HLBas-F/HLBas-R进行PCR扩增。PCR反应体系(50 μL):模板DNA 2 μL、rTaqTM Premix 25 μL、10 μmol/L上下游引物各2 μL、灭菌水19 μL。反应程序:预变性94 ℃ 4 min;变性94 ℃ 45 s,退火54 ℃ 45 s,延伸72 ℃ 45 s,35个循环;延伸72 ℃ 10 min。取PCR产物10 μL于1.0% 琼脂糖凝胶电泳中检测20 min,通过凝胶成像系统观察电泳结果。
1.2.5 RPA灵敏度
取柑橘黄龙病阳性样品的DNA模板进行梯度稀释,分别为100、10-1、10-2、10-3、10-4、10-5 6个稀释梯度,分别进行RPA检测和普通PCR检测,分析比较两者的检测灵敏度。RPA反应体系同“1.2.3”节,在40 ℃条件下温浴 40 min,从而完成RPA的灵敏度测定试验;常规PCR反应体系和反应程序同“1.2.4”节。
1.2.6 样品检测
从广东省各地采集疑似感染黄龙病的柑橘样品4份,分别提取总DNA,用本研究建立的RPA扩增技术进行检测,并用常规PCR扩增技术加以验证。
2 结果与分析
2.1 RPA引物筛选
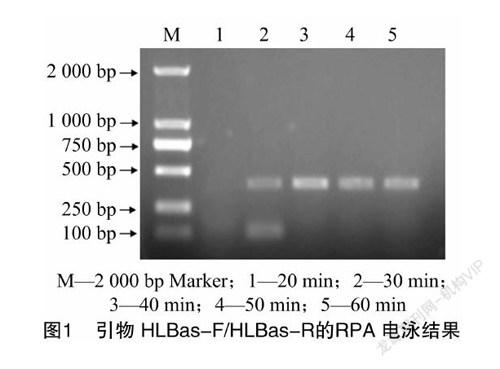
以柑橘黄龙病阳性植株总DNA为模板,40 ℃反应条件下,利用引物HLBas-F/HLBas-R进行RPA扩增。根据琼脂糖凝胶电泳结果(图1)可知,水浴20 min无特异性扩增,水浴30 min获得397 bp的目的条带,水浴40 min中获得的目的条带更亮、扩增条带单一,随着时间延长条带亮度无明显变化。根据琼脂糖凝胶电泳结果,确定反应40 min为最佳的反应时间。
以柑橘黄龙病阳性植株总DNA为模板,利用引物OMP-F1/OMP-R1、OMP-F2/OMP-R2分别进行RPA扩增。根据凝胶电泳结果(图2)可知,反应温度为40 ℃,分别水浴20~60 min,2对引物水浴20 min时都可以获得相应的目的条带,反应 30 min 获得的目的条带较亮,但随着时间的延长目的条带的亮度明显模糊不清。引物OMP-F1/OMP-R1 出现了非特异性扩增(图2左侧),引物OMP-F2/OMP-R2在40、50、60 min的扩增条带模糊不清(图2右侧)。鉴于3对RPA引物的电泳结果,最终选定引物HLBas-F/HLBas-R作为柑橘黄龙病RPA的检测引物。
2.2 RPA检测方法的灵敏度
以柑橘黄龙病阳性植物总DNA为模板进行稀释,浓度梯度为100、10-1、10-2、10-3、10-4、10-5 6个稀释度,分别进行RPA和普通PCR检测。琼脂糖凝胶电泳结果显示,RPA在模板稀释倍数为10-3时仍能扩增出目的条带(图3),普通PCR在模板稀释倍数为10-2时尚能扩增出目的条带(图4),因此,本研究所建立的RPA检测方法比普通PCR检测方法灵敏度提高10倍。
2.3 田间样品的检测
从广东省各地采集疑似柑橘黄龙病样品4份,用本研究建立的RPA检测方法进行检测,琼脂糖凝胶电泳结果(图5)显示,4份疑似病样品中3份检测均为阳性,同时采用普通PCR方法加以验证,其检测结果(图6)与RPA检测结果一致,两者的符合率为100%。试验结果表明,本研究建立的RPA检测方法能够实现柑橘黄龙病田间疑似样品的快速、准确检测与诊断。
3 讨论
RPA检测方法特异性强,对引物要求比常规PCR严格,RPA引物一般由30~38个核苷酸组成,而常规PCR引物长度通常为15~25个核苷酸[17-18]。与普通PCR检测方法相比,RPA扩增过程中不需要热循环,可在恒温水浴锅或金属浴中进行,检测耗时较短,经济适用,无需PCR仪、荧光定量PCR仪等昂贵仪器设备[19-20]。目前已建立的PCR、巢式PCR、荧光定量PCR等柑橘黄龙病病原检测技术[21-23],虽然不断提高了检测的灵敏度和准确率,但是检测时间依然比较费时,荧光定量PCR由于需要昂贵的试验设备和试剂耗材,检测费用偏高。
本研究建立的柑橘黄龙病亚洲种RPA检测方法简便、快速、灵敏性好,扩增反应快速,在40 ℃温度条件下最短30 min就可以完成扩增反应,检测灵敏度比普通PCR高10倍,是一种新型的柑橘黄龙病检测方法,笔者所在研究团队已经申请了国家发明专利(专利申请号202011285512.9)。尽管目前RPA检测方法的灵敏度与巢式PCR、荧光定量PCR相比仍存在较大差距[24],柑橘黄龙病亚洲种RPA检测方法的优势在于简单易学、省时省力,适用于田间疑似黄龙病树的快速诊断,为基层科研单位的黄龙病检测提供技术支持,未来应用前景廣泛。
参考文献:
[1]Bové J M. Huanglongbing:a destructive,newly-emerging,century-old disease of citrus[J]. Journal of Plant Pathology,2006,88(1):7-37.
[2]宋晓兵,彭埃天,陈 霞,等. 柑橘黄龙病病原培养及分子检测技术研究进展[J]. 广东农业科学,2013,40(23):65-69.
[3]许美容,戴泽翰,孔维文,等. 基于分子技术的柑橘黄龙病研究进展[J]. 果树学报,2015,32(2):322-334.
[4]柏自琴,周常勇. 柑橘黄龙病病原分化及发生规律研究进展[J]. 中国农学通报,2012,28(1):133-137.
[5]邓晓玲,郑永钦,郑 正,等. 柑橘黄龙病菌基因组学的研究进展[J]. 华南农业大学学报,2019,40(5):137-148.
[6]Hocquellet A,Toorawa P,Bové J M,et al. Detection and identification of the two Candidatus Liberobacter species associated with citrus huanglongbing by PCR amplification of ribosomal protein genes of the beta operon[J]. Molecular and Cellular Probes,1999,13(5):373-379.
[7]Davis M J,Mondal S N,Chen H,et al. Co-cultivation of ‘Candidatus Liberibacter asiaticus with Actinobacteria from Citrus with Huanglongbing[J]. Plant Disease,2008,92(11):1547-1550.
[8]Sechler A,Schuenzel E L,Cooke P,et al. Cultivation of ‘Candidatus Liberibacter asiaticus,‘Ca. L. africanus,and ‘Ca. L. americanus associated with Huanglongbing[J]. Phytopathology,2009,99(5):480-486.
[9]Garnier M,Jagoueix-Eveillard S,Cronje P R,et al. Genomic characterization of a liberibacter present in an ornamental rutaceous tree,Calodendrum capense,in the Western Cape Province of South Africa. Proposal of ‘Candidatus Liberibacter africanus subsp. capensis[J]. International Journal of Systematic and Evolutionary Microbiology,2000,50(6):2119-2125.
[10]Texeira D C,Ayres J,Kitajima E W,et al. First report of a Huanglongbing-like disease of citrus in Sao Paulo State,Brazil and association of a new liberibacter species,“Candidatus Liberibacter americanus”,with the disease[J]. Plant Disease,2005,89(1):107.
[11]丁 芳,洪 霓,钟 云,等. 中国柑橘黄龙病病原16SrDNA序列研究[J]. 园艺学报,2008,35(5):649-654.
[12]娄兵海. 柑橘黄龙病菌亚洲种全基因组测序及遗传多样性研究[D]. 重庆:西南大学,2018.
[13]哈登楚日亚,樊晓旭,赵永刚,等. 非洲猪瘟病毒实时荧光重组酶聚合酶扩增技术(RPA)检测方法的建立[J]. 中国畜牧兽医,2017,44(11):3270-3277.
[14]李 凯,金芜军,李 亮,等. 转基因玉米Bt11品系特异性荧光RPA检测[J]. 分子植物育种,2017,15(11):4741-4745.
[15]宋 建,薛 俊,孙海波,等. 一种基于RPA的番茄褪绿病毒检测方法[J]. 植物保护,2020,46(4):168-170,184.
[16]凌 莉,席 静,王 莹,等. 重组酶聚合酶扩增技术(RPA)检测创伤弧菌[J]. 江苏农业科学,2020,48(4):73-76.
[17]李华伟,林志坚,张 鸿,等. 甘薯薯瘟病菌RPA检测方法的建立及应用[J]. 福建农林大学学报(自然科学版),2020,49(5):583-588.
[18]龍 海,李一农,李芳荣.不同PCR引物对柑橘黄龙病菌的特异性检测[J]. 植物检疫,2012,26(4):38-41.
[19]Chen L,Jiao Z Y,Liu D M,et al. One-step reverse transcription loop-mediated isothermal amplification for the detection of maize chlorotic mottle virus in maize[J]. Journal of Virological Methods,2017,240:49-53.
[20]冯黎霞,魏 霜,余 辛,等. 重组酶聚合酶扩增技术(RPA)快速检测玉米褪绿斑驳病毒[J]. 植物保护学报,2020,47(1):217-218.
[21]Jagoueix S,Bové J M,Garnier M. PCR detection of the two ‘Candidatus Liberobacter species associated with greening disease of citrus[J]. Molecular and Cellular Probes,1996,10(1):43-50.
[22]李韬,柯 冲. 应用Nested PCR技术检测柑橘木虱及其寄主九里香的柑桔黄龙病带菌率[J]. 植物保护学报,2002,29(1):31-35.
[23]Li W,Hartung J S,Levy L. Quantitative real-time PCR for detection and identification of Candidatus Liberibacter species associated with citrus huanglongbing[J]. Journal of Microbiological Methods,2006,66(1):104-115.
[24]程保平,彭埃天,宋晓兵,等. 三种 PCR 方法检测柑橘黄龙病菌的效果比较[J]. 植物保护,2014,40(5):106-110.
