小麦扬辐麦4号辐射诱变突变体筛选和突变体库构建
2021-12-08刘建凤张容陈士强王建华范德佳何震天
刘建凤 张容 陈士强 王建华 范德佳 何震天

摘要:人工诱变是选育小麦新品种、创制新种质和挖掘新基因的有力工具之一。以丰产、稳产、广适的小麦品种扬辐麦4号为材料,通过60Co-γ辐射诱变,对获得的2 869个M2代穗系进行农艺性状和生物学性状表型筛选,结果获得89个幼苗、叶、茎、穗、生育期等生物学和主要农艺性状变异的突变体,突变频率为3.102%。经M3代验证,共发现22个表型稳定的突变体,其中叶部突变体4个、茎部突变体5个、穗部突变体11个、生育期突变体2个。对M2代中茎部突变体和穗部突变体衍生的M3代株系,收获后进行考种,数据分析表明,其中8个突变体在穗长、穗粒数、小穗数、不孕小穗数、硬度、千粒质量、粒长、粒宽等性状上有一个或多个优于对照扬辐麦4号。这些优良突变体可作为新的种质资源为培育小麦新品种提供基础,此外,构建的突变体库将有助于开展小麦功能基因组学的研究。
关键词:小麦;辐射诱变;60Co-γ射线;突变体
中图分类号:S512.103.52 文献标志码: A
文章编号:1002-1302(2021)22-0088-06
收稿日期:2021-03-01
基金项目:江苏省农委农业重大新品种创制项目(编号:PZCZ201707);江苏里下河地区农业科学研究所科研项目[编号:SJ(17)303];国家重点研发计划(编号:2016YFDO102101)。
作者简介:刘建凤(1968—),女,江苏兴化人,副研究员,主要从事稻麦辐射诱变育种和植保研发的研究。E-mail:yzljfeng@163.com。
通信作者:何震天,研究员,主要从事稻麦辐射诱变育种研究。E-mail:yzhzt@ 126.com。
辐射诱变育种是人工利用χ射线、γ射线、电子束、紫外线、激光、离子注入、混合离子场等物理诱变因素,诱发植物遗传基因突变,在短时间内获得多种多样的、有利用价值的突变体,育成的新品种供生产直接利用,或者在此基础上培育出新种质资源的育种技术[1]。小麦是世界上生产量最高的粮食作物之一,世界上超过1/3的人口以小麦为主要粮食[2]。我国小麦种植面积和总产量仅次于玉米和水稻,居第3位[3]。我国自辐射诱变技术应用于小麦育种工作以来,不仅创造了丰富的种质资源,还育成了许多小麦品种,如川辐2号、山农辐63、龙辐麦3号、龙辐麦16号、鲁麦20、郑品麦8号、豫麦63、小偃 6号、众麦2号、郑六辐、宁麦3号等[4-7],为我国小麦生產作出了重大贡献。60Co-γ射线诱变具有辐照条件易于控制、射线波长短、能量高、穿透性好、突变率高等优点,是目前辐射诱变育种中最常用的辐射源[8-9]。通过60Co-γ射线辐射诱变小麦种子,可获得很多有益变异,如株高突变、熟期提前、育性突变、抗病性增强、品质改良、产量增加等优良性状或具有特异性状的突变种质资源[10]。
江苏里下河地区农业科学研究所自20世纪50年代末期开展小麦辐射诱变育种工作,先后育成了扬麦158及13个扬辐麦系列小麦品种,其中扬麦158在1993—2003年累计种植面积1 000万hm2以上,获国家科技进步一等奖[11];扬辐麦4号2008年通过江苏省审定,2010年获农作物品种权保护[12],该品种自审定以来,种植面积一直处在江苏淮南麦区小麦品种前列,2014年被评为“江苏好品种”,年推广面积20万hm2以上,为农业生产创造了较好的社会经济效益。
普通小麦是异源六倍体(AABBDD,2n=42),与水稻相比基因组巨大(16 Gb)[13],可以承受庞大的突变密度。虽然已有一些小麦突变体库构建的研究报告,但是与庞大的小麦基因组相比,数量有限,还需要构建新的突变体库来补充,尤其是江苏省淮南麦区尚未创建适合当地种植的小麦突变体库。因此,本研究以高产、优质、多抗小麦品种扬辐麦4号为基础,构建60Co-γ辐射诱变突变体库,旨在为小麦基因功能研究和新品种选育提供基础材料。
1 材料与方法
1.1 试验材料
扬辐麦4号是通过辐射诱变宁麦8号/宁麦9号杂交种选育的一个小麦优良品种,该品种为春性,幼苗直立,叶色深绿。株型紧凑,分蘖性强,成穗较高。长芒,白壳,长方型穗,籽粒红皮,半角质,属于中筋小麦。具有高产、稳产、高抗小麦黄花叶病、中抗赤霉病、适应性广等特点[12]。
1.2 试验方法
1.2.1 辐射处理
2016年10月中旬,在扬州辐照中心采用60Co-γ射线辐照处理小麦扬辐麦4号干种子1 kg,辐射总剂量为300 Gy。
1.2.2 试验地点
2016年10月30日,处理后的种子密播于江苏里下河地区农业科学研究所万福基地试验田,试验地土质为沙壤土,前茬水稻,肥力中等。
1.2.3 突变材料的构建
2016—2017年对M1代做好田间管理,成熟后按主茎单穗收获4 000个,单穗单脱;于10月种成穗行,M2代群体共2 869个穗系,根据不同时期观察记载的突变体形态性状进行筛选,按单株收获。鉴于M2代同一个穗系的不同单株间仍可能存在变异,所以收获M2代时,没有出现明显分离的穗系,仅收获1个单株出现明显分离的穗系,收获一个最具代表性的单株,同时根据表型剔除重复的单株。2018年秋播时将M2代表型变异材料单株种植成M3代株系,每株种2行,2019年对表型突变体的稳定性进行鉴定。各世代每隔50个试验材料设置1个对照,对照处理为未辐照的扬辐麦4号。辐照材料各世代均按行长1.50 m、行距0.25 m、株距0.05 m播种,常规田间管理。
1.2.4 表型性状调查
对60Co-γ射线诱变获得的M2、M3代材料,全生育期每隔3~5 d田间调查1次,观察记录幼苗、叶、茎、穗、生育期、抗病性等表型变化。抽穗期与株高调查方法:在调查抽穗期时,当每个株系中有50%以上麦穗顶部小穗(不算芒)露出叶鞘,或在叶鞘中上部裂开见小穗时的日期确定为该株行的抽穗日期,早熟以早抽穗4 d以上为准,晚熟以晚抽穗4 d以上为准;株高为从基部至主茎顶部生长点之间的距离,矮秆以株高低于对照平均高度15 cm以上为准,高秆以株高高于对照平均高度15 cm以上为准。对M2代获得的茎部突变体和穗部突变体衍生的M3代株系及对照收获时每个株系取5株进行考种,分别测定株高、穗长、穗粒数、小穗数、不孕小穗数、硬度、千粒质量、粒长及粒宽等性状。
1.2.5 籽粒性状测定
M3代种子的硬度利用小麦硬度测定仪(JYDX100×40)进行测定,千粒质量、粒长、粒宽采用浙江托普云农科技股份公司智能考种分析系统(TPKZ-3)进行考种。
1.2.6 数据处理
对M3代考种的数据采用Excel作次数分布图和相关分析。
2 结果与分析
2.1 突变体类型和突变频率
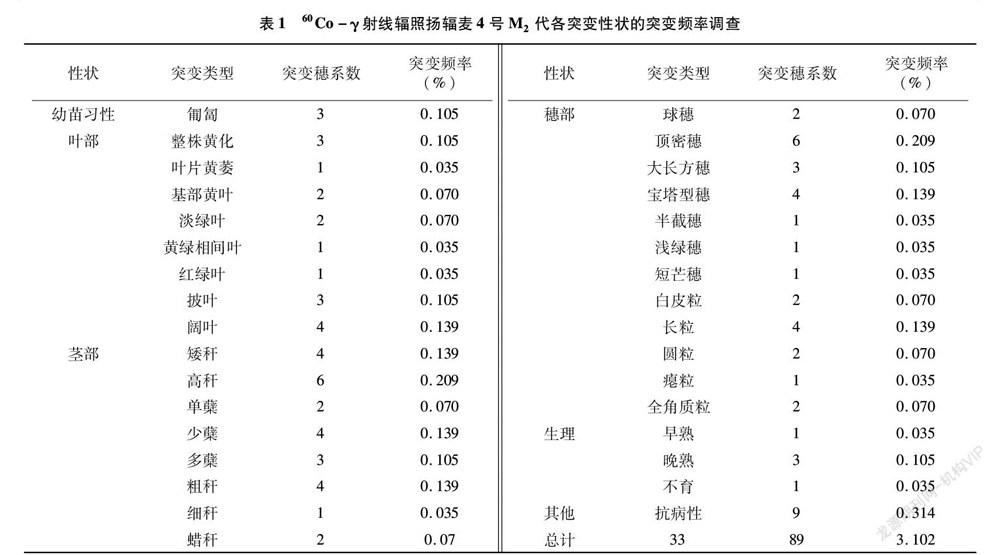
在2 869个M2代穗系中共筛选出89个表型突变穗系,突变频率为3.102%。其中,幼苗习性突变体3个,突变频率0.105%;叶部性状突变体17个,突变频率为0.593%;茎部性状突变体26个,突变频率为0.906%;穗部性状突变体29个,突变频率为1.011%;生理性状突变体5个,突变频率为0.174%,抗病性状突变体9个,突变频率为0.314%(表1)。
2.1.1 幼苗习性突变体
扬辐麦4号在越冬返青期幼苗习性为直立型。在调查的2 869个穗系中有3个穗系为匍匐型,突变频率为0.105%。经M3代验证,发现后代分离为匍匐、半匍匐、半直立3种类型。
2.1.2 叶部性状突变体
在M2代中共观察到17个穗系的叶片发生了突变,突变频率为0.593%。
2.1.2.1 叶色突变 共有6种类型:一是黄化叶突变,共3个穗系,整个生育期叶片都呈黄色,但后期的长势不及对照;二是叶片黄萎,1个穗系,三叶期前叶片呈淡黄色,由于无法进行正常的光合作用,随着植株的生长逐渐枯萎;三是基部黄叶,2个穗系,这类植株基部的叶片一直是黄色,随着新叶的出现与伸展,基部叶片仍呈黄色,后期植株的长势长相与对照扬辐麦4号没有明显差别;四是叶片淡绿突变,2个穗系,植株的叶片与对照扬辐麦4号相比呈淡绿色且叶片较薄;五是叶片黄绿相间,1个穗系,整株叶片有黄绿相间的条纹;六是红绿叶突变,1个穗系,叶片颜色略带暗红色,叶尖最明显。这6种类型的叶色突变经M3代验证,第1、3、4、5类后代无分离,其他2种类型仍有分离。
2.1.2.2 叶形突变 叶片形态突变体共有2种:一是披叶型突变,3个穗系,整株叶片都下披;二是阔叶型突变,4个穗系,表现为叶片极阔。这2个类型经M3代验证,突变性状有部分分离。
2.1.3 茎秆性状突变
在M2代诱变群体中共发现了26个茎秆性状相关的突变,突变频率为0.906%。
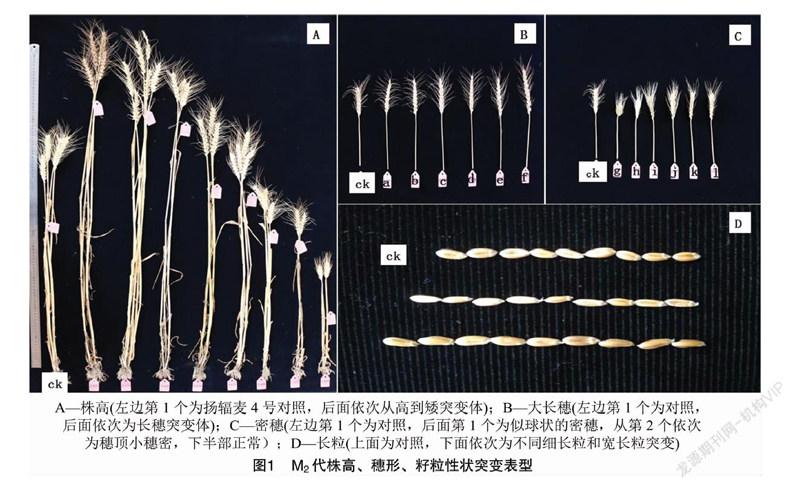
2.1.3.1 株高突变 共发现了10个穗系突变体,突变频率为0.349%。矮秆突变体4个穗系,最矮株 54 cm;高秆突变体6个穗系,最高达120 cm,对照材料扬辐麦4号在突变体库中平均高84.3 cm(图1-A)。经M3代验证,高秆和矮秆后代性状稳定,对矮秆突变体正在做进一步的等位基因检测验证。
2.1.3.2 分蘖突变 分蘖是禾本科的一个重要生物学特征,分蘖数与小麦的产量性状密切相关,共发现9个突变穗系,突变频率为0.314%。分蘖突变主要有3种:单蘖、少蘖、多蘖。其中单蘖有2个穗系;少蘖就是仅有2~3个分蘖,4个穗系;多蘖有3个穗系。其中多蘖有2种情况:一种是分蘖期分蘖多,多达30个以上;另一种是幼苗期分蘖少,拔节期小分蘖多,多达27个分蘖以上,但是小分蘖的结实差。经M3代验证,单蘖、少蘖和多蘖仍有分离,需进一步筛选。
2.1.3.3 茎秆直径突变 共发现5个突变体,突变频率为0.174%,其中较对照扬辐麦4号细的穗系有1个,较粗的有4个。经M3代验证,突变体的性状稳定。
2.1.3.4 蜡质茎秆 发现有蜡质茎秆的突变体2个,突变频率0.07%。经M3代验证,蜡质茎秆性状稳定遗传(图2-G)。
2.1.4 穗部性状突变
在M2代诱变群体中共观察到29个穗系为小麦穗部突变,突变频率为1.011%,其中主要有穗形突变、穗色突变、穗芒突变、籽粒性状突变。
2.1.4.1 穗形突变 60Co-γ射线辐照处理后穗形变异较明显,有16个穗系的穗形发生了突变,突变频率0.558%,变异类型有5种:一是密穗,有4个穗系,穗子短小,穗长在3.2~4.6 cm,穗粒数平均24~34个,但是不孕小穗数比对照扬辐麦4号多,平均有3~6个,这种穗形紧密,几乎呈球形(图1-C-g),经M3代验证,后代的性状稳定(图2-A);二是穗子顶部小穗紧密,下半部正常,共观察到5个穗系(图1-C-h~图1-C-l),经M3代验证,后代的性状基本稳定(图2-B);三是大長方穗,穗长高达14.1 cm,比对照扬辐麦4号的平均穗长10.9 cm多了3.2 cm,穗粒数最高达78粒,比对照扬辐麦4号的穗粒数45~50 粒多20余粒,共观察到2个穗系(图1-B-e~图1-B-f),经M3代验证,后代的性状部分稳定(图2-C);四是半截穗,穗子中上部小穗不发育,仅1个穗系,经M3代验证,性状有部分分离(图2-D);五是宝塔型穗,穗子下大上小呈宝塔状,共观察到4个穗系(图1-B-a至图1-B-d),经M3代验证,性状稳定(图2-E)。
2.1.4.2 穗色突变 浅绿穗,该突变与对照扬辐麦4号比较,穗子呈浅绿色,仅1个穗系,经M3代验证,后代性状稳定。
2.1.4.3 穗芒突变 对照扬辐麦4号为长芒品种,在突变群体中发现1个穗系麦芒较短,突变频率为0.035%,经M3代验证,性状稳定(图2-F)。
2.1.4.4 籽粒突变 对照扬辐麦4号的籽粒是粉红色,半角质,千粒质量41 g左右。突变群体中获得白皮籽粒2个穗系;籽粒比对照扬辐麦4号变得更长的有4个穗系(图1-D),千粒质量在50 g以上,最高58.2 g,高于对照17 g左右;籽粒与对照比变短变圆的有2个穗系,这个突变体多半生于密穗突变;籽粒全瘪的1个穗系;硬度值在70以上的有2个穗系,高于对照(硬度52.8)。经M3代验证,白皮粒、圆粒、长粒、角质籽粒的变异基本稳定,瘪粒仍有分离。本研究获得了长粒和角质籽粒的突变体,但是结果的可靠性还需多年多点进一步验证。
2.1.5 生理性状突变
在M2代中共观察到5个穗系的生理性状发生了突变,突变频率为0.174%。
2.1.5.1 生育期突变 突变群体中共发现4个早熟突变和晚熟突变,突变频率0.139%,其中早熟突变有1个穗系,其余3个穗系都是晚熟突变。早熟突变在乳熟后期籽粒迅速脱水,叶片失绿,比对照早熟2 d左右;晚熟突变类型在乳熟期开始时叶片仍呈现正常绿色,成熟期拉得较长,最晚延后12 d左右,种子成熟较慢。经M3代验证,生育期突变稳定,获得了早熟和晚熟突变体。
2.1.5.2 不育突变 在M2代观察到不育变异有1个穗系,主要表现为花药弱小干瘪无花粉,穗子轻,不结实。
2.1.6 抗病性状突变
在M2代诱变群体中共观察到9个穗系为抗病性突变,突变频率为0.314%。因试验田靠近赤霉病鉴定圃,且锈病近几年发病较严重,采用自然发病法来初步筛选抗赤霉病和抗锈病的突变体。对照扬辐麦4号是中抗赤霉病、中感锈病品种,经过M2代的初选和M3代的验证,有2个穗系由中感锈病诱变为中抗;3个穗系由中抗赤霉病诱变为高抗赤霉病、2个穗系为中感赤霉病;有2个穗系锈病和赤霉病同时都发生了变异。对抗病性突变结果的可靠性,将做进一步的鉴定验证。
2.2 突变体主要性状的考种分析
对M2代中26个茎部突变体和29个穗部突变体衍生的131个M3代株系及对照扬辐麦4号各收5株进行考种,分别测定株高、穗长、穗粒数、小穗数、不孕小穗数、硬度、千粒质量以及籽粒的长、宽等指标。结果(图3)表明,与对照扬辐麦4号相比,穗部突变体株系的株高、穗长、穗粒数、小穗数、不孕小穗数、硬度、千粒质量、粒长、粒宽等9个农艺性状基本服从正态分布,株高高于对照均值(84.3 cm)的株行占69.5%,低于对照的株行占29.8%;穗长高于对照均值(10.7 cm)的株行占35.1%,低于对照的株行占61.1%;穗粒数高于对照均值(58.1个)的株行占35.9%,低于对照的株行占61.1%;小穗数高于对照均值(20.8个)的株行占26.0%,低于对照的株行占72.5%;不孕小穗数高于对照均值(1.1个)的株行占58.8%,低于对照的株行占38.2%;硬度高于对照均值(52.8)的株行占40.5%,低于对照的株行占58.8%;千粒质量高于对照均值(41.6 g)的株行占46.6%,低于对照的株行占53.4%;籽粒的长高于对照均值(5.73 mm)的株行占64.9%,低于对照的株行占32.8%;籽粒的宽高于对照均值(3.01 mm)的株行占35.1%,低于对照的株行占63.4%。
通过对M3代突变体株系的分离进行鉴定,获得了表型性状稳定株系22个,其中叶片突变体4个,茎秆突变体5个,穗部突变体11个,生育期突变体2个,其中8个穗部性状优良、稳定的突变体,穗长、穗粒数、小穗数、硬度、千粒质量、粒长及粒宽与对照扬辐麦4号相比都有明显的区别,且有的一个或多个性状优于对照,这些突变体可以作为新的种质资源。
3 讨论与结论
突变体是承载和表达遗传变异的载体,是研究植物功能基因组学的基础材料[8],分析鉴定小麦基因功能目前最直接最有效的途径是构建小麦饱和的突变体库,通过突变体分析鉴定基因功能[14]。目前,利用辐射诱变技术已经在拟南芥[15]、花生[16]、水稻[17]、大豆[18]等植物中构建了突变体库,并在功能基因组学研究中发挥了重要作用。前人在普通小麦研究中獲得了多个典型的突变体,Mago等利用60Co-γ射线处理小麦,获得了小麦感秆锈病突变体[19];郎淑平等通过60Co-γ辐射小麦品种扬麦158,获得了高产、低植酸的小麦突变体[20];王停停等利用60Co-γ射线辐射小麦品种郑麦9023,获得强筋小麦突变体[21];张从宇等利用60Co-γ射线辐照小麦品种皖麦50,获得高分子量谷蛋白亚基(HMW-GS)突变体[22];孙光祖等利用60Co-γ射线照射小麦品种新克旱9,获得抗赤霉病突变体[23]。因此,60Co-γ射线是构建小麦突变体的重要手段。
本研究通过60Co-γ射线辐照诱变构建了扬辐麦4号突变体库。从该库M2代中筛选到89个表型变异明显的突变体,突变频率为3.102%,这些突变体包括茎秆、穗部、生育期等在内的6个类型,不同类型出现的频率为0.105%~1.011%,通过M3代的鉴定筛选,获得了22个具有明显遗传研究和育种价值的突变体株系。M2代主要农艺性状变异分析表明,60Co-γ射线诱变扬辐麦4号能引起农艺性状的广泛变异,有利于创造、筛选出特殊类型种质资源。M3代考种分析表明,株高、穗长、穗粒数、小穗数、不孕小穗数、硬度、千粒质量、粒长、粒宽等指标的变异率较大,易于品种和品质的改良。农艺性状间变异的程度存在差异,变异频率有大也有小,这说明小麦各农艺性状对60Co-γ射线的敏感度不同。由此可见,在短时间内可以根据需要筛选多种有利用价值的突变体,以供直接生产利用或者以此为基础培育出新的种质资源[1]。
对M2代和M3代突变体表型鉴定表明,扬辐麦4号突变体库突变频率高,突变类型丰富,易获得一些具有优良农艺性状的突变体,如大长穗、大粒、矮秆、抗病、早熟、硬度高等突变体,这将成为小麦高产、抗病、优质等要素研究很好的切入点。这些优良性状源于人工诱变,控制这些优良性状的基因与来自自然变异的基因通常是有差异的,因此是一种新的优良基因源,可作为优异的种质资源用于小麦育种。随着小麦分子育种研究的深入,控制突变体库中的株高、生育期、穗形、硬度等突变体进行相关基因的定位与挖掘,为优良基因在小麦育种中的应用提供理论和实践基础。
参考文献:
[1]杨兆民,张 璐. 辐射诱变技术在农业育种中的应用与探析[J]. 基因组学与应用生物学,2011,30(1):87-91.
[2]王琳清,陈秀兰,柳学余.小麦突变育种学[M]. 北京:中国农业科学技术出版社,2004.
[3]王金平.小麦关键性状遗传解析及功能标记开发[D]. 泰安:山东农业大学,2017.
[4]陈秀兰,柳学余,何震天,等. 江苏省农作物辐射诱变育种的成就与展望[J]. 核农学报,2004,18(2):121-124.
[5]范家霖,张建伟,杨保安,等. 河南省小麦诱变育种进展与分析[J]. 麦类作物学报,2013,33(1):195-199.
[6]李新华,邱登林,孙桂芝,等. 山东省小麦诱变育种[J]. 核农学报,2006,20(1):51-53,18.
[7]陳晓杰,杨保安,范家霖,等. 杂交与辐射诱变相结合选育高产优质小麦新品种的研究[J]. 中国种业,2018(12):64-68.
[8]赵林姝,刘录祥. 农作物辐射诱变育种研究进展[J]. 激光生物学报,2017,26(6):481-489.
[9]赵丽丽,孙小富,黄莉娟,等. 辐射诱变突变体鉴定技术[J]. 贵州大学学报(自然科学版),2020,37(4):26-29.
[10]于 沐,周秋峰.小麦诱发突变技术育种研究进展[J]. 生物技术通报,2017,33(3):45-51.
[11]王 龙,任立凯,李 强,等. 江苏省小麦育种及诱变育种技术的研究进展与展望[J]. 江苏农业科学,2014,42(6):60-62,68.
[12]何震天,张 容,王建华,等. 小麦扬辐麦4号高产表现及配套栽培技术[J]. 江苏农业科学,2013,41(4):69-70.
[13]赵天祥,孔秀英,周荣华,等. EMS诱变六倍体小麦偃展4110的形态突变体鉴定与分析[J]. 中国农业科学,2009,42(3):755-764.
[14]郭建秋,雷全奎,杨小兰,等. 植物突变体库的构建及突变体检测研究进展[J]. 河南农业科学,2010(6):150-155.
[15]郝建平,郭美丽,宋莲芬.拟南芥抗盐单基因突变体的诱导与筛选[J]. 山西大学学报(自然科学版),2003,26(4):349-351.
[16]彭振英,王兴军,田海莹,等. 花生60 Co-γ辐射诱变和突变体库的构建[J]. 核农学报,2016,30(3):422-429.
[17]龙 湍,安保光,李新鹏,等. 籼稻93-11辐射诱变突变体库的创建及其筛选[J]. 中国水稻科学,2016,30(1):44-52.
[18]韩锁义,张恒友,杨玛丽,等. 大豆“南农86-4”突变体筛选及突变体库的构建[J]. 作物学报,2007,33(12):2059-2062.
[19]Mago R,Spielmeyer W,Lawrence G J,et al. Re-sistance genes for rye stem rust (SrR) and barley powderymidew(Mla ) are located in syntenic regions on short arm of chromosome [J]. Genome,2004,47(1):112.
[20]郎淑平,马燕欣. 60Co-γ辐照高产低植酸小麦新品系的鉴定筛选[J]. 大麦与谷类科学,2016,33(2):20-24.
[21]王停停,王 敏,张从宇.60Co-γ射线诱变小麦M3代品质性状的遗传变异分析[J]. 麦类作物学报,2019,39(6):675-681.
[22]张从宇,王 敏,李文阳,等. 60Co-γ诱变皖麦50HMW-GS变异的筛选及其M3代品质分析[J]. 激光生物学报,2014,23(2):127-133.
[23]孙光祖,李忠杰,李希臣,等. 小麦抗赤霉病突变体的选育及RAPD分子验证[J]. 核农学报,1999,13(4):202-205.
