靓竹以芽繁芽及植株再生研究
2021-12-08王星徐薪璐卞丽丽姚文静林树燕
王星 徐薪璐 卞丽丽 姚文静 林树燕

摘要:对彩叶观赏竹种靓竹进行组培快繁研究,以不同季节采集的靓竹鞭芽为试验材料,对其进行最佳灭菌时间筛选,寻求初代培养、继代增殖培养、生根诱导培养过程中最佳植物生长调节物质组合,确定移栽驯化最佳基质,从而建立高效组培快繁体系。结果表明,靓竹最佳采样季节为8—9月,最佳灭菌处理为75%乙醇30 s→无菌水冲洗3~5次→2%次氯酸钠溶液处理15 min→无菌水冲洗3~5次→滤纸吸干水分接种,灭菌率达67.21%;靓竹丛芽诱导及增殖过程中,利用6-BA、KT、NAA、TDZ不同组合进行正交试验,筛选出最佳诱导培养基为5 mg/L 6-BA+0.5 mg/L KT,诱导率达87.57%,最佳增殖培养基为5 mg/L 6-BA+0.5 mg/L KT+0.5 mg/L TDZ,增殖系数达5.05;靓竹丛芽增殖过程中可同时生根,最佳生根培养基与增殖培养基相同,生根组培苗开盖炼苗7 d后,移栽至基质为壤土 ∶草炭土=2 ∶1中,成活率可达95%,幼苗长势良好。
关键词:靓竹;鞭芽;组织培养;炼苗移栽
中图分类号:S795.904 文献标志码: A
文章编号:1002-1302(2021)22-0064-07
收稿日期:2021-06-03
基金项目:江苏省林业科技创新与推广项目(编号:LYKJ[2019]29);江苏高校优势学科建设工程项目(编号:PAPD)。
作者简介:王 星(1995—),女,江西九江人,硕士,主要研究方向为竹类植物种质资源筛选。E-mail:1519814680@qq.com。
通信作者:林树燕,博士,教授,主要从事观赏竹种质筛选和快速繁育研究。E-mail:lrx@njfu.com.cn。
靓竹(Sasaella glabra f. albostriata),中文学名为白纹椎谷笹,禾本科,东笆竹属,混生型竹种。竹株矮小,株间密集,分蘖力强,叶片绿色具黄白色纵条纹,色彩优美,经常作为观赏竹种被人们所认识。由于竹类植物开花间隔期长,很少开花结实,且竹类植物花粉萌发率普遍较低,因此种子获取十分困难。目前竹子繁殖主要以移竹、竹蔸、埋鞭、埋秆、埋节等传统方法为主,这些方法具有消耗母竹多、种苗运输不便、劳动强度大、繁殖系数低等缺点,尤其对资源稀少的珍贵观赏竹种来说,传统的繁殖方法受到了较大限制,难以快速规模化发展资源。针对这些问题,随着对竹类研究的深化,人们开始研究竹类植物新的繁殖方法,其中最直观有效的就是竹类组织培养获得再生植株。
当前对于靓竹的研究主要集中在其抗旱性[1]、抗性生理研究[2]、花叶变异机制的研究[3]、叶片叶绿素荧光特性的研究[4]、高生长规律[5]、光合特性研究[6、7]、叶片结构[8、9]、引种适应性[10]等方面,而对于靓竹组织培养的研究还未见报道。以芽繁芽途径没有通过脱分化与再分化过程,一般能保持品种特性稳定不变异,是植物组培快繁最常用的方法。目前,竹子组织培养多采用以芽繁芽途径,且大多数均采用带芽茎段为外植体,而通过以鞭芽为外植体繁芽的报道较少,仅见于Prutpongse等的少数研究[11]中,本研究初次使用靓竹鞭芽为外植体,建立靓竹组培快繁体系,填补了靓竹以芽繁芽的空白,可为其他观赏竹的快繁研究提供参考。
1 材料与方法
1.1 试验材料
试验材料为南京林业大学白马苗圃繁育基地生长旺盛、茎秆较多、花叶繁茂的盆栽靓竹苗,采样时间为2019年1—12月。
1.2 试验方法
1.2.1 材料处理
将靓竹从容器中取出,去除土壤,洗净地下茎部分,将带有萌动或休眠芽的长鞭剪成每段1~2 cm的带芽鞭段,放在培养瓶中,洗洁精浸泡5 min后流水下冲洗2~3 h。
1.2.2 外植体消毒
在冲洗好的鞭芽中添加5~10滴吐温80,不断搅拌,时间持续5~8 min,流水下冲洗干净,转至超净工作台上备用。利用消毒试剂75%乙醇不同处理(30、45、60 s)及2%次氯酸钠溶液不同处理(12、15、17 min)进行组合,对靓竹鞭芽进行消毒灭菌,每次消毒结束后用无菌水冲洗外植体3~5次,无菌濾纸吸干水分。将消毒后的靓竹鞭芽接种在培养基MS+3 mg/L 6-BA中,每个处理接种15瓶,每瓶2个外植体,重复3次,20 d后统计污染率,30 d后统计死亡率及无菌成活率,确定最佳消毒方法。污染率=(污染外植体数/接种外植体总数)×100%;死亡率=(死亡外植体数/接种外植体总数)×100%;成活率=(成活外植体数/接种外植体总数)×100%
1.2.3 初代诱导培养
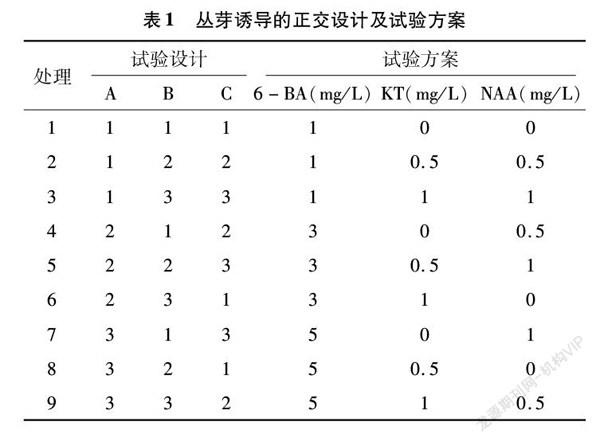
经最佳消毒方式获得靓竹无菌鞭芽后,将其接种在不同植物生长调节物质组合的培养基中,进行丛芽的诱导。本试验选择3种不同浓度的6-BA、KT、NAA组合进行丛芽诱导,试验按照正交设计L9(34)(表1),每个处理接种15瓶,每瓶2个外植体,重复3次,35 d后统计丛芽个数,计算诱导率。诱导率=(无菌外植体启动数/接种外植体总数)×100%。
1.2.4 继代增殖与生根培养
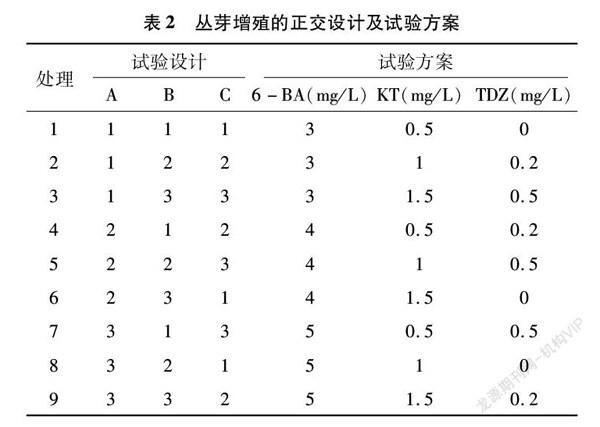
将诱导出的芽接种至继代培养基中进行增殖培养。本试验选择不同浓度的6-BA、KT、TDZ组合进行丛芽增殖,试验按照正交设计L9(34)(表2),每种浓度组合15瓶,每瓶接种2个外植体,重复3次,观察周期为45 d,统计丛芽增殖系数。增殖过程中丛生芽出现生根现象,记录各不同处理下丛生芽不定根的生长情况,统计生根率。增殖系数=继代后芽苗总数/继代前的芽苗总数,生根率=(生根的外植体数/接种的外植体数)×100%。
1.2.5 移栽驯化
生根培养一段时间后,选取生长健康、根系发育较为良好的的靓竹组培苗, 在培养室的散光下进行开口炼苗,然后移栽至不同基质中,移栽前对基质进行消毒处理,选用0.1%高锰酸钾对基质进行喷洒消毒灭菌。不同基质配方为100%壤土、壤土 ∶草炭土=1 ∶1、壤土 ∶草炭土=2 ∶1、壤土 ∶蛭石=1 ∶1、壤土 ∶蛭石 ∶草炭土=1 ∶1 ∶1,移栽后叶面经常浇水,保持空气湿度在70%~90%之间,温度为22~28 ℃之间,观察生长情况,统计成活率,比较不同基质对移栽成活率的影响。
1.3 培养条件
试验过程中培养基pH值的范围控制在5.75~5.80之间,蔗糖浓度30 g/L,琼脂含量为2.25 g/L。培养温度(25±1) ℃,光照度1 200~1 500 lx,光照时长14 h/d。
1.4 数据分析
试验结果选择Microsoft Excel 2010和SPSS 22.0软件进行数据处理和差异显著性检验,小写字母表示在0.05水平差异显著。
2 结果与分析
2.1 最佳消毒时间的选择
靓竹鞭芽消毒灭菌结果见表3,当乙醇灭菌时间相同时,次氯酸钠不同处理时间对鞭芽的灭菌效果不同:在乙醇处理时间为30 s时,不同次氯酸钠处理时间下鞭芽污染率及成活率出现显著性差异,处理时间为15 min时,鞭芽的污染率最低,仅为12.15%,成活率最高,为67.21%,17 min时死亡率最高,为36.27%;当乙醇处理时间为45 s时,不同次氯酸钠处理时间下鞭芽成活率差异不显著,污染率和死亡率出现显著差异,污染率在次氯酸钠处理时间为12 min时,达最高,为21.77%,死亡率在 17 min 时达到最高,为36.47%;当乙醇处理 60 s 时,不同次氯酸钠处理时间下鞭芽的污染率及死亡率均差异显著,在消毒12 min时,成活率最高,为54.16%,消毒17 min时,污染率最低,仅为9.63%,但此时外植体的死亡率达最高,为47.77%。综上所述,靓竹鞭芽消毒过程中,乙醇和次氯酸钠处理时间不宜过长,最佳消毒处理组合为75%乙醇30 s+2%次氯酸钠15 min。
2.2 不同季节采样对靓竹无菌体系建立的影响
不同月份采集的靓竹鞭芽,外植体灭菌效果不同。从表4可以看出,2—7月外植体污染率较高,均在50%及以上,成活率较低,最低为23.41%;8—10月采集鞭芽,外植体死亡率较低,均在8%以下,成活率较其他月份高,最高成活率可达61.54%;1月与11—12月采集的外植体成活率无明显差异,但该时期外植体死亡率、污染率较高,且该时期外植体萌动较慢,接种1周后开始出现萌动。观察8—10月外植体成活率可知,8—9月成活率显著高于10月,培养过程中发现,8—9月外植体生长状态较好,萌芽生长速度快,10月采集的外植体在转瓶过程中易出现2次污染的现象,因此靓竹外植体最佳取样季节为8—9月。
2.3 不同植物生长调节物质对靓竹鞭芽诱导的影响
利用6-BA、KT、NAA 3种生长调节物质不同水平组合进行正交试验(表5),3种生长调节物质对鞭芽诱导的影响效果为6-BA>KT>NAA,6-BA、KT、NAA均对鞭芽诱导率产生显著影响。对3种生长调节物质不同水平对靓竹鞭芽诱导的影响结果进行多重比较,结果表明,6-BA最佳处理为水平2、水平3,而水平3处理下靓竹鞭芽的诱导率高于水平2处理,因此6-BA应选择水平3处理,即5 mg/L。KT最佳处理为水平2、水平3,但水平2处理下鞭芽的诱导率高于水平3处理,因此KT浓度应选择0.5 mg/L。NAA最佳处理为水平1、水平3,水平1处理下鞭芽的诱导率高于水平2,因此NAA的最适浓度为水平1,即不添加NAA。最适诱导组合为A3B2C1,且在该组合对应的处理下,即处理8下,丛芽诱导率最高,为87.57%,与其他处理之间差异显著,因此靓竹丛芽诱导最佳配方为 5 mg/L 6-BA+0.5 mg/L KT。
2.4 不同植物生长调节物质对靓竹鞭芽丛芽增殖的影响
不同生长调节物质组合对丛芽增殖过程中增殖系数及生长状况均产生较大的影响。其中6-BA对丛芽增殖影响最大,其次为KT,最小的为TDZ。为明确6-BA及KT不同水平对丛芽增殖的影响,对6-BA、KT进行进一步多重比较,结果表明,6-BA最佳处理为水平1,平均增殖系数最高,为4.84,即6-BA最佳处理浓度为 3 mg/L。KT最佳处理为水平1,即KT最佳浓度为0.5 mg/L。通过对丛生芽生长情况的观察,发现处理1與处理2、处理7之间差异不显著,但处理7时,即6-BA浓度为 5 mg/L 时,丛生芽的平均生长高度、叶片平均长度及叶片数量均优于其他配方下的丛生芽,且此时KT和TDZ均为最优处理配方。增殖过程中,除了增殖系数指标外,应当结合丛芽生长高度、生长状态等各种指标,共同比较从而筛选出最佳增殖配方。因此靓竹丛芽最佳增殖配方为5 mg/L 6-BA+0.5 mg/L KT+0.5 mg/L TDZ(表6)。
2.5 生根培养
常规快繁体系建立过程中,需要获取一定数量的丛芽之后,再对其进行生根诱导,从而建立其快繁体系。但本研究在对丛芽增殖过程中,组培苗出现不定根,对不同增殖配方下诱导出的不定根生长情况进行记录(表7),在不含TDZ的培养基中未见不定根的出现,在TDZ为0.2、0.5 mg/L时,均可长出不定根。其中,处理2和处理5、处理9条件下组培苗生根率较低,不定根较短,数量较少;处理3条件下生根率增加,但丛芽生长较慢;在处理4条件下,生根率最高,达68.33%,平均根长6.32 cm,平均根数11.7条,但丛生芽生根后基部易发黑,增殖速度减慢(图1-C);处理7条件下生根率低于处理4,但该处理下丛生芽增殖系数高,生长速度快,未出现发黑现象,且该处理同时为丛芽增殖最佳培养基配方,因此靓竹生根过程中,最佳生根配方为5 mg/L 6-BA+0.5 mg/L KT+0.5 mg/L TDZ。
2.6 移栽驯化
靓竹组培苗开盖炼苗1周后,移栽至含有壤土与草炭土、蛭石不同组合的基质中,进行培养观察(表8)。不同基质下靓竹移栽成活率均达到70%以上,其中在处理3条件下,即基质配比为壤土 ∶草炭土=2 ∶1时移栽成活率最高,为95%,此时植株叶片完全展开,花叶逐渐增多,长势较快;基质全为壤土时,移栽成活率最低,为72%,不少叶片逐渐发黄, 基质中添加蛭石比添加草炭土更适合靓竹组培
苗的生长。靓竹组培苗对光照的要求很高,在光照度较弱的地方,花叶易逐渐生长为绿叶,而随着光照度的增加,新长出来的幼叶多为花叶。
3 结论与讨论
建立无菌体系时,确定合适的消毒试剂及时间是成功进行组织培养的关键之一。正确的消毒方式可以有效抑制细菌、真菌等微生物的繁殖,有效防止外植体在培养过程中因染菌而死亡,从而提高其成活率[12]。乙醇、次氯酸钠、氯化汞等是组培中常见的消毒试剂,其中氯化汞消毒效果最佳[13-14],但氯化汞毒性大,易残留,对环境易产生污染,且不易回收,被列为实验室危险用品之一。不少研究表明,乙醇浓度为75%时[15-17],消毒效果较好;次氯酸钠溶液浓度为2%时[18-19],灭菌效果最佳。因此本试验选择75%乙醇与2%次氯酸钠溶液作为外植体的消毒试剂,对靓竹鞭芽进行消毒灭菌,结果表明,不同消毒剂处理不同时间对靓竹鞭芽的无菌率影响各不相同。靓竹鞭芽在乙醇处理时间为30 s时污染率较低,成活率较高,随着乙醇消毒时间延长,尽管能够将降低污染率,但外植体却因此受到伤害,造成死亡率上升、存活率降低。次氯酸钠处理15 min时,鞭芽污染率较低;死亡率在不同乙醇处理条件下不同,在乙醇处理30 s时最低,此时成活率最高,因此靓竹最佳外植体灭菌处理为乙醇 30 s,2%次氯酸钠溶液15 min,该处理下可获得较多的无菌萌动外植体。
在组培过程中,污染的发生不仅与取材的位置有关,同时与取材的季节也有关系。不同季节采样对靓竹鞭芽无菌体系的建立产生一定的影响,在春季及夏季采样,外植体污染率较高,成活率较低,可能因为该时期休眠芽数量较多,在萌动过程中易造成染菌死亡。而在秋季采样时,由于萌动芽数量多,不易经消毒剂处理产生毒害作用而死亡,使得成活率较其他季节高。因此靓竹鞭芽最佳采集时间为8—9月,这与圣音竹[20]、花吊丝竹[21]取材时间存在较大差异,与吊丝球竹[22]取材时间相同。
植物生长调节物质是影响组培快繁的重要因子之一,不同培养阶段所需植物生长调节物质的种类和浓度比例不同[23]。本研究中利用细胞分裂素与生长素对外植体进行丛芽的诱导,发现靓竹鞭芽在只含有细胞分裂素6-BA与KT的培养基中诱导效果最好,与云南龙竹、小蓬竹研究结果[24-25]相似,最佳靓竹鞭芽诱导配方为5 mg/L 6-BA+0.5 mg/L KT,誘导率可达87.57%,添加NAA不利于靓竹丛芽的诱导。继代过程中经常利用细胞分裂素进行丛生芽的增殖,不同细胞分裂素对不同植物丛生芽增殖的效果不同。陈宗礼等发现,TDZ与6-BA二者结合使用可显著促进枣树不定芽的增殖[26]。杨柳等在粉葛丛生芽增殖过程中发现6-BA和KT的组合可以让继代培养的苗长势旺盛而健壮,更适合作为继代培养的生长调节物质[27]。在靓竹丛芽增殖过程中,最佳增殖配方为5 mg/L 6-BA+0.5 mg/L KT+0.5 mg/L TDZ,增殖系数可达5.05,6-BA浓度高低在增殖过程中起主导作用,较高的浓度有利于靓竹丛芽的增殖,这与慈竹、云南甜龙竹的研究结果[28-29]相似。
植物根系发育调控的大量研究表明,激素是所有根系形成过程中必需的和共同的信号[30]。其中,生长素和细胞分裂素是2种最重要的生长调节物质。通常认为,细胞分裂素的主要生理功能之一是诱导芽的分化,而生长素则诱导根的分化。因此,在生根诱导过程中,经常选择生长素NAA/IBA等诱导不定根的形成,本研究中,在增殖过程中,培养基中只含有细胞分裂素时,出现生根苗,且试管苗增殖生长和生根均良好,这一现象在组织培养过程中较为罕见,这可能是由于在增殖培养过程中,植物生长调节物质浓度消耗导致培养基局部细胞分裂素浓度降低,从而使生长条件有利于根的形成[31]。王光萍等研究发现,只添加细胞分裂素可诱导竹子生根[32]。本研究中在不含TDZ的培养基中,未观察到生根现象,而在添加少量的TDZ后,均出现不同程度的根系生长,表明TDZ可显著诱导竹子生根,与Lin等研究结果[33]一致。此外,随着靓竹组培苗在增殖培养基上继续生长,不定根数量逐渐增多,根系变长,但丛生芽生长速度减慢,基部易出现发黑现象,说明不定根的生长会抑制竹子的增殖过程。
靓竹组培苗从无菌培养室转移到自然环境中,需要进行一定时间的炼苗处理,使其逐渐适应外界自然环境。炼苗时间的长短是保障移栽后能否成活、正常生长发育的关键[34]。本研究中,靓竹组培苗经过炼苗1周后,组培苗已逐渐适应外界自然环境,将其移栽至不同基质中,在壤土 ∶草炭土=2 ∶1基质中,成活率最高,达95%,且幼苗生长较好,培养2个月后,植株开始出现较多的花叶,丛生芽在增殖过程中产生的生根苗,经移栽后并成活,可对靓竹快繁体系的建立产生重要意义。
参考文献:
[1]王晓洁,刘西岭,辛 华. 青岛引种的5种观赏丛生竹的抗旱性研究[J]. 中国农学通报,2010,26(22):248-251.
[2]王建武,吴纯华,赵 亮,等. 6种观赏地被竹的抗逆性研究[J]. 山东林业科技,2015,45(5):48-51.
[3]王啸晨. 4种观赏竹花叶色素组成、结构分析及相关调控基因的研究[D]. 北京:中国林业科学研究院,2012.
[4]崔晓伟,高 健,张志坚,等. 5种地被竹叶绿素荧光特性研究[J]. 江西农业大学学报,2011,33(4):726-730.
[5]刘国华,王福升. 修剪对6种地被竹高生长的影响[J]. 南京林业大学学报(自然科学版),2008,32(2):145-147.
[6]刘松梅. 广玉兰林下5种地被竹生长和光合作用研究[J]. 上海建设科技,2017(4):85-87.
[7]张 芸,赵欢欢,张翠萍.冬季温室内竹类植物光合特性研究[J]. 现代园艺,2020,43(17):41-43.
[8]苏佳露,林树燕,史无双,等. 6个竹种竹叶的解剖形态观察与三维构建[J]. 南京林业大学学报(自然科学版),2020,44(1):47-53.
[9]苏佳露,史无双,杨雅运,等. 6个竹种叶色与光合色素含量及叶片结构比较[J]. 林业科学,2020,56(7):194-203.
[10]唐 红,黄 滔,刘 玮,等. 3个观赏竹在长沙地区引种适应性研究[J]. 中国农学通报,2019,35(31):26-32.
[11]Prutpongse P,Gavinlertvatana P.In vitro micropropagation of 54 species from 15 genera of bamboo[J]. HortScience,1992,27(5):453-454.
[12]贾 贤.土沉香组织培养再生体系的建立[D]. 海口:海南大学,2014:6-7.
[13]蔡 升,续 晨,宰学明,等. 乌饭树组织培养技术[J]. 北方园艺,2021(5):114-118.
[14]饶宝蓉,陈泳和,刘忠辉,等. 瓜蒌组培快繁体系研究[J]. 热带农业科学,2020,40(3):55-60.
[15]林 茜,高营营,覃换玲,等. ‘阳光玫瑰葡萄组培脱毒快繁技术研究[J]. 果树学报,2021,38(3):435-443.
[16]魏 博,潘登浪,刘子凡,等. 珠芽魔芋组培快繁技术[J]. 热带作物学报,2021,42(4):975-981.
[17]张忠强,张海泉,李俊豪,等. 芳香型矮牵牛‘Carpet Blue高效再生体系的建立[J]. 分子植物育种,2021,19(3):937-945.
[18]柯义强,郭鹏辉,马洪鑫,等. 兰州百合组培快繁体系的构建[J]. 浙江农业学报,2020,32(6):1000-1008.
[19]李江舟,庄 杰,金晓彤,等. ‘异株荨麻组织培养技术体系的建立[J]. 分子植物育种,2020,18(7):2331-2337.
[20]唐 磊. 两种观赏竹的组织培养研究[D]. 长沙:中南林业科技大学,2009.
[21]张 玮,黄树燕,谢锦忠,等. 花吊丝竹组培快繁育苗技术研究[J]. 林业科学研究,2010,23(6):914-919.
[22]徐强兴,杨广超. 吊丝球竹的组培快繁技术研究[J]. 广东农业科学,2007,34(2):42-44.
[23]吕 娟,龙秋梅,普建春.不同植物生长调节剂对草莓组培苗快繁的影响[J]. 现代农业科技,2017(21):121,125.
[24]李云海,陈丽华,吕诗涵,等. 云南龙竹试管无性系的建立及快繁研究[J]. 西部林業科学,2020,49(1):16-19.
[25]李敏进,刘济明,涂云燕,等. 小蓬竹消毒方法及诱导培养[J]. 贵州农业科学,2011,39(5):176-178.
[26]陈宗礼,齐向英,张向前,等. TDZ和6-BA对枣树继代培养的影响[J]. 西北农业学报,2006,15(3):162-165.
[27]杨 柳,廖宇娟,满建民.粉葛丛生芽诱导与增殖条件[J]. 分子植物育种,2021,19(12):4088-4099.
[28]夏登云,项 艳,卞林玲,等. 慈竹种子胚的组织培养[J]. 竹子研究汇刊,2009,28(1):12-15.
[29]郑祥亁,陈凌娜,孙茂盛,等. 基于种子无菌苗的云南甜龙竹组培快繁研究[J]. 世界竹藤通讯,2019,17(4):26-29,33.
[30]刘大同,荆彦平,李栋梁,等. 植物侧根发育的研究进展[J]. 植物生理学报,2013,49(11):1127-1137.
[31]杨海芸,王晓芹,张 宁,等. 日本花叶矢竹组织培养与叶色变异研究[J]. 竹子研究汇刊,2010,29(4):15-20.
[32]王光萍,丁雨龙. 几种观赏竹种组织培养研究[J]. 竹子研究汇刊,2002,21(2):5-9.
[33]Lin C S,Chang W C.Micropropagation of Bambusa edulis through nodal explants of field-grown culms and flowering of regenerated plantlets[J]. Plant Cell Reports,1998,17(8):617-620.
[34]邵 华,张玲琪,李俊梅,等. 铁皮石斛研究进展[J]. 中草药,2004,35(1):109-112.
