饲料花生四烯酸含量对子二代中华鲟成活与生长、抗氧化能力、组织花生四烯酸代谢酶活性及肠道菌群组成的影响
2021-12-08吴金平杨代勤危起伟朱建强
吴金平 杨代勤 杜 浩 罗 江 熊 伟 刘 源 危起伟* 朱建强*
(1.长江大学农学院,荆州 434025;2.中国水产科学研究院长江水产研究所,农业农村部淡水生物多样性保护重点实验室,武汉 430223)
二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)与花生四烯酸(arachidonic acid,ARA)是海洋生物重要的长链高不饱和作脂肪酸,对鱼类有着重要的生理作用。海水鱼类中,一般DHA与EPA有利于鱼类生长,并且鱼体缺乏将亚麻酸(18∶3n-3)转化成DHA与EPA的能力,因此将DHA与EPA当作海水鱼类的必需脂肪酸,从而忽略了ARA相关的研究[1-4]。随着饲料添加ARA后的重要作用越来越突出,目前关于ARA的研究亦越来越多。ARA已经表现出具有影响海水鱼类的存活与生长[5-10]、抗应激[11-12]、脂质代谢[13-14]、激素合成[15-17]、色素调控[18-20]、免疫调控[21-22]及亲鱼的繁殖性能[23-24]等一系列的生理调控作用。相比于海水鱼类,淡水鱼类ARA的相关研究更少,这与淡水鱼类必需脂肪酸的满足可以通过亚油酸与亚麻酸的获取来实现以及淡水鱼类对ARA的需求量很小等因素有关[4]。值得关注的是最近有许多淡水鱼类也表现出饲料添加ARA后会促进其生长、调控脂质代谢与提高亲鱼的繁殖性能等重要的生理功能[25-27];同时,有学者提出鲟鱼不具备将亚油酸转化为ARA的能力[28],这意味着ARA在鲟鱼上的生理功能需要重新定位。
中华鲟作为一种江海洄游型鱼类,具有体型大、寿命长与性成熟周期长等特点,由于涉水工程建设、捕捞、航运及污染等人类活动的影响,其赖以生存的栖息环境已经退化或功能丧失,导致其自然种群严重衰退,目前已被列入我国国家一级重点保护动物[29-31]。Zhou等[32]、Liu等[33]提出ARA是中华鲟性腺发育及其生长中的关键营养物质。Leng等[34]基于转录组学与代谢组学的研究表明饲料中18%的脂肪水平促进了ARA的代谢且有利于中华鲟性腺发育。这些研究结果表明ARA是人工淡水养殖环境下的重要营养因子。当前,关于中华鲟ARA相关的营养研究尚未见报道。基于此,本试验拟配制4种不同ARA含量的试验饲料,养殖性腺发育处于Ⅱ期的4龄子二代中华鲟22周,考察ARA对其成活与生长、抗氧化能力、组织ARA代谢酶活性及肠道菌群组成的影响,从而为人工养殖环境下中华鲟养殖提供ARA营养学参数。
1 材料与方法
1.1 试验饲料配制
采用秘鲁鱼粉、脱脂豆粕、酪蛋白与明胶作为蛋白质源,面粉作为糖源,鱼油与ARA纯化油作为主要的脂肪源,通过在基础饲料中添加0、0.5%、1.0%和2.0%的ARA纯化油(ARA占总脂肪酸的44.88%),制成4种等氮等能的试验饲料,经气相色谱检测,试验饲料中ARA含量分别为0.18%、0.53%、0.96%和1.89%。试验饲料组成及营养水平见表1,试验饲料主要脂肪酸组成见表2。饲料制作前,将所有的原料粉碎后过60目分级筛,按照配方分别称取相应重量的饲料原料,混合,少量的成分采用逐级预混法混合,与鱼油、ARA纯化油混合后,最后加入约20%的水,再次混匀,用颗粒饲料机(KL-210)制成直径约5.80 mm、长约12.00 mm的条形状颗粒饲料,于室内阴凉干燥处电风扇吹干后,置于-20 ℃冰箱中保存备用。
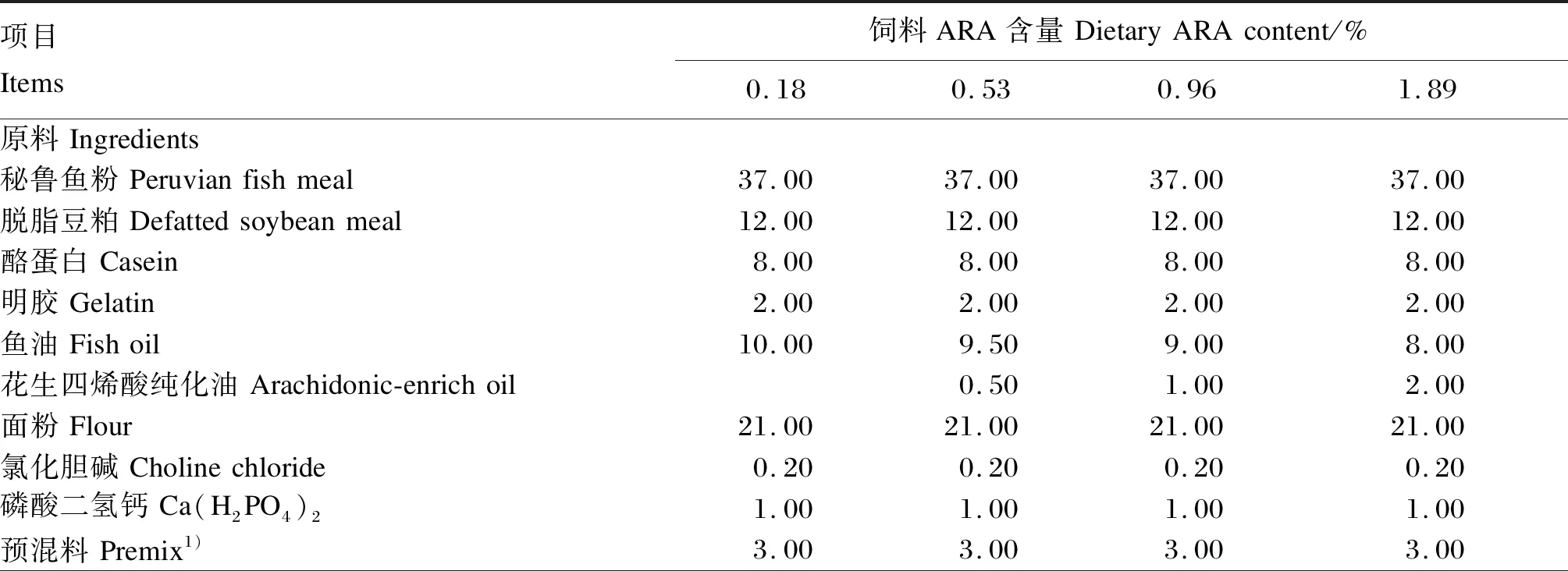
表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets (DM basis) %
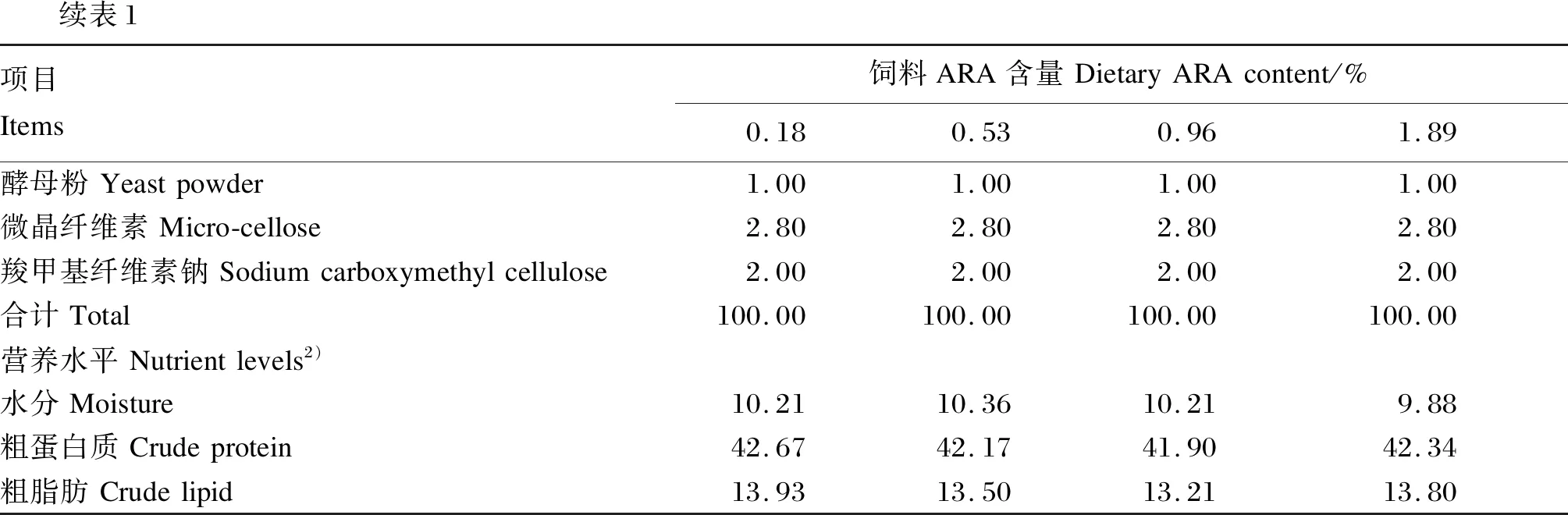
续表1项目Items饲料ARA含量DietaryARAcontent/%0.180.530.961.89酵母粉Yeastpowder1.001.001.001.00微晶纤维素Micro-cellose2.802.802.802.80羧甲基纤维素钠Sodiumcarboxymethylcellulose2.002.002.002.00合计Total100.00100.00100.00100.00营养水平Nutrientlevels2)水分Moisture10.2110.3610.219.88粗蛋白质Crudeprotein42.6742.1741.9042.34粗脂肪Crudelipid13.9313.5013.2113.80
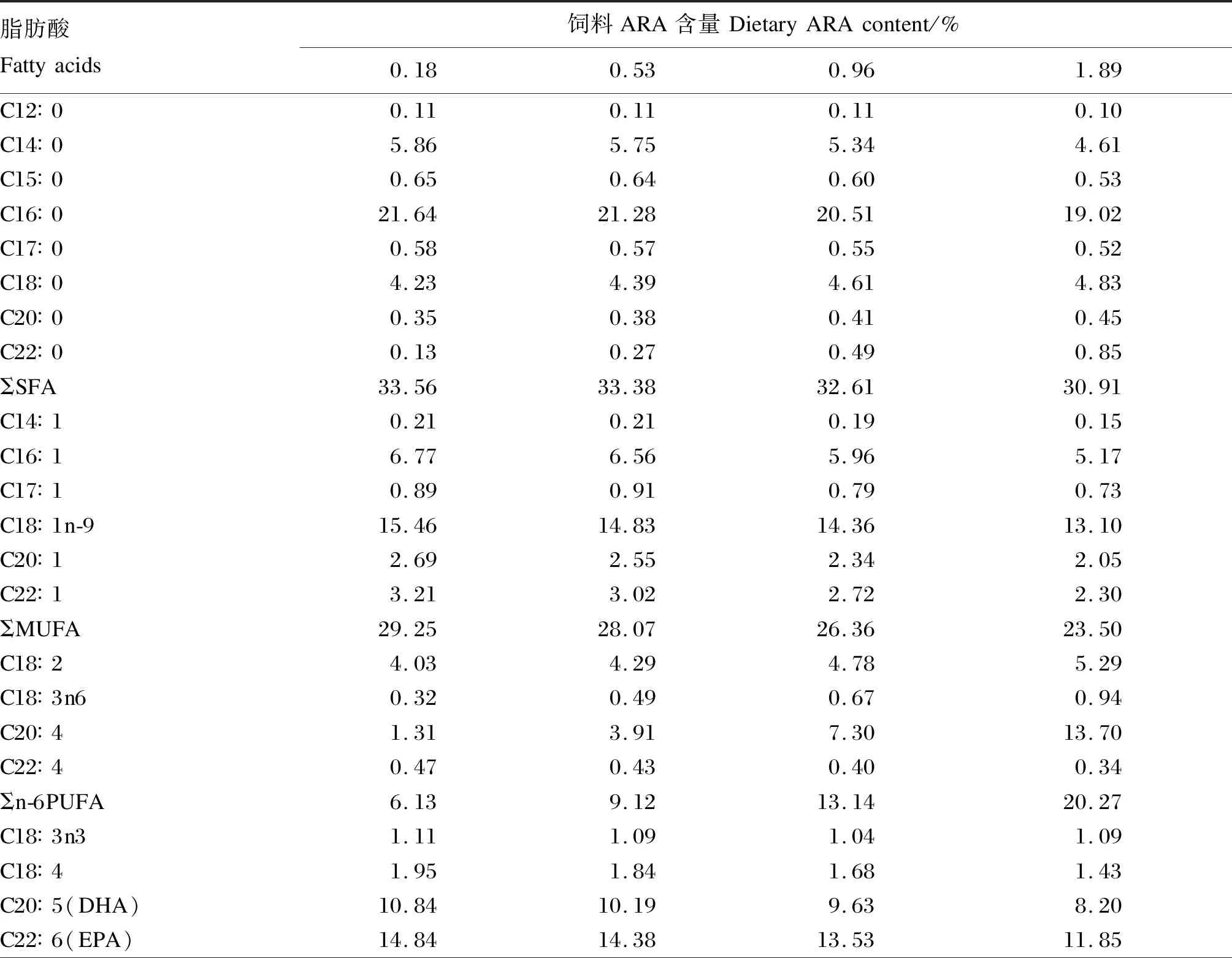
表2 试验饲料主要脂肪酸组成 Table 2 Main fatty acid composition of experimental diets %
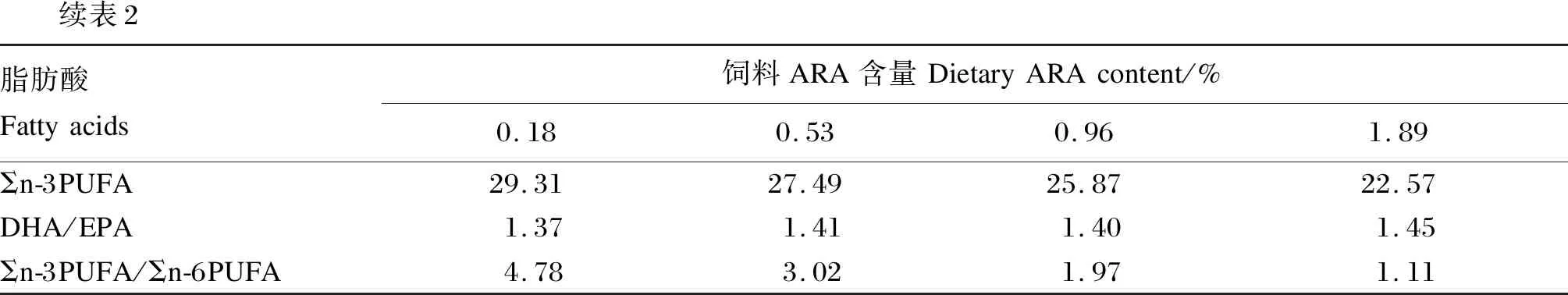
续表2脂肪酸Fattyacids饲料ARA含量DietaryARAcontent/%0.180.530.961.89Σn-3PUFA29.3127.4925.8722.57DHA/EPA1.371.411.401.45Σn-3PUFA/Σn-6PUFA4.783.021.971.11
1.2 试验鱼与养殖管理
试验鱼来源于中国水产科学研究院长江水产研究所农业农村部中华鲟保护与增殖放流中心2016年繁殖的子二代中华鲟,该批子二代中华鲟养殖于直径长14 m,宽7 m,水深1 m的椭圆形水泥池中。试验开始前,采用学科组雌雄性别特异性分子标记方法对该批试验鱼进行雌雄性别鉴定。鉴定完成后,将72尾初始体重为(4.17±0.22)kg的试验鱼(性别比为1∶1)随机分配到12个圆形流水养殖水泥池(直径3 m,水深0.5 m)中,每个养殖池放养18条鱼,每种饲料投喂3个养殖池,养殖22周。养殖期间采用表观饱食法投喂,每天投喂2次(08:00和20:00),投食量约为鱼体重的1%,每餐实际投喂量因鱼的摄食情况而变化,每天定时排污1次,排水量约为池水的1/3。养殖期间水温18.0~21.4 ℃,溶氧浓度>5.56 mg/L,pH 7.91~8.19,氨氮浓度<0.5 mg/L,铁离子浓度为0.037~0.077 mg/L,水体浊度为0.50~1.79 NTU。
1.3 样品采集与测定
养殖试验结束后,试验鱼饥饿24 h,每组随机挑选6尾雌鱼麻醉,测量体重与体长。将鱼体表面的水擦干后,采集血液,血液于4 ℃冰箱过夜澄清后于3 000×g、4 ℃离心15 min,收集上清液用于抗氧化指标的检测;解剖鱼体后,剥离肝脏与性腺组织,用于测定组织抗氧化指标及ARA代谢酶活性。接着,剥离后肠的肠道内容物于无菌冻存管中,所有样品于液氮速冻后,立即置于-80 ℃冰箱保存备用。
根据下列公式,计算增重率(weight gain rate,WGR)与成活率(survival rate,SR)。
增重率(%)=[(W1-W0)/W0]×100;成活率(%)=(N1/N0)×100。
式中:W1为每个养殖池终末体质量(kg);W0为每个养殖池初始体质量(kg);N1为终末尾数;N0为初始尾数;
饲料粗蛋白质、粗脂肪含量分别采用凯氏定氮法、索氏抽提法测定。饲料水分含量采用103 ℃恒温干燥失重法测定。饲料脂肪酸含量采用液相色谱仪(GC-2030,Shimadzu,日本)测定,色谱柱型号为DB-WAX-30M I.D.0.32 mm。
肝脏与血清中谷胱甘肽硫转移酶(glutathione S-transferase,GST)、过氧化氢酶(peroxidase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD))活性与丙二醛(malondialdehyde,MDA)含量以及肝脏与性腺组织中环氧合酶-1(cyclooxygenase-1,COX-1)、环氧合酶-2(cyclooxygenase-2,COX-2)、脂氧合酶(lipoxgenase,LOX)与细胞色素氧化酶P450(cytochrome P450,CYP450)活性均采用江苏酶免实业有限公司生产的试剂盒测定。
1.4 肠道菌群多样性分析
1.4.1 DNA提取与PCR扩增

1.4.2 PCR产物的混样和纯化
PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测;对检测合格的PCR产物进行磁珠纯化,采用酶标定量,根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,对目的条带使用QIAGEN公司提供的胶回收试剂盒回收产物。
1.4.3 文库构建和上机测序
1.5 数据处理与分析
除肠道菌群组成外的所有数据经SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA),并采用Tukey HSD进行组间多重比较,显著性水平设置为P<0.05。试验结果以平均值±标准误(mean±SE)表示。
2 结果与分析
2.1 饲料ARA含量对子二代中华鲟成活与生长的影响
饲料ARA含量对子二代中华鲟成活与生长的影响见表3。经过22周的养殖,饲料中不同含量的ARA对试验鱼的终末体重、增重率及成活率均未产生显著影响(P>0.05)。
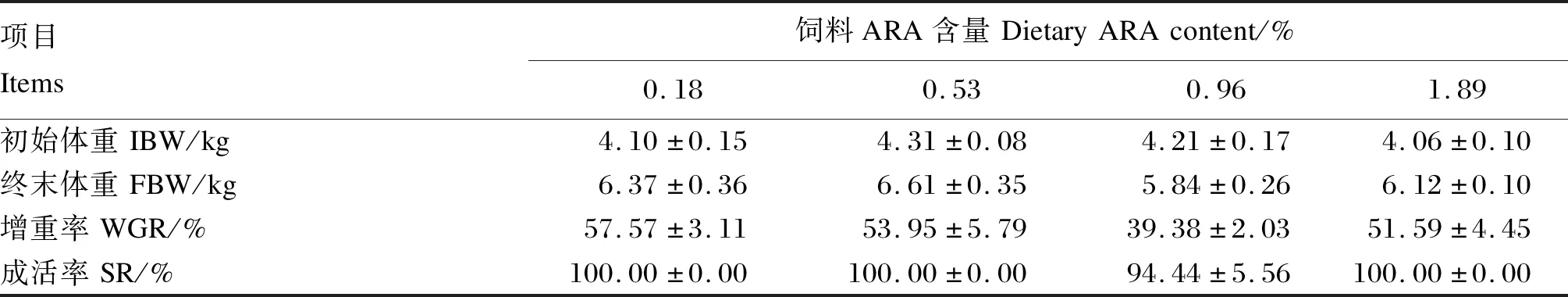
表3 饲料ARA含量对子二代中华鲟成活与生长的影响Table 3 Effects of dietary ARA content on survival and growth of F2 generation Chinese sturgeon
2.2 饲料ARA含量对子二代中华鲟肝脏与血清抗氧化指标的影响
饲料ARA含量对子二代中华鲟肝脏与血清抗氧化能力的影响见表4。试验鱼经过22周的养殖后,1.89% ARA组肝脏SOD活性显著高于0.18%与0.53%ARA组(P<0.05),与0.96%ARA组无显著差异(P>0.05)。1.89%ARA组肝脏CAT活性显著高于0.18%与0.53%ARA组(P<0.05),与0.96%ARA组无显著差异(P>0.05)。1.89%ARA组肝脏MDA含量最低,与0.18%、0.53%及0.96%ARA组差异显著(P<0.05)。0.18%ARA组肝脏GST活性显著低于1.89%ARA组(P<0.05),与0.53%与096%ARA组无显著差异(P>0.05)。血清中SOD、CAT、GST活性与MDA含量不受饲料ARA含量的显著影响(P>0.05)。
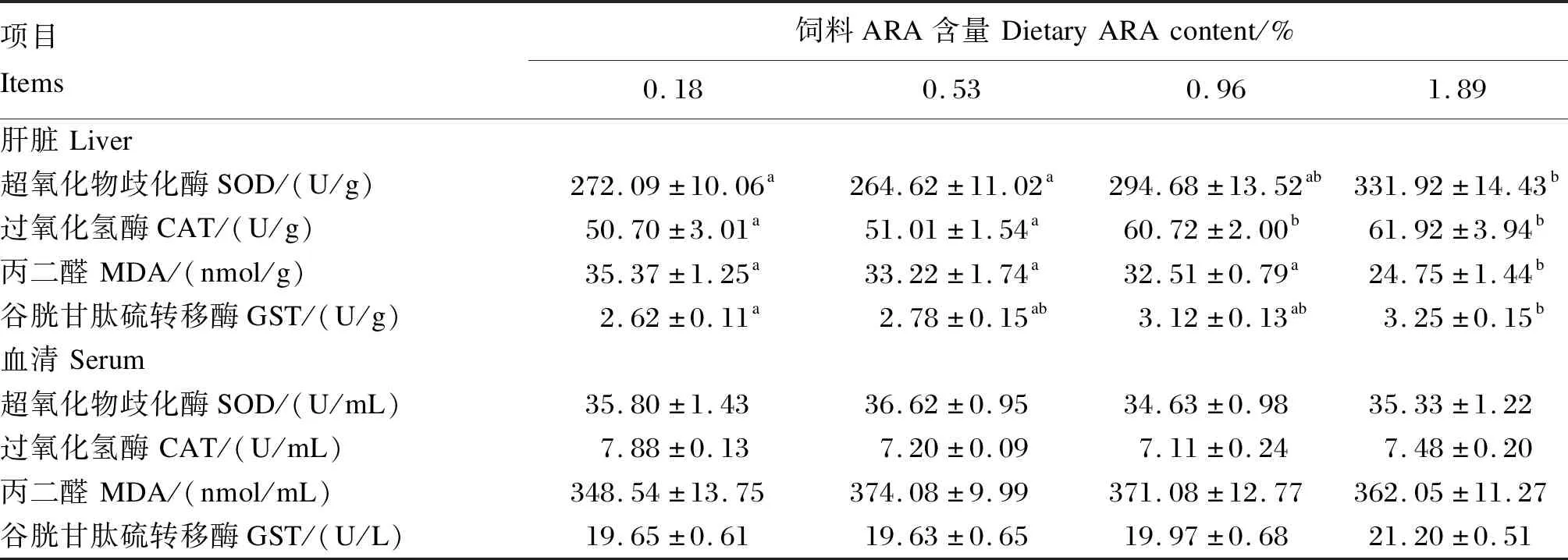
表4 饲料ARA含量对子二代中华鲟肝脏与血清抗氧化指标的影响Table 4 Effects of dietary ARA content on liver and serum antioxidant indexes of F2 generation Chinese sturgeon
2.3 饲料ARA含量对子二代中华鲟肝脏与性腺ARA代谢酶活性的影响
饲料ARA含量对子二代中华鲟肝脏与性腺ARA代谢酶活性的影响见表5。试验鱼经过22周的养殖后,性腺中COX-2与CYP450活性均以1.89%ARA组最高,且显著高于0.18%与0.53%ARA组(P<0.05),与0.96%ARA组无显著差异(P>0.05)。0.96%ARA组性腺中COX-1活性显著高于0.18%与0.53%ARA组(P<0.05),与1.89%ARA组无显著差异(P>0.05)。1.89%ARA组性腺中LOX活性显著高于0.18%ARA组(P<0.05),与0.53%及0.96%ARA组无显著差异(P>0.05)。肝脏中,COX-1、COX-2与LOX活性均以1.89%ARA组最高且显著高于0.18%与0.53%ARA组(P<0.05),与0.96%ARA组无显著差异(P>0.05)。0.18%ARA组肝脏中CYP450活性显著低于0.96%与1.89%ARA组(P<0.05),与0.53%ARA组无显著差异(P>0.05)。
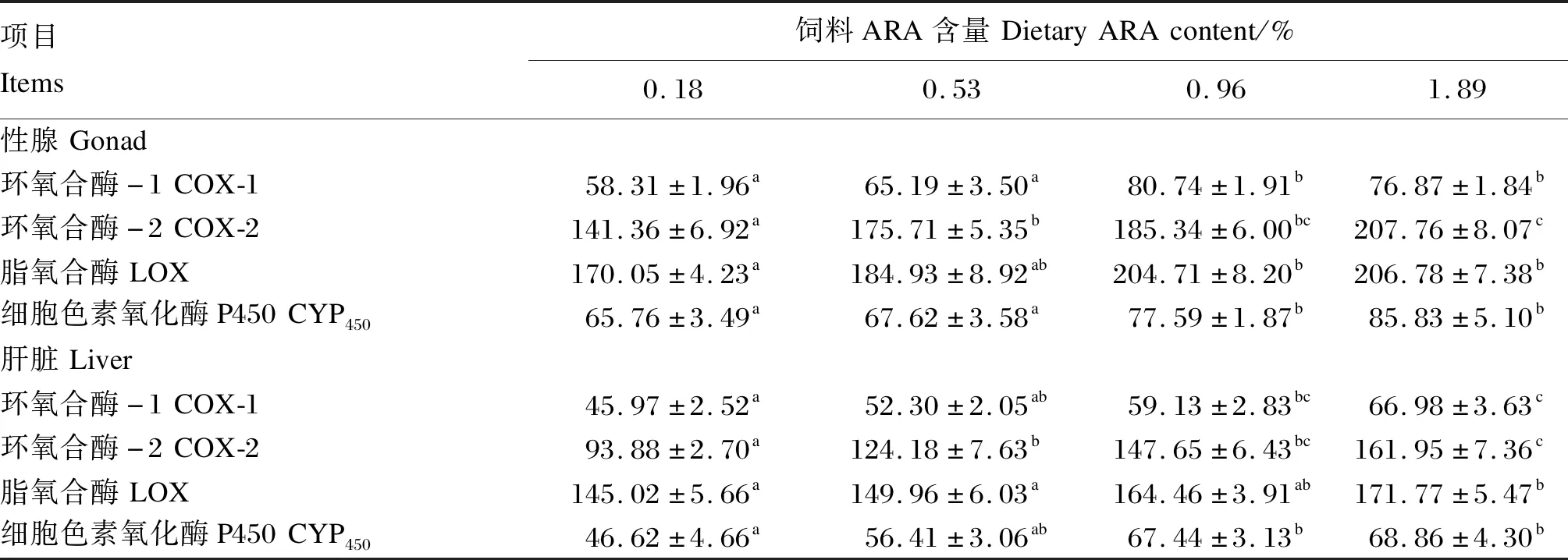
表5 饲料ARA含量对子二代中华鲟肝脏与性腺ARA代谢酶活性的影响Table 5 Effects of dietary ARA content on liver and gonad ARA metabolism enzyme activities of F2 generation Chinese sturgeon ng/g
2.4 饲料ARA含量对子二代中华鲟肠道菌群α多样性的影响
饲料ARA含量对子二代中华鲟肠道菌群α多样性的影响见表6。试验鱼经过22周的养殖后,其肠道菌群α多样性受到了饲料ARA含量的影响。0.18%ARA组Chao1指数与ACE指数显著高于0.53%ARA组(P<0.05),与0.96%及1.89%ARA组无显著差异(P>0.05)。Simpson指数不受饲料ARA含量的影响,各组之间无显著差异(P>0.05)。0.18%ARA组Shannon指数与Observed-species数量显著高于0.53%ARA组(P<0.05),与0.96%及1.89%ARA组无显著差异(P>0.05)。系统发育多样性指数PD-whole tree指数不受饲料ARA含量的影响,各组之间无显著差异(P>0.05)。
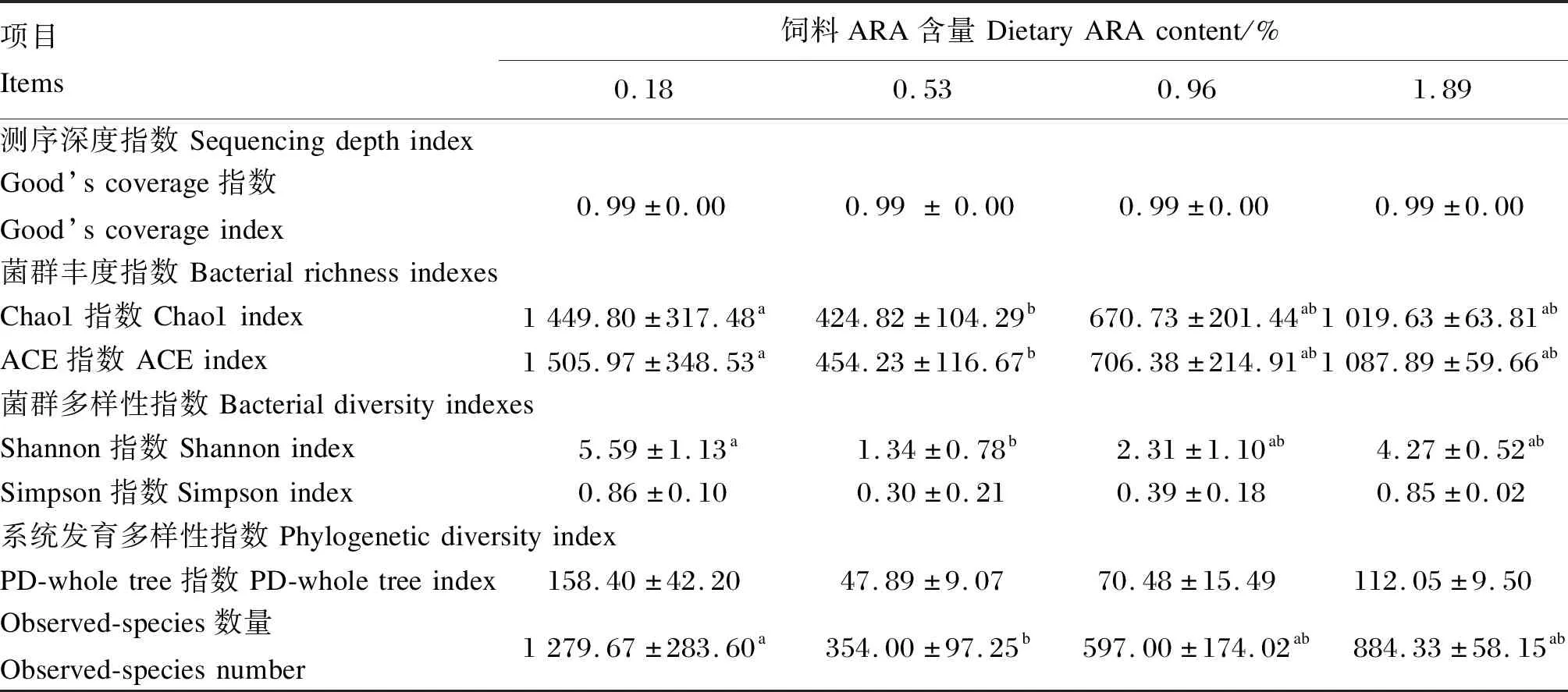
表6 饲料ARA含量对子二代中华鲟肠道菌群α多样性的影响Table 6 Effects of dietary ARA content on intestinal microbial α diversity of F2 generation Chinese sturgeon
2.5 饲料ARA含量对子二代中华鲟肠道菌群组成的影响
将所有样本中相对丰度不在前10的门与属归为其他,表7、表8分别展示了各组样本在门与属分类水平排名前10的菌群组成。在门分类水平下,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)为0.18%、1.89%ARA组的优势菌门,厚壁菌门分别占到了49.44%、56.44%,变形菌门分别占到了19.77%、25.44%。梭杆菌门(Fusobacteriota)为0.53%、0.96%ARA组优势菌门,分别占到了64.59%、75.71%。上述结果表明,梭杆菌门、厚壁菌门与变形菌门是不同ARA含量饲料处理下的优势菌门。在属分类水平下,0.18%ARA组活泼瘤胃球菌类群([Ruminococcus]_gnavus_group)是其优势属,占比为20.73%。鲸杆菌属(Cetobacterium)是0.53%、0.96%ARA组的优势菌属,分别占到了65.54%、75.66%。链球菌属(Streptococcus)是1.89%ARA组的优势菌属,占比为21.58%。上述结果表明,鲸杆菌属、活泼瘤胃球菌类群与链球菌属可能是不同ARA含量饲料处理下的优势菌属。
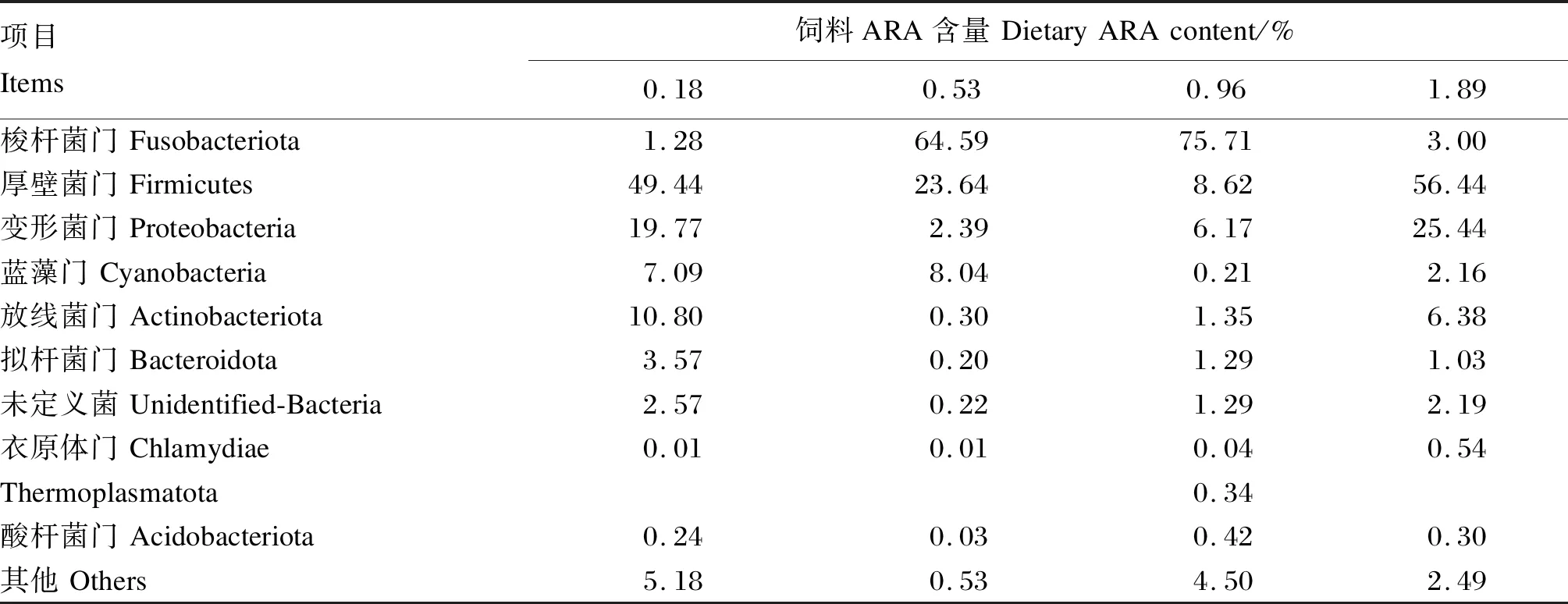
表7 饲料ARA含量对子二代中华鲟肠道菌群基于门水平的相对丰度的影响Table 7 Effects of dietary ARA content on relative abundances of intestinal microbial communities at phylum level of F2 generation Chinese sturgeon %
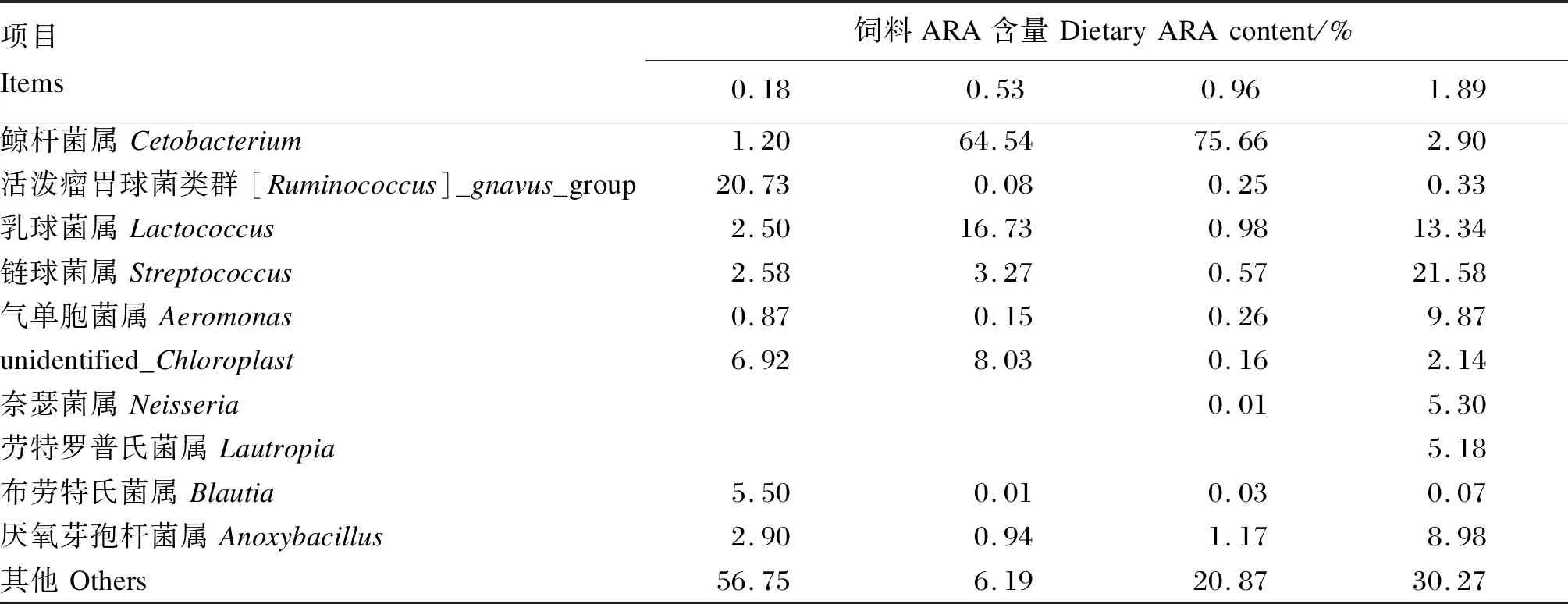
表8 饲料ARA含量对子二代中华鲟肠道菌群基于属水平的相对丰度的影响Table 8 Effects of dietary ARA content on relative abundances of intestinal microbial communities at genus level of F2 generation Chinese sturgeon %
3 讨 论
3.1 饲料ARA含量对子二代中华鲟成活与生长的影响
3.2 饲料ARA含量对子二代中华鲟抗氧化能力的影响
3.3 饲料ARA含量对子二代中华鲟肝脏与性腺ARA代谢酶活性的影响
游离的ARA在机体内存在着三大类酶促反应参与类二十烷酸的合成,包括经环氧合酶(COX)催化形成的前列腺素与凝血噁烷,经LOX催化形成的白三烯及不同类别的羟基二十碳四烯酸,以及经CYP450催化形成的环氧二十碳四烯酸与羟基二十碳四烯酸(HETEs)[49-51]。当前,关于饲料添加ARA后对试验对象组织中ARA代谢酶活性的报道还很鲜见。本试验中,性腺与肝脏中COX-1、COX-2、LOX及CYP450的活性均随饲料ARA含量的升高而升高,表明饲料中添加ARA后对子二代中华鲟组织中ARA代谢酶具有一定的正向调控作用,同时发现同种酶活性在性腺中是高于肝脏中的,这可能表明ARA优先沉积于性腺组织中导致其与底物结合的活性高,是否意味着ARA在中华鲟子二代性腺发育过程有着更重要的作用还需进一步研究。
3.4 饲料ARA含量对子二代中华鲟肠道菌群α多样性的影响
本试验中,各组样本的Good’s coverage指数均在0.99以上,表明每组样本达到了足够的测序覆盖度且本次检测的操作分类单元(OTU)数量也足够代表该批次抽样群体。α多样性指数是反映样本内的微生物群落多样性[52],通过单样本的α多样性分析可以反映样本内的微生物群落的丰富度和多样性,主要包括Chao1指数、ACE指数、Shannon指数、Simpson 指数、Good’s coverage指数与PD-whole tree指数等。本试验中,菌群丰度指数中的Chao1指数与ACE指数均以0.53%ARA组最低,在0.18%、0.96%和1.89%ARA组之间无显著差异;同样的,菌群多样性指数中的Shannon指数与Simpson指数以及Observed-species数量也表现出一致的趋势;而系统发育多样性指数PD-whole tree指数则在各组之间无显著差异,这可能表明饲料中含有0.18%、0.96%与1.89%的ARA有利于肠道菌群的丰富度(Chao1指数与ACE指数)和多样性(Shannon指数与Simpson指数)。当前关于饲料中添加ARA对肠道菌群多样性的研究仅见中间球海胆[42]相关的研究报道,现有研究中发现饲料ARA含量对中间球海胆的菌群丰富度(Chao1指数)及多样性(Shannon指数与Simpson指数)均无显著性影响,这可能和海胆与鱼类属于2个不同的物种密切相关。关于饲料营养组分影响鱼类肠道菌群多样性的研究有很多,但是不同的研究结果也不尽相同。例如,李秀玲[53]报道,不同脂肪源对ACE指数、Chao1指数、Shannon指数和Simpson指数具有显著影响,磷虾油组和1∶1鱼油-豆油组具有较高的肠道菌群丰富度和多样性;Xu等[54]报道,不同的鲟类摄食同种饲料,其肠道菌群的丰富度与多样性也是不一致的,这些研究结果表明饲料组分对肠道菌群多样性的影响不一致,也进一步表明关于饲料添加ARA后对鱼类肠道菌群多样性产生影响的问题是一个值得进一步探索的课题。
3.5 饲料ARA含量对子二代中华鲟肠道菌群组成的影响
本试验中,在门分类水平下,梭杆菌门、厚壁菌门与变形菌门是子二代中华鲟肠道中较为丰富的门类。中间球海胆经过不同ARA含量饲料投喂后,也发现变形菌门与厚壁菌门在各组的相对丰度较高[42]。对人工养殖达氏鳇(Husodauricus)幼鱼肠道菌群组成的分析发现厚壁菌门是其最主要的菌群(占比98.25%)[55];对欧洲鳇(Husohuso)的研究也表明变形菌门与厚壁菌门是其优势菌门[54]。对长江鲟(Acipenserdabryanus)的研究也表明梭杆菌门、厚壁菌门与变形菌门是其优势菌门[56]。这些研究结果表明梭杆菌门、厚壁菌门与变形菌门是鲟类肠道中较为丰富的门类,本试验中这3个菌门的相对丰度在不同ARA含量饲料处理下存在差异可能更多的与饲料ARA含量不同有关。在属分类水平下,鲸杆菌属在0.53%与0.89%ARA组分别占到了64.54%与75.66%,表明该属是其优势菌属,与Liu等[57]报道的鲸杆菌属是肉食性鱼类主要的菌属之一的结果相符;在达氏鳇[55]与长江鲟[56]的研究中也检测到了鲸杆菌属。值得注意的是,0.18%ARA组中检测到了相对丰度较高的活泼瘤胃球菌类群;1.89%ARA组中检测到了相对丰度较高的乳球菌属、链球菌属、气单胞菌属与厌氧芽孢杆菌属,而中间球海胆经过不同ARA含量饲料投喂后也检测到了芽孢杆菌属与乳球菌属[42];在长江鲟[56]的研究中也检测到了气单胞菌属。上述这些菌属在1.89%ARA组中的相对丰度较高,这是否有利于中华鲟子二代肠道健康及其具体原因还需进一步研究。
4 结 论
饲料中添加1.0%的ARA纯化油使饲料ARA含量为0.96%时对子二代中华鲟的生长与存活无显著影响,但能增强鱼体的抗氧化能力、组织中ARA代谢酶活性及调控肠道菌群多样性。
