植物乳杆菌对全株杂交构树青贮品质、有氧稳定性及瘤胃体外产气特性的影响
2021-12-08张玉琳杨泽毅李超程黄星宇张凡凡马春晖
张玉琳 杨泽毅 李超程 黄星宇 张凡凡* 马春晖*
(1.石河子大学动物科技学院,石河子 832000;2.新疆科构生物科技有限公司,石河子 832000)
构树(Broussonetiapapyrifera)又称壳树、褚树等,为多年生落叶乔木,营养价值高,适应性强,其叶片中粗蛋白质、粗脂肪含量高,粗纤维含量低,且富含各种氨基酸,是一种优质的非常规饲料资源。杂交构树是由中国科学院植物研究所通过现代农业育种技术培育出的优质树种[1-2],目前主要包括中科1号、中科2号、中科3号、杂交构树101、杂交构树201等品种,各品种在保持构树原有优良特性的同时,兼具耐贫瘠、耐刈割、营养价值高等特点,极具开发价值[3]。当前,我国诸多地区都相继开展了杂交构树的栽培和利用研究,而新疆地区未见相关研究报道。因此,开展杂交构树加工研究和实际生产对本地区实现“经济-社会-生态”协调持续发展和乡村振兴具有重要现实意义。
目前杂交构树茎叶分离机械作业成本高,不易实现,因此其主要以全株刈割进行利用,虽全株构树的营养价值低于叶片,但诸多研究通过发酵手段对全株构树进行加工利用也能使育肥猪、肉牛、奶牛等表现出较好的生产性能[4-6]。杂交构树的原料特征与苜蓿类似,表面附着乳酸菌数量较少(<1×105CFU/g),干物质和可溶性碳水化合物含量较低,缓冲能高,直接青贮较难成功[7],而添加外源微生物制剂尤其是乳酸菌制剂是改善青贮品质最为便捷和有效的方式[8-10],其主要作用是通过调节青贮原料微生物区系,确保青贮营养成分的保存,保证青贮饲料的发酵品质和稳定性;同时促进多糖和纤维的转化,提高青贮的消化率及适口性[11]。其中,植物乳杆菌(Lactobacillusplantarumas)属同型发酵乳酸菌,其生长繁殖较快,对于发酵底物利用率高、竞争力强,在发酵初期能够产生大量乳酸,使得发酵体系迅速形成酸性环境,抑制有害微生物的生长繁殖,最大程度地保存青贮原料的营养物质[12]。
有研究报道称,在杂交构树叶中接种植物乳杆菌,随着其添加量的增加青贮品质更佳[13];或将植物乳杆菌、异型发酵乳酸菌布氏乳杆菌(Lactobacillusbuchneri)、各类纤维素酶(纤维素酶、木聚糖酶、β-葡聚糖酶)、糖蜜联合接种时,青贮品质最优[14];但也有报道称,杂交构树青贮单独添加糖蜜青贮品质最优[15]。那么在实际生产中,单独接种植物乳杆菌对裹包全株杂交构树的青贮品质有何影响?从经济角度出发,是否添加最低剂量(1×105CFU/g)的植物乳杆菌即可达到改善青贮品质的目的?目前尚无定论。鉴于此,本研究在实际生产作业中添加低剂量植物乳杆菌,研究其对全株杂交构树青贮发酵品质、微生物数量、瘤胃体外产气特性及有氧暴露过程中青贮发酵品质和微生物数量的影响,为加工调制优质杂交构树青贮饲料提供指导,同时促进本地区杂交构树的高效加工利用。
1 材料与方法
1.1 试验材料
青贮原料于2020年9月份采自新疆维吾尔自治区石河子地区143团杂交构树种植示范基地(N44°52′,E85°50′,海拔335 m),人工种植的杂交构树(杂交构树201)待株高长至1.5 m左右,利用青饲料收获机进行全株收割粉碎(图1-A),留茬高度为15~20 cm,粉碎长度1~2 cm。植物乳杆菌购自中国工业微生物菌种保藏管理中心(CICC)。
1.2 试验设计
试验分为2个处理,分别为对照处理(CK处理,不添加任何菌剂)和植物乳杆菌处理(LP处理,添加1×105CFU/g植物乳杆菌)。将菌种在MRS液体培养基中培养,平板计数后确定其数量,按比例配制菌液,以鲜重为基础进行添加。用水枪均匀地喷洒至待贮青贮原料表面(CK处理喷洒等量的水)(图1-B)。喷洒完毕后立刻混匀进行裹包青贮(图1-C),原料含水量76.35%,裹包密度500 kg/m3,每个处理10包。裹包规格半径50 cm,高100 cm,裹包膜厚度0.1 mm,裹包层数8~10层,裹包完成后放置于室外发酵60 d后开包(图1-D),随后测定全株杂交构树青贮的发酵品质、微生物数量和瘤胃体外产气模型参数,并在开包后的第0(开包当天)、4、8、12天检测全株杂交构树青贮的发酵品质和微生物数量。

A:克拉斯收割机收割作业;B:喷洒菌剂;C:全株杂交构树青贮拉伸膜裹包作业;D:全株杂交构树青贮感官情况。A:the harvesting operation of Crass harvester;B:spraying microbial inoculum;C:the stretching film wrapping operation of whole-plant hybrid Broussonetia papyrifera silage;D:the sensory condition of whole-plant hybrid Broussonetia papyrifera silage.图1 全株杂交构树生产加工过程Fig.1 Production and processing process of whole-plant hybrid Broussonetia papyrifera
1.3 测定指标及方法
1.3.1 营养成分分析
全株杂交构树鲜样及青贮营养成分主要测定干物质(DM)、粗蛋白质(CP)、可溶性碳水化合物(WSC)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、粗脂肪(EE)、粗灰分(Ash)含量。其中,DM含量采用105 ℃烘干法测定(DHG-9620A鼓风干燥机,上海合恒仪器设备有限公司);CP含量采用凯氏定氮法测定(Kjeltec 8400 FOSS全自动凯氏定氮仪,美国福斯公司);WSC测定采用蒽酮比色法测定(722可见分光光度计,上海精密科学仪器有限公司);NDF和ADF含量采用范氏洗涤纤法测定(自制纤维袋,专利号:ZL201621382211.7和ZL201621382214.0);EE含量采用索氏提取法测定(玻璃索氏提取器,上海垒固有限公司);Ash含量采用550 ℃灼烧法测定(XL-3000型高效节能智能一体马弗炉,上海合恒仪器设备有限公司)[16]。
1.3.2 发酵特征指标分析
发酵特性指标主要测定pH、氨态氮(NH3-N)、乳酸(lactic acid,LA)、乙酸(acetic acid,AA)、丙酸(propanoic acid,PA)、丁酸(butyric acid,BA)。pH用酸度计测定(PHSJ3F酸度计,上海仪电科学仪器股份有限公司);LA、AA、PA、BA含量采用液相色谱法(Agilent1260高效液相色谱仪HPLC,美国安捷伦科技公司)测定;NH3-N含量采用苯酚-次氯酸比色法测定[16-17]。
1.3.3 微生物数量分析
微生物主要测定好氧细菌(aerobic bacteria,AB)、乳酸菌(lactic acid bacteria,LAB)、酵母菌(yeast)和霉菌(mold)数量。AB、LAB、酵母菌、霉菌数量分别采用营养琼脂培养基、MRS培养基、麦芽糖浸粉琼脂培养基和高盐察氏培养基进行培养,所有培养基均购自北京路桥集团有限公司,培养结束后进行平板计数,并计算微生物数量[18]。
1.3.4 绵羊瘤胃体外产气分析
选择3只健康、体重接近的哈萨克羊作为瘤胃液供体。试验饲粮由200 g精料(玉米51.0、麸皮24.0%、豆粕18.0%、碳酸氢钙2.5%、预混料2.0%、尿素1.5%、食盐1.0%)和1.8 kg青贮玉米组成,每天晨饲(08:00),自由饮水,持续饲喂1个月。饲喂结束后,在晨饲前宰杀采集瘤胃液,采集时将瘤胃液以4层纱布初步过滤到预热过的保温瓶中,迅速带回实验室处理,再次用4层纱布过滤瘤胃液后弃去过滤后的残渣,置于39 ℃水浴锅中待使用。参照Menke等[19]的方法配制人工瘤胃液,将人工瘤胃液与瘤胃液以2∶1的比例进行混合,用分液器分别向所有培养管注入30 mL混合培养液,将培养管进液端竖直向上排尽管内气体,用止水夹夹住前端硅橡胶管,并记录相应的初始刻度值(mL)。将培养管迅速放入已预热(39 ℃)的水浴箱中,待加液完毕后所有培养管同时转入人工瘤胃培养箱中进行培养。按照卢德勋等[20]的方法测定第0(初始发酵时)、2、4、6、8、10、12、18、24、30、36、42、48 h的产气量,同时分析有机物消化率(OMD)和代谢能(ME),计算公式如下:
OMD=0.986×GP+0.060 6×CP+11.03;ME=0.1639×GP+0.007 9×CP+0.023 9×EE+0.04。
式中:GP为24 h的产气量(mL);CP为粗蛋白质含量(%);EE为粗脂肪含量(%)[21]。
1.4 数据处理与分析
试验数据采用SPSS 20.0统计软件进行单因素方差分析,差异显著者用Duncan氏法进行多重比较,以P<0.05作为差异显著性判断标准。瘤胃体外产气模型参数采用DPS V7.05软件中一元非线性回归模型(Gompertz模型)进行计算。采用Origin 2017软件进行绘图。计算公式[22]如下:
X2=C1×exp[-C2×exp(-C3×X1)]。
式中:X2为产气量(mL);C1为理论最大产气量(mL);C2为产气速率(mL/h);C3为产气延滞时间(h);X1为体外培养时间(h)。
2 结果与分析
2.1 植物乳杆菌对全株杂交构树青贮发酵品质及微生物数量的影响
由表1可知,发酵60 d时,LP和CK处理的pH和CP、WSC、NDF、ADF含量及酵母菌、霉菌、AB数量均显著低于青贮原料(P<0.05),NH3-N、Ash、LA、AA含量及LAB数量均显著高于青贮原料(P<0.05),DM、EE含量与青贮原料差异不显著(P>0.05)。发酵60 d时,LP处理的pH、ADF含量、AB数量显著低于CK处理(P<0.05),而LA含量、LAB数量显著高于CK处理(P<0.05),PA、BA在发酵结束时均未检测出。CK处理和LP处理之间NH3-N、DM、Ash、CP、WSC、NDF、AA含量及酵母菌、霉菌数量均差异不显著(P>0.05)。

表1 植物乳杆菌对杂交构树发酵品质及微生物数量情况的影响Table 1 Effects of Lactobacillus plantarum on fermentation quality and microbial quantity of whole-plant hybrid Broussonetia papyrifera silage
2.2 植物乳杆菌对全株杂交构树青贮产气量、有机物消化率、代谢能和产气模型参数的影响
如图2所示,随着体外产气时间的延长,各处理产气量逐渐升高,在48 h达到顶峰。在发酵的0~48 h,各处理在不同时间点的产气量均差异不显著(P>0.05)。
由表2可知,LP处理的OMD、产气速率显著高于青贮原料和CK处理(P<0.05);青贮原料、CK处理和LP处理之间理论最大产气量、产气延滞时间和ME均差异不显著(P>0.05)。各处理产气模型为:

表2 植物乳杆菌对杂交构树青贮有机物消化率、代谢能和产气模型参数的影响Table 2 Effects of Lactobacillus plantarum on OMD,ME and gas production model parameters of Broussonetia papyrifera silage
青贮原料,X2=72.01×exp[-1.08×exp(-0.18×X1)](F=329.89,P=0.001,R2=0.99);CK处理,X2=72.22×exp[-1.03×exp(-0.17×X1)](F=286.93,P=0.001,R2=0.98);LP处理,X2=72.44×exp[-1.11×exp(-0.16×X1)](F=343.69,P=0.001,R2=0.99)。
式中:X2为产气量(mL);X1为体外培养时间(h)。

数据点无标注表示差异不显著(P>0.05)。Value points with no label mean no significant difference (P>0.05).图2 各处理0~48 h体外产气规律Fig.2 Gas production in vitro of 0 to 48 h in each treatment
2.3 植物乳杆菌对开包后全株杂交构树青贮发酵品质和微生物数量的影响
由表3可知,LP和CK处理的pH、NH3-N含量及4类主要微生物(AB、LAB、酵母菌、霉菌)数量在开包后逐渐增加,AA、PA含量呈先上升后下降的趋势,仅LA含量随开包后时间的延长逐渐减少。其中,LP处理的pH在开包后第0、4、8、12天显著低于CK处理(P<0.05)。LP处理的LA含量在开包后第0天显著高于CK处理(P<0.05),AA含量在开包后第8天显著高于CK处理(P<0.05)。LP处理的LAB数量在开包后第0、8天显著高于CK处理(P<0.05),而AB数量则显著低于CK处理(P<0.05)。BA在开包后未检测出。CK处理和LP处理之间开包后NH3-N、PA含量和酵母菌、霉菌数量差异均不显著(P>0.05)。
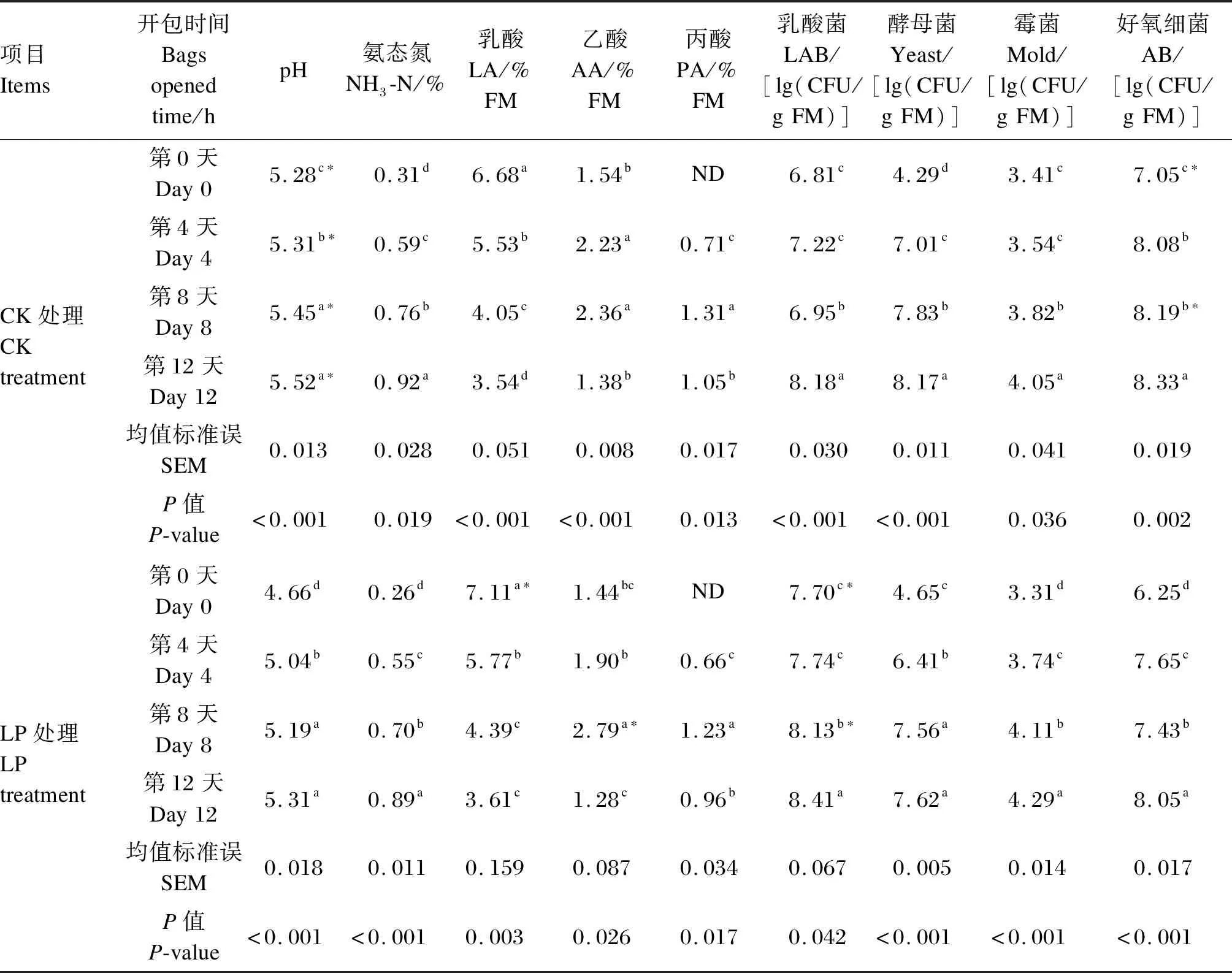
表3 植物乳杆菌对开包后杂交构树青贮发酵品质和微生物数量的影响Table 3 Effects of Lactobacillus plantarum on fermentation quality and microbial quantity of whole-plant hybrid Broussonetia papyrifera silage after bags opened
3 讨 论
3.1 植物乳杆菌对杂交构树青贮发酵品质和微生物数量的影响
青贮饲料干物质的损失始于细胞的呼吸作用,需氧微生物利用碳水化合物产生水、热量和二氧化碳,破坏分解养分[14]。本研究中,接种低剂量植物乳杆菌未显著影响发酵底物干物质含量,即一定程度减少了发酵底物营养物质损失。青贮饲料中CP含量的变化与pH高低密切相关[23]。本研究开包时LP处理pH显著低于CK处理,但CK处理和LP处理之间CP和NH3-N含量均无显著差异,这与以往研究结果[13]相同,表明接种植物乳杆菌未显著影响发酵体系蛋白质的腐败。LP和CK处理的CP和NH3-N含量较初始发酵时有显著变化,其原因可能由于梭菌(Clostridiumspp.)未被完全抑制,导致蛋白质分解所致[6]。另外,本研究LP和CK处理的WSC含量较初始发酵时显著下降,其主要原因为青贮体系微生物对底物糖类物质的利用所致[4];LA、AA含量较初始发酵时显著上升,这说明杂交构树表面附着乳酸菌可基本满足厌氧发酵条件;而LP处理的LA含量显著高于CK处理,且CK处理和LP处理之间WSC含量差异不显著,这说明青贮中被消耗的WSC主要被植物乳杆菌等同型发酵乳酸菌用以产生LA[24],且低剂量的植物乳杆菌接种可消耗更少WSC产生LA。
以往研究表明,添加剂对青贮NDF和ADF含量均有不同程度改善效果[25-26],主要由于大多数添加剂如LAB、纤维素酶、糖蜜等不仅能为饲料中的微生物提供底物,同时能加速其利用底物,能快速产生丰富的具有溶解纤维活性的微生物酶,降解植物中NDF和ADF[27]。这与本研究的结果一致。本研究中,LP和CK处理的NDF和ADF含量较初始发酵时显著降低,LP处理的ADF含量显著低于CK处理,说明接种低剂量植物乳杆菌即可显著降低ADF含量。EE、Ash含量较发酵前有所升高,原因可能是由于水分、营养物质等的损失,造成青贮底物总质量下降,使得这些成分的比例有略微升高。此外,发酵60 d时,酵母菌、霉菌、AB数量均较初始发酵时显著降低,仅LAB数量显著升高,且LP处理的LAB数量显著高于CK处理,这说明低剂量植物乳杆菌的接种即可达到提高发酵体系LAB数量的目的,以促使LA和AA的生成,迅速形成酸性环境和厌氧环境,抑制好氧致腐微生物的生长繁殖[11]。发酵结束时未检测到PA与BA,这是由于发酵底物充足,LAB占主导地位形成了较低pH环境抑制了有害微生物的增殖[28],同时也可能与构树本身具有黄酮类物质,而黄酮类物质具有抑菌作用有关[29]。
3.2 植物乳杆菌对杂交构树青贮瘤胃体外产气特性的影响
瘤胃体外产气法可有效地通过饲料降解过程中的产气量较准确地评价饲料在动物体内的消化率,是反映青贮饲用价值的重要体现[11,18]。本研究中接种低剂量植物乳杆菌即能使得OMD显著提高;此外,LP处理的产气速率显著高于CK处理,这说明植物乳杆菌的接种有助于加速瘤胃微生物的活动,从而改善消化能力,在泌乳奶牛生产中也得到相似结论[6]。饲料在瘤胃体中发酵时产气的来源主要是有机物中的CP、EE、NDF、WSC等,这些物质在瘤胃中被分解代谢从而产生CO2、CH4等气体后引起反应空间的体积变化[30]。全株杂交构树CP、EE、NDF含量均较高,WSC含量低,因此在本研究中,随着发酵时间的延长,各处理产气量逐渐增加,这与部分学者的研究结果[31-32]相一致,主要反映出发酵底物中营养物质的消化和瘤胃微生物代谢情况。
3.3 植物乳杆菌对开包后全株杂交构树青贮发酵品质和微生物数量的影响
有氧暴露后,pH的增加是衡量青贮饲料是否变质的一个重要指标[33]。本研究中pH在发酵结束和开包过程中始终未降到优质青贮的标准(pH<4.4),其原因主要由于青贮体系含水量和缓冲能高[14]。此外,本研究中所有处理的pH均随开包时间的延长逐渐增加,而接种低剂量植物乳杆菌可维持pH在较低水平,这与前人研究结果[34-35]类似,主要由于植物乳杆菌在发酵过程中产生较多LA,开包后虽然有所损失,但仍可以维持较低pH环境[36];此外,可能由于植物乳杆菌的接种促进了开包后异型发酵乳酸菌产AA的含量。有氧暴露后,使得NH3-N含量有所增加,主要由于pH升高,不良微生物开始活动,氨基酸被分解成氨、硫化氢和胺类,降解率增大[37],而接种低剂量的植物乳杆菌可减少NH3-N的产生,这与以往研究结果[33,38]一致。青贮中有机酸含量的变化反映碳水化合物的转化情况。本研究中LA含量随开包时间的延长逐渐减少,而AA含量随开包时间的延长呈现先上升后下降的趋势,其原因可能是在有氧暴露期间LA易被酵母菌利用,导致青贮的二次发酵;另外,青贮本身附着的异型发酵乳酸菌分解LA产生AA,在一定程度上维持杂交构树青贮中低pH水平[39]。有氧暴露后,无论是否添加植物乳杆菌,发酵体系的PA含量逐渐增加,其原因可能为有氧环境使好氧微生物的活动性增强,其利用青贮发酵底物产生水、CO2和热量[40],从而产生少量PA。
青贮发酵过程中乳酸菌起主导作用。本研究发现杂交构树青贮中接种低剂量的植物乳杆菌有助于增加开包过程中LAB数量,维持其继续利用底物进行生长繁殖,而有氧环境使得LAB生长速度减缓,这与以往研究结果[24]。相同。由于植物乳杆菌产生的能够抑制酵母菌、霉菌等生长繁殖的短链脂肪酸的数量非常少,导致开包后酵母菌、霉菌的数量逐渐增加,这与以往研究结果[41]相同,其也认为好氧微生物数量的增长主要由于LA源为同化型酵母菌提供了生长繁殖所需的底物。开包过程中,无论植物乳杆菌添加与否,AB数量都有不同程度的增加,主要由于pH的升高为好氧微生物创造了有利的环境,同时好氧微生物直接接触青贮底物,造成青贮营养成分的进一步损失[24]。
4 结 论
在实际裹包作业中接种1×105CFU/g植物乳杆菌可提高全株杂交构树青贮发酵中乳酸菌数量和乳酸含量,降低pH,抑制好氧细菌增殖,从而利于青贮营养物质的有效保存;且可通过促进开包8 d内乳酸菌的生长和乙酸的生成,以维持酸性环境,减少好氧细菌生长,延缓二次发酵;同时可显著降低酸性洗涤纤维含量,提高有机物消化率。
