嵌合抗原受体T淋巴细胞治疗多发性骨髓瘤疗效及安全性的Meta分析
2021-12-08王腾王晓晨吕纯懿王金鑫徐瑞荣
王腾,王晓晨,吕纯懿,王金鑫,徐瑞荣
多发性骨髓瘤(MM)是一种来源于B淋巴细胞后生发中心的浆细胞单克隆增殖性肿瘤,其特点是骨髓微环境中浆细胞恶性增殖,血液、尿液中出现蛋白单克隆,以及靶器官功能损害。MM约占恶性肿瘤的1%,占血液系统肿瘤的13%。其在西方国家的发病率约5.6/10万,发病率因国家、人种不同而有较大差异[1]。在我国尚缺乏大范围流行病学调查资料,但有发病年轻化及发病率逐年上升的趋势[2-3]。目前MM无法治愈,虽然蛋白酶体抑制剂(Pi)、免疫调节剂(IMiD)、单克隆抗体以及自体造血干细胞移植(ASCT)等治疗方式的应用使患者生存期得以延长[4],但仍然面临骨髓瘤复发及难治的问题,亟待寻找新的治疗方法。嵌合型抗原受体T淋巴细胞(CAR-T)是一种发展迅速的新型细胞免疫疗法,嵌合抗原受体(CAR)是一种基因修饰的跨膜蛋白,包含胞外结构域、跨膜结构域和胞内结构域三部分[5],第二代CAR结构如图1所示。CAR-T的机制是将CAR转染至T淋巴细胞并诱导其在细胞表面表达,使T淋巴细胞具有靶向识别抗原、杀伤肿瘤细胞的作用。相关研究肯定了分化抗原19(CD19)CAR-T在淋巴瘤、白血病等B细胞恶性肿瘤治疗中的疗效[6-7]。CD138、自然杀伤细胞表面活化性受体D(NKG2D)、信号淋巴细胞激活分子家族成员7(SLAMF7)、CD38、B淋巴细胞成熟抗原(BCMA)等多种CAR-T抗原的开发,以及相关临床试验的陆续开展,也显示出CAR-T在MM治疗中的潜力[8]。但临床研究报道CAR-T治疗过程中不良事件(AEs)及细胞因子释放综合征发生率较高[9]。AEs是指在疾病治疗过程中出现的可能与使用药物或治疗相关的任何异常的实验室指标、症状或一过性疾病,如发热、恶心、转氨酶升高、血细胞计数减少等。AEs评级≥3级即为严重AEs,可引起严重症状、致残甚至致死[10]。细胞因子释放综合征(CRS)是CAR-T治疗最常见的毒副作用,其通常是一种免疫药物治疗引发的全身炎性反应,发病与白介素、干扰素等多种细胞因子升高有关。CRS的临床表现异质性较大,最常见的症状包括发热、皮疹、低血压、心动过速、呼吸窘迫、癫痫和器官功能衰竭等,严重者可致死[11-12]。CAR-T治疗另一严重毒副作用为神经毒性,通常表现中毒性脑病,伴有谵妄、精神错乱或脑水肿,然而这些安全风险在治疗中大多是可控的[13-14]。加强安全监测管理对CAR-T在临床广泛应用至关重要。
本文对已公开发表的CAR-T治疗MM的临床研究分别进行总反应率、严重AEs发生率(≥3级)、CRS发生率的Meta分析,讨论其疗效及安全性,为CAR-T安全高效治疗MM提供循证医学证据。
1 资料与方法
1.1 文献检索策略 计算机检索PubMed、EMBase与The Cochrane Library数据库中所有的英文文献,检索时限自建库至2019年11月,以PubMed数据库为例,采用主题词和自由词结合检索(见图2)。手工对检索出文献的参考文献进行二次检索。

图1 第二代CAR结构示意图Figure 1 Schematic structure of second generation of CAR

图2 PubMed数据库检索策略Figure 2 Search strategy of the PubMed database
1.2 文献纳入与排除标准 纳入标准:(1)研究对象为明确诊断为初治或复发性难治性MM的患者;(2)CAR-T治疗过程中出现严重AEs、CRS的患者;(3)研究类型为CAR-T治疗MM的临床试验;(4)干预措施为CAR-T;(5)结局指标为总反应率、严重AEs发生率以及CRS发生率,其中总反应率为完全缓解(CR)和部分缓解(PR)患者占比之和。排除标准:(1)非英文文献;(2)动物实验、综述或病例报道;(3)重复发表的研究;(4)没有提供诸如预处理方案、严重AEs及CRS发生例数、CAR-T治疗后疗效评价等必要信息的研究;(5)纳入患者<10例的研究。
1.3 文献筛选、资料提取与质量评价 由两名研究人员根据文献纳入与排除标准筛选符合要求的文献,独立筛选、提取数据并进行数据核对、质量评价,若有异议,则与相关专家讨论解决,缺乏的资料尽量与作者联系予以补充。文献筛选时首先阅读文题和摘要,在排除明显不相关的文献后,进一步阅读全文,以确定最终是否纳入。提取数据的内容包括第一作者、发表时间、样本量、性别、中位年龄、抗原类型、共刺激分子、预处理方案、中位细胞输注数、中位无进展生存期(PFS)、结局指标、质量评价等信息。结局指标包括:总反应率、CRS发生率、AEs发生率。质量评价采用The Newcastle-Ottawa量表(NOS)评价纳入研究的偏倚风险。最后整理并汇总数据。
1.4 统计学方法 数据处理均使用R软件(version 3.6.1)完成。以Log转换法进行数据转换并检验正态性后,采用I2检验和Q检验验证文献异质性,当I2<50%,且Q检验P>0.1时,异质性较低,可选用固定效应模型,否则选用随机效应模型[15]。按照预处理方案、共刺激分子、CAR-T抗原类型分组进行亚组分析及Meta回归分析,进一步探讨影响CAR-T疗效与安全性的因素。亚组分析与Meta回归分析各组间异质性大小不一,均采用随机效应模型进行率的合并。以P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 经关键词检索共获得相关文献871篇,初步筛选后获得文献44篇,阅读全文筛选后,最终纳入8篇文献[16-23],共191例患者。文献筛选流程及结果见图3,文献基本特征及质量评价情况见表1。
2.2 Meta分析结果
2.2.1 主要结局指标 CAR-T治疗MM的总反应率为0.88〔95%CI(0.83,0.93)〕(见图4);严重AEs发生率为0.90〔95%CI(0.83,0.98)〕(见图5);CRS发生率为0.92〔95%CI(0.85,1.00)〕(见图6)。

表1 纳入文献的基本特征Table 1 Basic characteristics of included literature
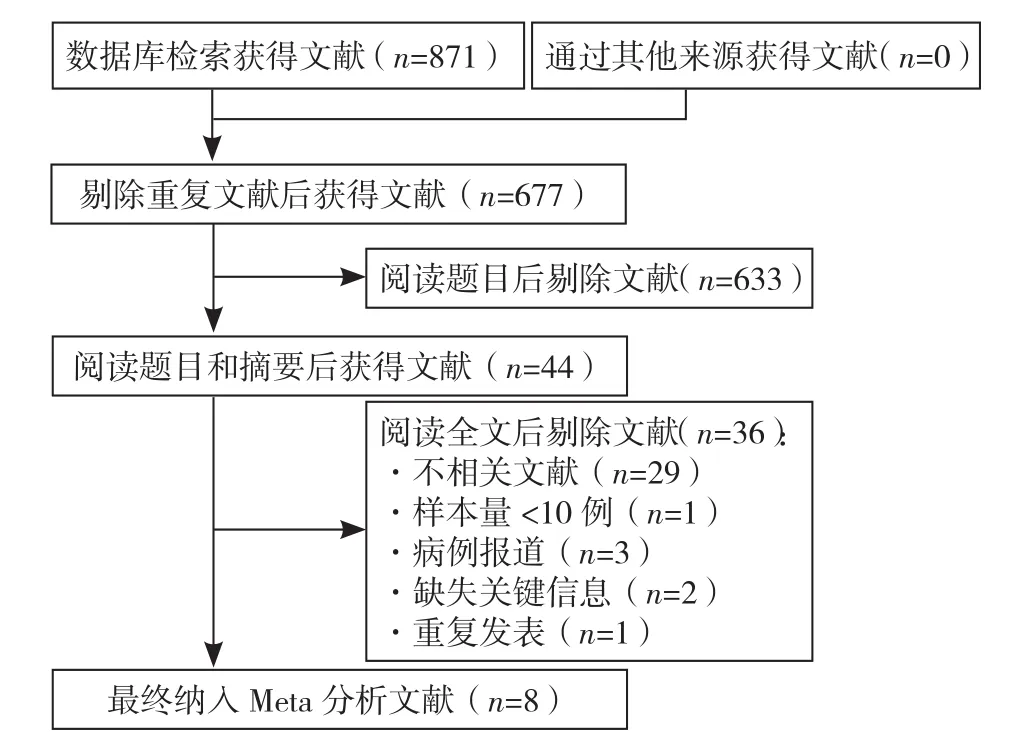
图3 文献筛选流程图Figure 3 The flow diagram of literature screening

图4 CAR-T治疗MM患者总反应率的森林图Figure 4 Forest plot of the overall response rate of MM patients treated with CAR-T

图5 CAR-T治疗MM患者严重不良事件发生率的森林图Figure 5 Forest plot of the incidence of severe adverse events of MM patients treated with CAR-T

图6 CAR-T治疗MM患者细胞因子释放综合征发生率的森林图Figure 6 Forest plot of the incidence of cytokine release syndrome of MM patients treated with CAR-T
2.2.2 亚组分析 采取随机效应模型对各影响因素分别进行Meta回归分析,结果显示,不同共刺激分子MM患者总反应率、严重AEs发生率比较,差异均有统计学意义(P<0.05);不同抗原类型MM患者总反应率、严重AEs发生率比较,差异均有统计学意义(P<0.05);不同共刺激分子、抗原类型MM患者CRS发生率比较,差异均无统计学意义(P>0.05)。
2.2.2.1 基于预处理方案的亚组分析 按照预处理方案的不同分为Flu+Cy、Cy、HDM+ASCT、无预处理4组进行分析,结果显示,不同预处理方案MM患者总反应率比较,差异均无统计学意义(P=0.062 2);不同预处理方案MM患者严重AEs发生率、CRS发生率比较,差异均有统计学意义(P=0.013,P<0.001);其中,Flu+Cy组、Cy组、无处理组严重AEs发生率、CRS发生率高于HDM+ASCT组,差异均有统计学意义(P<0.05,见表2)。
2.2.2.2 基于共刺激分子的亚组分析 按照共刺激分子分为4-1BB、CD28 两组进行分析,结果显示,共刺激分子4-1BB组总反应率高于CD28组,严重AEs发生率低于CD28组,差异均有统计学意义(P=0.001、0.004);不同共刺激分子MM患者CRS发生率比较,差异均无统计学意义(P=0.134,见表2)。
2.2.2.3 基于CAR-T抗原类型的亚组分析 按照CAR-T抗原类型分为 BCMA、LCAR-B38M、CD19、BCMA+CD19 4组进行分析,结果显示:不同抗原类型MM患者总反应率、严重AEs发生率、CRS发生率比较,差异均有统计学意义(P=0.004、0.049、0.023);其中,BCMA组总反应率低于LCAR-B38M组、BCMA+CD19组,严重AEs发生率、CRS发生率高于CD19组,差异均有统计学意义(P<0.05);LCAR-B38M组、BCMA+CD19组严重AEs发生率、CRS发生率高于CD19组,差异均有统计学意义(P<0.05,见表2)。亚组分析的异质性见表3。
2.3 发表偏倚 应用Egger's法检测文献的发表偏倚,结果显示,各Meta分析间均存在一定的发表偏倚。为探讨发表偏倚对Meta分析结果的影响,进一步采用剪补法对结果进行检验,提示发表偏倚对Meta分析结果影响不显著,不会对结论产生严重干扰(见表4)。

表3 亚组分析的异质性Table 3 The heterogeneity test of subgroup analyses

表2 亚组分析结果Table 2 Results of subgroup analyses
3 讨论
CAR-T目前已经发展到第四代,第一代CAR由单链可变抗体片段、CD8跨膜结构域、CD3ζ胞内激活域构成,第二代CAR在上代基础上增加了胞内共刺激分子,第三代CAR有多种共刺激分子,第四代CAR可释放如白介素12(IL-12)等转基因产物,从而增强肿瘤杀伤作用[24-26],本文纳入的研究均采用了第二代CAR设计。CAR-T在MM治疗中潜力巨大,但据报道患者在治疗过程中的严重AEs与CRS发生率高,可有发热、神经毒性、全血细胞减少、器官衰竭等毒副作用,安全问题在CAR-T治疗MM中不容忽视[27]。
本文纳入8个单臂临床试验,共191例患者。Meta分析结果显示,CAR-T治疗MM总反应率达88%,具有较好的临床疗效。CAR-T治疗MM严重AEs发生率和CRS发生率分别为90%与92%。疗效方面,共刺激分子与CAR-T抗原类型是主要影响因素;预处理方案、共刺激分子、CAR-T抗原类型均明显影响严重AEs发生,对CRS发生影响较小。预处理方案为Flu+Cy一组疗效稍好,但安全风险较高;共刺激分子为4-1BB组疗效与安全性优于CD28组;CAR-T抗原类型为LCAR-B38M组疗效与安全性优于BCMA组。
共刺激分子可协同T淋巴细胞活化与增殖分化从而发挥免疫作用,CD28共刺激分子能产生强刺激信号,可迅速诱导T淋巴细胞活化,并分化出效应记忆表型;而4-1BB诱导活化T淋巴细胞过程相对缓慢且刺激强度更低,可分化产生大量效应T淋巴细胞与中枢记忆T淋巴细胞[28]。CD28对T淋巴细胞产生过度刺激,可能增加CRS的发生率,并使T淋巴细胞衰竭加快,体内扩增减少,降低抗肿瘤效应[29]。此外,BRUDN等[21]研究发现CAR-T在体内的扩增量大时治疗反应相对较好。上述可能为共刺激分子4-1BB组在疗效与安全性方面优于CD28组的原因。

表4 发表偏倚检验与剪补法检验结果Table 4 The results of publication bias test and trim-and-fill test
BCMA又名TNF配体超家族成员17,在MM细胞系中选择性表达,并在MM恶性B淋巴细胞增殖分化中发挥重要作用,是理想的抗原靶点[30]。但MM表型异质性大,同一患者体内可能存在多种亚克隆表型,易逃逸单一抗原治疗[31],LCARB38M是一种双BCMA表位的CAR-T细胞,与单BCMA表位CAR-T(如bb2121)相比,LCAR-B38M与靶点亲和力更高,单位剂量的疗效更强,或可减少单一抗原的免疫逃逸机制[17]。YAN等[16]研究发现CD19+BCMA多抗原CAR在MM治疗中表现出较好的疗效,但其确切效果仍需后续验证。此外,在按CAR-T输注剂量递增分组的单表位BCMA的研究中,输注剂量与疗效呈正相关,同时高剂量CAR-T输注提高了免疫原性,使安全风险相应增加[19,21]。在应用双表位LCAR-B38M的研究中,未设计剂量递增分组,细胞输注平均剂量虽远低于前者,但疗效与安全性较前者更佳[17,20]。低输注剂量很可能降低了LCAR-B38M组安全风险,因纳入研究设计不均一,细胞输注剂量差异对不同靶点CAR-T的疗效与安全性影响尚待更多临床试验验证。
CRS与AEs发生除与CAR-T输注剂量相关外,研究表明,其与血清IL-6、C反应蛋白(CRP)、肿瘤坏死因子α(TNF-α)等免疫因子水平升高也密切相关,临床常应用预防性治疗及类固醇激素与抗IL-6受体单克隆抗体(Tocilizumab,托珠单抗)免疫抑制治疗[11-12]。另外,BRUDNO等[21]研究提示高肿瘤负荷会导致患者CRS发生概率增加,GARFALL等[18]研究发现提前接受ASCT可减少CAR-T输注后自身免疫反应,同时降低肿瘤负荷,对控制CRS与AEs发生有积极意义。
本研究局限性:(1)CAR-T作为一种新兴疗法,缺少大样本、多中心、随机对照试验,同时所纳入文献质量一般,可能会影响结果的客观性;(2)所纳入研究之间疾病分型、分期、肿瘤负荷等因素不甚相同,无法进行定量分析;(3)本文所纳入的研究结果均为阳性,不排除有未公开发表的阴性试验结果;(4)纳入的部分研究未报道长期随访数据,生存资料不全,无法统一进行生存分析。
综上所述,CAR-T作为一种具有巨大潜力的新型免疫治疗策略,在MM治疗中的疗效显著,但是安全性有待进一步提高。本研究发现,预处理方案、共刺激分子类型、CAR-T抗原类型均是影响其疗效及安全性的因素。改进CAR结构、制备多靶点CAR-T、增加CAR-T共刺激分子、增加CAR-T细胞体内扩增数和持久性、优化预处理方案,将成为CAR-T治疗MM的进一步研究内容。相信随着研究深入,CAR-T治疗MM的疗效将更加可靠,毒副作用的发生也更加可防可控。
作者贡献:王腾、徐瑞荣进行文章的构思与设计,研究的实施与可行性分析;王腾、王晓晨、吕纯懿进行数据收集;王晓晨、吕纯懿、王金鑫进行数据整理;王腾、王金鑫进行统计学处理;王腾、王晓晨进行结果的分析与解释;王腾撰写论文;王腾、吕纯懿进行论文的修订;徐瑞荣对文章整体负责,监督管理。
本文无利益冲突。
