IL-2、IL-12、IL-13、MIP-1与急性冠脉综合征痰瘀互结证的相关性研究❋
2021-12-08潘秋霞胡镜清
潘秋霞,胡镜清
(1.战略支援部队特色医学中心,北京 100101;2.中国中医科学院中医基础理论研究所,北京 100700)
以超敏C-反应蛋白(high sensitivity C-reactive protein,hs-CRP)异常为主的炎症反应,谷氨酰转肽酶(glutamyl transpeptidase,GCT)水平升高的氧化应激反应,血小板(platelet,PLT)升高的凝血状态,糖代谢异常,构成了冠心病痰瘀互结证患者的主要病理变化[1-5]。有学者认为,炎症反应是急性冠脉综合征(acute coronary syndrome,ACS)痰瘀互结证的重要病理改变之一[6],其中基质金属蛋白酶(matrix metalloproteinase,MMP)8、MMP-9/MMPs组织抑制物3可能发挥了关键作用[7]。柏冬等[8]通过文献梳理发现,有13个炎症相关指标可能与ACS痰瘀互结证相关,包括①CRP、hs-CRP;②同型半胱氨酸(homocysteine,Hcy);③细胞因子,如肿瘤坏死因子(tumor necrosis factor,TNF-α)、白介素6(IL-6)、IL-18、MMPS、单核细胞趋化蛋白1(monocyte chemoattractant protein,MCP-1)、巨噬细胞集落刺激因子;④免疫细胞膜分子,如细胞间黏附分子1、分化抗原与分化抗原40配体、P选择素与P选择素糖蛋白配体1;⑤脂蛋白(Apo A-Ⅰ、α1-AT)。
为阐明炎性细胞因子在ACS痰瘀互结证患者外周血中的特异性表达,本研究对ACS痰瘀互结证患者外周血中11个炎性相关细胞因子的含量进行检测。
1 对象
所有志愿者的基本资料和来源于2015~2018年间胡镜清研究员团队973项目所收集的ACS志愿者和健康志愿者。ACS志愿者分为痰瘀互结证组和非痰瘀互结证组,健康志愿者均纳入健康对照组。
1.1 诊断标准
ACS痰瘀互结证诊断与积分计算标准:采用“痰湿证+血瘀证”组合形式的《冠心病痰瘀互结证宏观诊断标准》[9]进行痰瘀互结辨证诊断及量化积分计算。痰湿或血瘀累计赋分≥6分者则痰湿证或血瘀证成立,同时达到痰湿证、血瘀证诊断阈值时可诊断为痰瘀互结证。为保证纳入样本的高质量及代表性,所有入组病例均为在连续3次随访中无证候演变及转化的患者。
1.2 纳入标准
ACS的纳入标准:患者年龄35~85岁;符合WHO急性冠脉综合征诊断标准;西医诊断为不稳定心绞痛或非ST段抬高型心肌梗死患者;签署知情同意书并自愿参加本研究者;预计1年内能坚持随访。健康受试者纳入标准:受试者年龄35~85岁;体检健康且中医体质测评被判定为阴阳平和体质志愿者;签署知情同意书并自愿参加本研究者。
1.3 排除标准
急性冠脉综合征患者排除标准:近1个月内感染、发热、创伤、烧伤、手术史;活动性结核病或风湿免疫疾病患者;重度心律失常(快速房颤、房扑、阵发性室速等)伴血流动力学改变者;慢性心力衰竭阶段C患者(阶段C指临床心衰阶段,患者已有基础的结构性心脏病,以往或目前有气短、乏力、运动耐量下降等心衰的症状或体征);心脏瓣膜(1个瓣膜及以上发生中度病变)或原发性心肌病;合并脑血管病急性期或亚急性期的患者;胃肠道手术或器质性疾病病史;慢性阻塞性肺疾病急性加重期或肺心病或呼吸衰竭患者;已知的肾功能不全,血清肌酐(creatinine,Cr)男性>221 μmol/L,女性>177 μmol/L者;已知肝功能不全者,丙氨酸转氨酶(alanine aminotransferase,ALT)大于正常值3倍或合并肝硬化者;合并造血系统或恶性肿瘤等严重原发性疾病;脏器移植患者;严重的精神障碍患者(感知障碍、思维障碍);孕妇、哺乳期妇女;研究者认为存在不适合参加该试验其他情况。
健康志愿者排除标准:近1个月内感染、发热、创伤、烧伤、手术史;活动性结核病或风湿免疫疾病患者;脑血管病患者;心脏瓣膜(1个瓣膜及以上发生中度病变)或原发性心肌病;慢性阻塞性肺疾病急性加重期或肺心病或呼吸衰竭患者;已知肾功能不全,Cr男性>221 μmol/L,女性>177 μmol/L者;已知肝功能不全者,ALT大于正常值的3倍或合并肝硬化者;合并造血系统或恶性肿瘤等严重原发性疾病;脏器移植患者;严重的精神障碍患者(感知障碍、思维障碍);孕妇、哺乳期妇女;研究者认为存在不适合参加该试验的其他情况。
2 方法
2.1 样本收集
血液样本均为志愿者上午7~9时的空腹静脉血(志愿者均被告知采血前24 h内避免运动、饮酒,饮食习惯和睡眠习惯改变)2~5 mL,离心后分类冻存于-80 ℃。
2.2 样本检测
所选血清样品于4 ℃水浴解冻和离心待检,抗体选用Merck公司生产的MILLIPLEX抗体。采用悬液芯片检测仪及Luminex200TM检测及分析结果,具体操作按试剂盒说明书进行。
2.3 统计学方法

3 结果
表1示,本研究应用的证候数据均来自于课题组前期的流行病学调查资料。经过两轮数据清洗和严格的信息筛选,纳入质量合格的血清样本。本研究中,共纳入ACS痰瘀互结证患者10例,ACS非痰瘀互结证患者13例,健康志愿者12人。各组患者的年龄、性别、身体质量指数(BMI)等情况比较差异无统计学意义。

表1 各组一般情况比较
3.1 血清IL-2、IL-12、IL-13、IL-17、MIP-1水平检测结果
表2示,与健康对照组比较,在痰瘀互结证患者外周血中IL-2、IL-12、IL-13、IL-17水平显著升高(P<0.01,P<0.01,P<0.01,P<0.05),且痰瘀互结证组患者外周血中IL-2、IL-12、IL-13、IL-17含量也明显高于非痰非瘀证组(P<0.01,P<0.01,P<0.05,P<0.01)。与健康对照组比较,巨噬细胞炎性蛋白-1(MP-1)在痰瘀互结证组的含量明显升高(P<0.05),非痰瘀互结证组MIP-1含量明显降低(P<0.05),且痰瘀互结证组的MIP-1水平显著高于非痰瘀互结证组(P<0.01)。
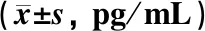
表2 3组血清IL-13、IL-12、IL-2、IL-17、MIP-1水平比较
3.2 血清IL-1β、IL-37水平检测结果
表3示,与健康对照组和痰瘀互结证组比较,非痰瘀互结证组IL-1β含量显著低(P<0.01,P<0.01);健康对照组和痰瘀互结证组IL-1β含量比较差异无统计学意义。痰瘀互结证组的IL-37水平显著低于非痰非瘀证组(P<0.01),但痰瘀互结证组IL-37的含量与健康对照组比较差异无统计学意义。
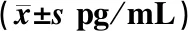
表3 3组血清IL-1β、IL-37水平比较
3.3 血清CCL5、IL-18、IL-8、MCP-1水平检测结果
表4示,与健康对照组比较,痰瘀互结证组和非痰瘀互结证组CCL5的含量均显著降低(P<0.01,P<0.01),但痰瘀互结证组和非痰瘀互结证组CCL5含量比较差异无统计学意义。与健康对照组比较,痰瘀互结证组和非痰瘀互结证组IL-18含量均明显升高(P<0.01,P<0.05),但痰瘀互结证组和非痰瘀互结证组IL-18含量比较差异无统计学意义,外周血中IL-8、MCP-1的含量在各组间比较差异无统计学意义。
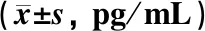
表4 3组血清CCL5、IL-18、IL-8、MCP-1水平比较
4 讨论
炎症反应是冠心病的关键病理基础之一。而炎性细胞因子聚集所形成的“炎性负荷”是ACS患者发生斑块破裂、造成不良心血管结局的主要原因之一[10-13]。痰瘀互结证是ACS的主要证候之一。既往研究认为,与机体炎症反应密切相关的hs-CRP在痰瘀互结证患者外周血表达明显升高[14]。因此,挖掘痰瘀互结证患者的外周血中差异表达的炎性细胞因子,对今后ACS痰瘀互结证的潜在分子标志物研究与临床辨证用药具有重要的参考价值。
IL-2、IL-12、MIP-1都是促炎性的细胞因子。IL-2、IL-12、MIP-1在ACS痰瘀互结证患者外周血清中含量明显高于健康对照组和非痰瘀互结证组。IL-2能刺激自然杀伤(natural killer,NK)细胞的增殖和杀伤活性,诱导淋巴因子激活的杀伤细胞(lympholine activated killer cell,LAK细胞)产生,并能促进B细胞增殖和分泌抗体、激活巨噬细胞[15]。IL-12能诱导T细胞产生干扰素-g(IFN-g),促进Th0细胞向Th1细胞分化,也可以诱导促进IFN-γ、肿瘤坏死因子α(TNF-α)、粒细胞-巨噬细胞集落刺激因子(GC-SF)、IL-2Rα等产生[16],还能协同IL-2促进细胞毒性T淋巴细胞和LAK细胞的产生,与冠心病的病情程度关系密切[17-19]。MIP-1能激活粒细胞,诱导NK细胞增殖与活化,发挥趋化和促进炎症的生物学作用,还与冠状动脉粥样硬化斑块病变严重程度及斑块稳定性明显相关[20-23]。IL-2、IL-12、MIP-1的表达增加,意味着ACS痰瘀互结证患者体内巨噬细胞、单核细胞、中性粒细胞参与形成的“炎性负荷”加重,而且IL-2、IL-12、MIP-1表达增加与ACS痰瘀互结证密切相关。
IL-13在ACS痰瘀互结证患者外周血清中的含量明显高于健康对照组和非痰瘀互结证组。IL-13是一种抑炎性细胞因子,能诱导B细胞增殖及合成IgE类抗体,增强B细胞表面MHCⅡ类分子、CD23及CD72的表达,协同IL-2刺激NK细胞产生IFN,从而促进单核-巨噬细胞活化和Th1型细胞免疫反应[24,25]。我们推测,IL-13的高表达可能为机体“炎性负荷”加重的负反馈,IL-13的表达也与ACS痰瘀互结证关系密切。
IL-17的含量在ACS痰瘀互结证患者外周血清中的含量明显高于健康对照组和非痰瘀互结证组。IL-17是Th17细胞诱导炎症反应的早期启动因子,通过促进释放促炎性细胞因子以放大炎症反应;IL-17与受体结合后,可通过MAP激酶途径和核因子κB(NF-κB)途径,介导中性粒细胞动员的兴奋过程[26,27],导致炎症的产生[28,29]。但诸多研究表明,IL-17的高表达与血瘀证的发生关系密切,且活血化瘀药物能明显降低关节液中IL-17的含量[30-33]。因此我们推测,IL-17的表达可能与痰瘀互结证或血瘀证中的“瘀”关系更为密切。
CCL5和IL-8均为促炎性的细胞因子。与健康对照组比较,痰瘀互结证组和非痰瘀互结证组中CCL5的表达均显著降低,IL-18的表达均明显升高;但CCL5和IL-18含量在瘀互结证组与非痰瘀互结证组比较差异无统计学意义。目前尚未发现,CCL5和IL-18与ACS痰瘀互结证有明显的相关性,我们推测CCL5的低表达和IL-18的高表达可能只与ACS疾病本身相关。
综上所述,炎症反应是ACS痰瘀互结证的重要病理改变。高表达的IL-12、IL-2、MIP-1、IL-13与ACS痰瘀互结证密切相关,IL-17的高表达可能与痰瘀互结证或血瘀证中的“瘀”关系更为密切。
