HPV 在口咽鳞癌的临床意义
2021-12-08冯恩梓王登欢杨兴宇吴锡芳
冯恩梓,王登欢,张 冉,杨兴宇,张 楠,杨 洁,吴锡芳
(昆明医科大学第三附属医院头颈外科,云南 昆明 650118)
口咽癌为发生在舌根、扁桃体、软腭及咽后壁部位的恶性肿瘤。据Globocan 统计[1],2018 年全球口咽癌新增92887 例,主要集中于亚洲与欧洲,占总发病人数的71.8%。近10 a 我国口咽癌发病率及死亡率均呈现上升趋势。口咽鳞癌的病因主要与烟草及酒精有关,而近年发现HPV 感染也与口咽鳞癌的发病有着密切联系,后者具有其特殊的临床特征。不同地域口咽鳞癌的HPV 感染情况不同。目前,我国尚无较大规模研究统计口咽鳞癌相关HPV 感染率,现有小样本研究发现感染率在16.7%~50%[2−9]。因此笔者选择2010 年1 月至2019 年12 月在云南省肿瘤医院进行诊治并符合入组标准的129 例口咽鳞癌患者作为研究对象,收集详细临床资料及病理标本进行研究。从临床病理特征方面进行回顾性分析。
1 资料与方法
1.1 研究对象
本研究选择2010 年1 月至2019 年12 月在云南省肿瘤医院进行诊治并符合入组标准[10]的129例口咽鳞癌患者作为研究对象,收集详细临床资料及病理标本进行研究。收集资料包括:年龄、性别、吸烟/饮酒史、首发症状、病理学分化、TNM 临床分期、治疗方案及其效果。
研究对象入组标准为:(1)病理类型确诊为鳞状细胞癌;(2)原发灶为舌根、软腭、扁桃体及口咽侧壁及后壁;(3)为初治病例,未接受过放化疗;(4)有完整的临床资料且在昆明医科大学第三附属医院病理科存档,具有完整的临床资料且在云南省肿瘤医院病理科存档具有一定质量的标本以供分析;(5)无同期其他原发癌及远处转移。本研究已通过云南省肿瘤医院伦理委员会审核。
1.2 HPV 检测方法及判定
HPV16/18 型DNA 探针(小鼠抗地高辛抗体聚合物法)、HPV 6/11 型DNA 探针(小鼠抗地高辛抗体聚合物法),以上均购自北京中杉金桥公司;孵育盒、恒温箱、杂交仪、移液器、计时器、染色缸、洗瓶。由病理科主治以上医师对染色后切片进行观察判断。HPV DNA 阳性:至少有一个细胞核见黄色、棕黄色或棕褐色着色,且细胞质和细胞膜无着色(当核分裂时可以出现细胞质着色);HPV DNA 阴性:细胞中未见棕黄色着色。
1.3 统计学处理
本研究采用SPSS 24.0 统计软件进行数据分析。计数资料采用卡方检验或Fisher 精确概率法进行比较,P<0.05 为差异具有统计学意义。
2 结果
2.1 临床资料
共收集口咽鳞癌患者298 例,符合入组标准的口咽鳞癌患者129 例,男性114 例,女性15 例,男女比例7.6∶1。具体临床资料见表1。本组患者治疗方法主要以放化疗为主,共计118 例接受放射治疗(91.5%),7 例接受手术治疗(5.4%),4例行单纯化疗(3.1%)。放射治疗分为单纯放疗或同步放化疗,61 例为单纯放疗(51.7%),57 例为同步放化疗(48.3%),放疗剂量为66~72.1 Gy,2 例因无法耐受副反应中途放弃治疗,剂量为18 Gy 及50 Gy;其中,101 例予以诱导化疗。手术方案包括:单纯经口原发灶切除3 例,经口扩大切除或开放切除原发灶+颈部淋巴结清扫术4 例。仅行单纯化疗4 例,为晚期病例,予以姑息化疗。以放射治疗为主要治疗手段的118 例患者治疗后效果评估:达到完全缓解(CR)占33.1%(39/118);部分缓解(PR)占37.3%(44/118),疾病稳定(SD)占25.4%(30/118);疾病进展(PD)占4.2%(5/118)见表2。HPV 感染情况与解剖位置的关系本组患者HPV 阳性51 例,阳性率39.53%,全部为高危型HPV 16/18,低危型HPV 6/11 无阳性。4 个口咽解剖位置中,扁桃体区HPV 阳性率最高,达到52.5%;其次为舌根区,为40.6%;口咽侧壁及后壁区为33.3%;软腭区阳性率最低,为20.0%,见图1。
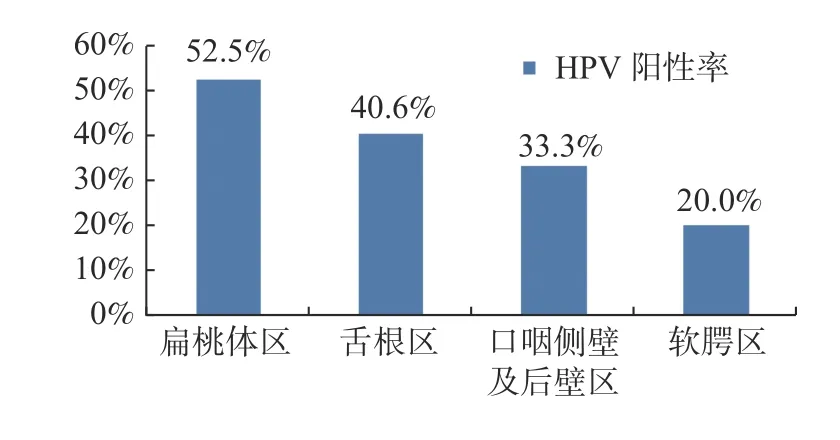
图1 口咽各解剖位置HPV 阳性率Fig.1 The HPV positive rate on different sites of oropharynx
2.2 HPV 阳性口咽鳞癌与HPV 阴性口咽鳞癌临床资料比较
HPV 阳性口咽鳞癌共51 例,HPV 阴性口咽鳞癌共78 例,表1。2 组间男女性别比较无明显差异,但阳性组中发病年龄小于60 岁的患者数较阴性组多,前者36 例,占70.6%,后者41 例,占52.6%,经卡方检验有统计学意义(χ2=4.164,P=0.041)。比较2 组既往史,阴性组69.2%的患者长期吸烟,高于阳性组(47.1%),差异具有统计学意义(χ2=6.342,P=0.012)。
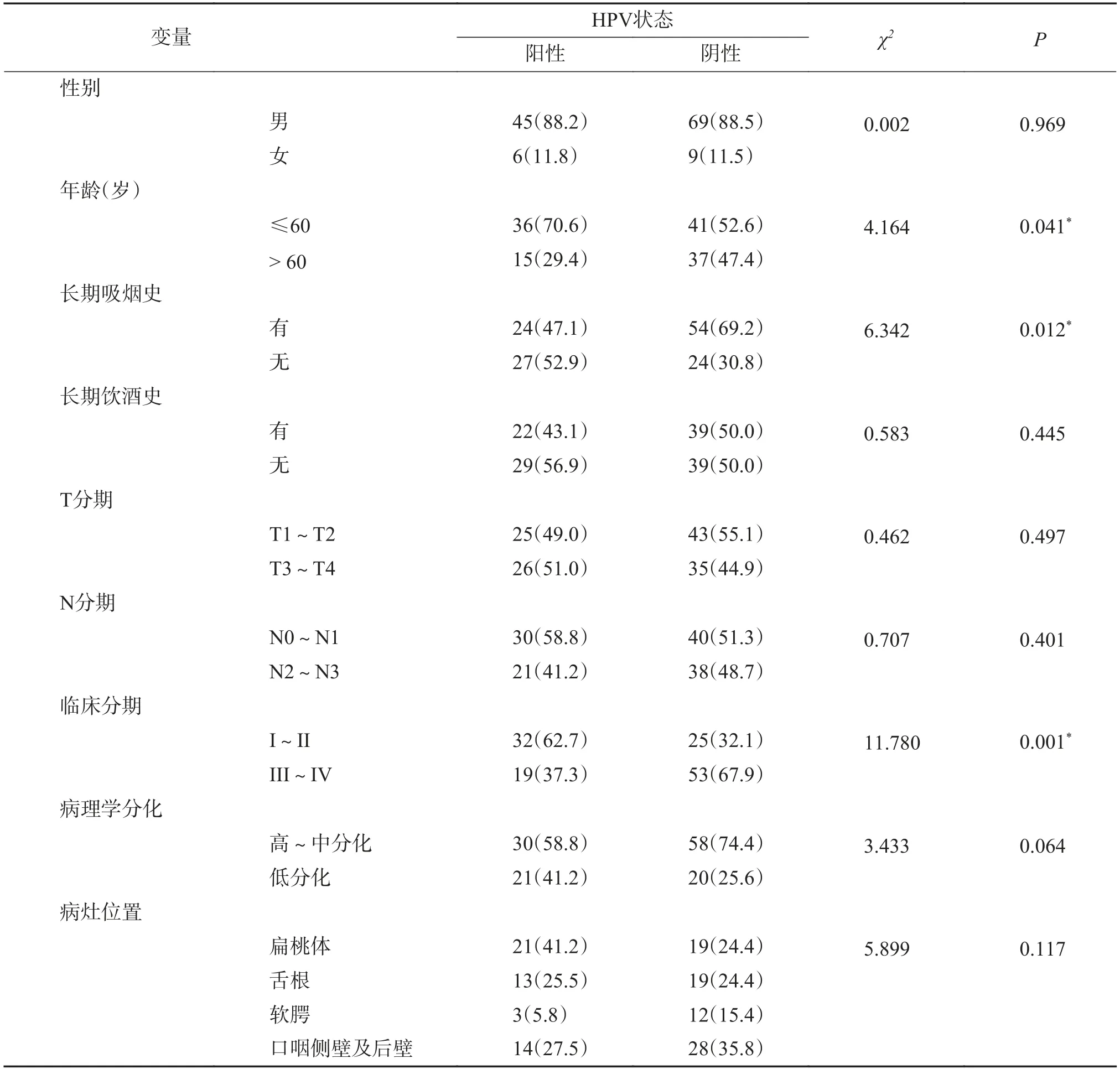
表1 云南省肿瘤医院129 例HPV 相关口咽癌临床资料比较[n(%)]Tab.1 Comparison of the clinical data of 129 cases of HPV-related oropharyngeal cancer in Yunnan cancer hospital [n(%)]
而2 组长期饮酒史比较无明显区别[43.1%(阳性组)vs 50.0%(阴性组)]。2 组T 分期及N 分期经统计学分析无明显差异。但2 组临床分期差异明显,阳性组早期患者占比较大,为62.7%,而阴性组早期患者比例较低,为32.1%,其中晚期患者比例达67.9%,2 组差异有统计学意义(χ2=11.78,P=0.001)。HPV 阳性组低分化病例较阴性组占比多,分别为41.2%与25.6%,但二者无统计学差异。此外,阳性组发病位置最多见于扁桃体区域,占41.2%,其次为口咽侧壁及后壁区以及舌根区,分别为27.5%和25.5%,软腭占比最少,为5.8%;阴性组口咽侧壁及后壁区域发病最多,占35.8%,其次为扁桃体及舌根区域,均为24.4%,软腭区域最低,占15.4%,但二者无统计学差异。
2.3 不同HPV 感染状态间治疗效果的比较
在接受放化疗的口咽鳞癌患者中,HPV 阳性患者经治疗后达到CR 及PR 的例数为38 例,治疗有效率80.9%;HPV 阴性患者治疗后达到CR及PR 的例数为45 例治疗有效率63.4%,两者具有统计学差异(χ2=15.002,P=0.002),见表2。
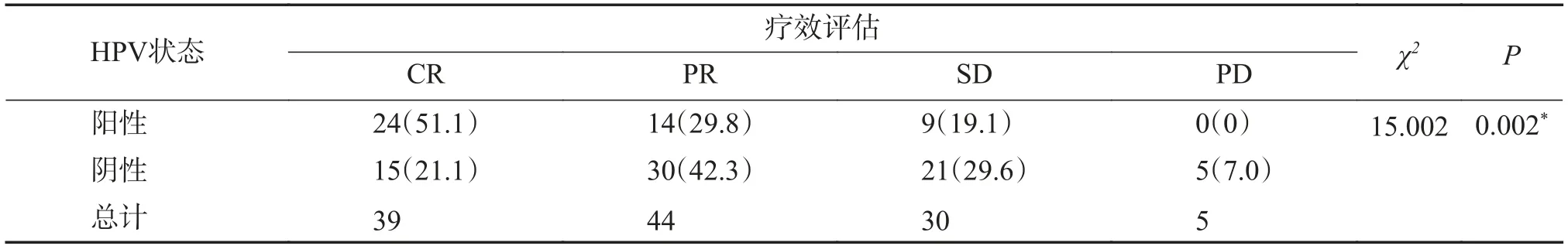
表2 云南省肿瘤医院118 例不同 HPV 感染状态口咽癌放化疗治疗效果比较[n(%)]Tab.2 Comparison of radiotherapy and chemotherapy effect of 118 cases of oropharyngeal cancer in different HPV infection states in Yunnan cancer hospital [n(%)]
3 讨论
口咽鳞癌好发于中老年男性,患者多有烟酒嗜好。本组患者男女比例为7.6∶1。一项基于中国人群的口咽鳞癌研究提示,近10 a,我国男性发病率增加30.7%,而女性发病率在同一时期却相对稳定,这在一定程度上体现了烟酒危险因素对口咽鳞癌患病的影响[11]。此外,多项研究发现男性感染HPV 的风险比女性高2~3 倍,还有学者发现男性更容易发展为HPV 持续感染状态,但原因尚不清楚[12−13]。HPV 作为一种病毒感染致病因素,所引发的口咽鳞癌具有独特的临床病理特点。因此,对HPV 病因的深入探索,可为口咽鳞癌的预防、诊断及治疗提供重要临床证据。
HPV 感染率受地区、生活方式、检测方法等因素而不同,西方国家HPV 感染率较高,有报道提示其在口咽鳞癌中的感染率可高达90%[14]。目前,我国还未有大规模研究统计口咽鳞癌HPV 感染情况。现有研究感染水平差异较大,例如,广西地区有报道口咽鳞癌HPV 感染率为50.0%[6];吉林地区头颈部鳞癌的总感染率在12.9%,其中口咽鳞癌感染率最高,为28.6%[5];新疆地区口咽鳞癌HPV 感染率为35.0%[15];其次,四川地区口咽鳞癌HPV 感染率较低,为16.7%[16]。本研究测定的口咽鳞癌HPV 感染率为39.53%,在国内现有文献报道中属中等偏高水平。结合国内研究,我国HPV 阳性率总体上低于国外报道,这可能由于种族、环境、性生活方式等差异所导致。HPV常见致病亚型是HPV16、18、31 和33 亚型。HPV 16 是最主要的高危致病亚型。有研究表明,95%的HPV DNA 阳性头颈鳞癌检出HPV 16 感染,并认为HPV 16 感染率与地理区域无关[17]。国内文献报道HPV 16 占所有口咽鳞癌感染者中72.73%~100%。本研究HPV 阳性口咽鳞癌感染亚型均为HPV 16/18 型,但未明确两种亚型的比例,仍需在后续研究中对不同亚型HPV 做进一步测定。据以往流行病学统计资料报道,HPV 相关口咽鳞癌患者多较年轻、更多发生于非吸烟饮酒人群、原发灶分期较非相关口咽鳞癌早、转移淋巴结更多、病理学分化更低。本研究HPV 阳性组中发病年龄小于60 岁的患者更多,差异有统计学意义;阳性组中长期吸烟史的比例明显低于阴性组(P<0.05),但阳性组长期饮酒者占比仅稍低于阴性组(43.1% vs 50.0%),这可能由于云南地区饮酒较为普遍,导致2 组差异并不明显。在临床分期方面,HPV 阳性组的早期患者比例明显高于阴性组(P<0.05),但与之前文献报道不同,本研究中HPV 阳性者淋巴结分期较早,N0~N1 分期占58.8%,大于阴性组比例51.3%,该差异无统计学意义。本研究HPV 阳性组病例病理学分级偏低,低分化病例占41.2%,高于阴性组低分化病例占比25.6%,虽然2 组差异无统计学意义,但这种趋势较明显。扁桃体及舌根与HPV 相关口咽鳞癌有着密切联系,其特殊的解剖结构造成了较高的HPV 易感性。构成这两个位点的上皮组织中含有大量免疫系统成分-淋巴样细胞,具有免疫豁免的功能,可抑制HPV 特异性T 细胞。当HPV 感染这些上皮组织时,它们可以耐受抗原的引入,而不会诱发炎性免疫反应,从而促进HPV 免疫逃逸[18]。本研究中,HPV 阳性口咽鳞癌有66.7%的病例发病位置在扁桃体及舌根区域,并且扁桃体及舌根部位HPV 感染率也最高,符合以上学说。但值得注意的是,本研究中口咽侧壁及后壁癌占全组病例的32.6%,远远高于国内以往文献报道,国内研究比例多在0%~5%,较高一项研究为9.5%,而国外文献中其比例差异较大,在2.0%~36.2%之间[18−21],本研究与国内报道的差距可能由于:一是各研究样本量及入组标准的不同导致了误差;二是可能与云南地区人口遗传特异性、生活习惯、环境差异等因素有关,因此,还需进行多中心大样本研究进一步明确各地区口咽鳞癌发病位置是否存在差异。
本研究还对HPV 感染状态与放化疗后的疗效进行了比较。结果显示,HPV 感染者接受放化疗后的有效率高于未感染者,且在有效患者中达到CR 的比例达63.2%,远远大于未感染者(33.3%),经卡方检验2 组具有统计学差异。这符合HPV 相关口咽鳞癌对放射敏感的发现。现已有体外实验证明,与HPV 阴性肿瘤相比,HPV 阳性肿瘤的放射敏感性提高了30%[22−23]。多种机制共同促进了增敏作用[4,24]。(1)HPV 相关口咽鳞癌多为野生型p53 基因,照射后双链DNA 断裂,p53 将被激活,诱导细胞周期阻滞以及凋亡程序的进行,而在非相关口咽鳞癌中,p53 发生突变,无法诱发细胞凋亡;(2)p16 蛋白在HPV 相关口咽鳞癌中过表达,该种蛋白可抑制放射后细胞的DNA 损伤修复,从而启动细胞凋亡;(3)HPV 相关口咽鳞癌具有更明显的肿瘤浸润淋巴细胞,另外放射线引起肿瘤细胞损伤导致肿瘤及病毒抗原释放,引发更强的免疫反应。一项前瞻性临床试验研究了III/IV 期口咽鳞癌及喉鳞癌中HPV 与治疗效果的关系,结果提示,诱导化疗后HPV 阳性组的缓解率为82%,高于HPV 阴性组55%(2 组差异27%[95%CI 9.3%~44.7%];P=0.01);完成放化疗后HPV 阳性组的缓解率也高于阴性组,为84% vs 57%(27%[95%CI 9.7%~44.3%]),也体现了HPV相关肿瘤较好的治疗反应[25]。
