苹果MdGH3-2/12在盐胁迫下的功能分析
2021-12-08马梦楠马锋旺邹养军
马梦楠,刘 媛,马锋旺,邹养军
(西北农林科技大学园艺学院,陕西 杨凌 712100)
苹果(MalusdomesicaBorkh.)是世界主栽果树之一,我国苹果的种植面积和产量均占世界50%以上,居世界第一位[1]。西北地区是我国主要苹果产区,因条件限制,干旱和盐胁迫等成为制约这一地区苹果产业发展的重要因素。我国的盐碱地约占全国耕地面积的7%左右,而将来土壤盐渍化可能会更严重[2]。土壤盐渍化会改变土壤中离子浓度、渗透势,造成离子紊乱,影响植株生长,进而导致作物产量下降。近年来盐碱地的改良已经在技术方面取得了不错的成果[3],但是因为成本过高,改良往往达不到预期效果。因此尽快发掘苹果中逆境胁迫基因以提高苹果抵御胁迫的能力,保证其在不良条件下产量也能增加,对于促进我国的苹果产业发展具有重要意义。
植物在受到盐胁迫后会发生许多变化[4],从表观来看,长期盐胁迫会导致植株长势缓慢,根系不能正常发育,茎秆矮小,叶片发黄失绿直至坏死脱落,干物质积累量减少等[5]。从微观来看,植物在受到盐胁迫时体内会发生许多复杂的理化反应,主要有Na+浓度过高引起的离子毒害、根系细胞失水引起的渗透胁迫和体内活性氧积累引起的氧化胁迫[6],细胞膜的完整性与稳定性,以及植株净光合速率、代谢能力、渗透调节物质的生成,活性氧的产生与消除,抗氧化相关酶活性和矿质元素的吸收和积累等都会受到影响[7-8]。除了改变形态以及生理活性来适应盐胁迫外,植物还会通过调控激素变化来响应各种胁迫[9]。人类最早发现的一种植物激素是生长素(IAA)[10],IAA通过调控下游基因的表达来控制植物对环境作出反应,GH3(GretchenHagen3)家族就是一个生长素早期响应基因家族,最早由Gretchen Hagen在大豆中发现[11],目前已在苹果[12]、拟南芥(Arabidopsis)[13]、烟草(Nicotiana)[14]、水稻(Oryza)[15]、辣椒(Capsicum)[16]、玉米(Zea)[17]和小麦(Triticum)[18]等多种植物中得到鉴定。前人的研究证实GH3基因会参与植物生长发育,GH3蛋白可通过促进各种激素与氨基酸结合来调节体内不同激素的稳态,激活激素信号途径来提高植物对逆境的抗性[19],部分GH3蛋白还参与植物根部生长发育的调控,控制顶端优势、衰老及逆境适应等生理过程[13,20-21],对植物的早期发育和形态建成均具重要意义。大部分GH3家族成员具有不止一种生长素氨基酸合成酶活性,例如AtGH3.6在盐胁迫下表达量显著增加,在干旱、ABA和高盐等逆境胁迫下,过表达GH3-6还会抑制RD22、KIN1和RD29A等逆境响应基因的表达[22]。与野生型相比,拟南芥过表达GH3-6突变体明显不耐干旱和盐胁迫[23]。干旱也会显著诱导GH3-5表达,但不同的是GH3-5过表达突变体表现出较强的耐旱性,这可能因为GH3-6只能以IAA为底物完成腺苷酰化,而GH3-5可以同时作用于IAA和SA,其可能会通过水杨酸途径提高拟南芥植株的耐旱能力[24]。水稻中过表达OsGH3.1会降低生长素的含量,进而抑制细胞的生长,提高了水稻在真菌病原胁迫下的抗病性[25]。本实验室博士黄冬[26]发现MdGH3-2/12在丛枝菌根共生中扮演重要角色,将苹果中MdGH3-2和MdGH3-12基因同时干扰后发现AMF侵染率降低,且转基因植株比野生型植株对干旱胁迫表现得更敏感[27]。以上研究表明,GH3基因家族在响应非生物胁迫中起着重要作用。
为进一步探究MdGH3-2和MdGH3-12基因在苹果响应盐胁迫中的功能,本试验以野生型苹果植株和RNA干扰MdGH3-2/12苹果植株为材料,进行了为期15 d的120 mM·L-1NaCl水培处理,对盐胁迫下苹果植株的生长指标与生理指标的变化进行了分析,初步探究了将MdGH3-2和MdGH3-12基因干扰后苹果植株对盐胁迫的响应,为提高苹果耐盐性提供了理论依据。
1 材料与方法
1.1 试验材料
苹果野生型(WT)材料为本实验室保存‘嘎啦’苹果(M.domesticacv. Gala)品种(GL-3),转基因材料由实验室已毕业博士黄冬转化获得。MdGH3-2/12干扰植株获得3个株系,分别为RNAi的1、9和10号,简写为GR-1、GR-9以及GR-10。
1.2 试验设计
试验于2020年5月起在西北农林科技大学果树逆境生物学实验室的组培室以及水培室进行,位于陕西省咸阳市杨凌区西北农林科技大学南校区(东经107°59′,北纬34°14′)。供试材料的培养条件参照孙逊[27]的方法。组培苗在生根培养基上生根后移栽至营养土中,在光照培养箱中继续生长1个月,待其长至8片真叶后挑选长势一致的植株转移至水培盆中进行盐胁迫处理,水培方式参考梁博文[28]的方法。将植株分成2组,一组进行盐处理(120 mM·L-1NaCl+1/2 Hoagland营养液),另一组设为对照组(1/2 Hoagland营养液)。Hoagland营养液的配置参考康晓育[29]的方法。各重复每株系至少40株。处理15 d时植株表现出明显伤害,取顶部1~2片叶用来检测基因对盐胁迫的响应,取茎尖以下第4~6片叶用来检测生理指标。
1.3 生物量的测定
处理结束时各处理各株系随机选取10株苹果苗,将植株分为根、茎、叶三部分,并用清水、蒸馏水、超纯水依次清洗一遍,擦干水分后,用万分之一天平测定植株鲜重,然后将各部分分别装入信封袋后置于烘箱105℃杀青20 min,而后在65℃下烘至恒重,再用万分之一天平分别称量植株各部分的干重。总鲜重和总干重分别为各部分鲜重和干重之和,相对生长速率的计算方法为处理植株的重量除以对照植株的重量。
1.4 生理指标的测定
1.4.1 光合参数、总叶绿素含量、丙二醛含量、根系活力以及相对电导率的测定 在试验进行的第0、5、10、15天,上午8∶30—11∶30使用CIRAS-3便携式光合系统(CIRAS, Amesbury, MA,USA)测定植株从顶端数第4~8片叶的光合参数:Pn、Gs和Ci,每处理每株系取3个生物学重复,每个重复选取5棵植株。测定时选用红蓝光源,设定光强为1 000 μmol·m-2·s-1,流速为300 μmol·s-1以及参比室CO2浓度为300±5 cm3·m-3。
叶绿素含量:根据Porra等[30]改良修订的方法进行测定。在盐处理结束时,取植株新鲜叶片,去掉主叶脉后剪成1 mm左右的细丝混匀,称取0.1 g浸泡入10 ml 80%的丙酮溶液中避光浸提,期间充分摇晃离心管4次使叶绿素完全溶解,每处理每株系进行3次生物学重复。48 h后待浸提结束,用UV-2550分光光度计分别测定663、645 nm和470 nm下吸光值,以80%丙酮作为空白对照,分别计算叶绿素a、叶绿素b和类胡萝卜素浓度以及总叶绿素含量。
叶绿素计算公式:
Ca(mg·L-1)=12.7×A663-2.69×A645×V/(1000×W)
Cb(mg·L-1)=22.9×A645-4.68×A663×V/(1000×W)
Cc(mg·L-1)=(1000×A470-3.27×Ca-104×Cb)×229×V/(1000×W)
C总(mg·L-1)=(20.2×A645+8.02×A663)×V/(1000×W)
式中,A663、A645、A470分别为相应波长下的吸光值,V为提取液的体积,W为叶片鲜重。
丙二醛(MDA)含量和根系活力使用检测试剂盒(苏州科铭生物)按照说明书方法测定。
相对电导率(REL)的测定参照陈爱葵等[31-32]的方法:取茎尖以下第4~6片叶,用打孔器打取10个小叶圆片,充分浸泡在8 ml去离子水中,盖好离心管盖。常温浸泡4 h,期间充分摇晃离心管4次,直至完全浸泡出叶圆片中的细胞液。而后使用雷磁DDS-307电导率仪测定电导率,用R1表示,去离子水电导率用R0表示。再将离心管沸水浴20 min,冷却至室温后摇匀,测定煮沸后电导率R2,按以下公式计算REL:
REL(%)= (R1-R0)/(R2-R0)×100%
1.4.2 叶片气孔的观察 盐处理结束后,取各株系第3~6片叶片,避开叶片主脉剪下宽约5 mm的细条,并迅速剪成方形放入1 mL离心管中,管内装有冰浴预冷的4%戊二醛固定液,置于4℃冰箱保存。上机观察前将样品经0.1 M磷酸缓冲液冲洗1次后,用90%、80%、75%、50%、30%的乙醇溶液逐级脱水,在通风橱用乙酸异戊酯置换处理,用Hitachi HCP-2型临界点干燥器干燥后粘样喷金。用钨灯丝扫描电镜分别在300和3 000倍下观察并拍照,每个处理各拍10张,最后用ImageJ软件对气孔密度、长度和开张度进行统计分析。
1.4.3 氨基酸含量的测定 使用液质联用仪(SCIEX, QTRAP5500)测定氨基酸含量:将叶片冻样研磨成粉末后准确称取0.1 g至预冷的1 mL 50%乙醇提取液中提取,然后4℃、12 000 r·min-1离心10 min,用1 mL注射器吸取上清液用0.22 μm有机滤膜过滤后,置于冰上待测。吸取50 μL上清液加入干净棕色进样瓶中,添加950 μL色谱级纯甲醇至终体积为1 mL后上样。使用LC-MS系统检测,色谱柱为Inertsil ODS-4 C18(4.6×250 mm, 5 μm),流速设定为0.3 mL·min-1。洗脱溶剂体系为含有0.1%(v/v)甲酸的超纯水(A)和乙腈(B)。通过与Sigma氨基酸标准品获得的峰面积(标曲)进行比较来计算结果。
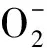
1.4.5 矿物质元素含量测定 Na+、K+含量通过火焰分光光度计Sherwood M410(Cole-Parmer,Chicago,America)测定,具体参考赵琪[33]的方法。
1.4.6 RNA提取和qRT-PCR表达定量分析 植物总RNA使用Wolact®植物RNA分离试剂盒(深圳市凯联生物技术有限公司,中国),按照说明书进行提取。反转录得到的cDNA核酸样品的浓度和纯度使用微型分光光度计进行检测。NanoDrop 2000C(Thermo Fisher Scientific,Massachusetts,America)测定浓度后,用灭菌后的蒸馏水将cDNA全部稀释成200 ng·μL-1。LightCycler 96荧光定量仪(Roche, Switzerland)进行qRT-PCR分析,荧光实时定量染料采用SYBR Premix Ex TaqTMII(Takara, Tokyo, Japan)。选取苹果MDH(MDP0000197620)为内参基因;用2-ΔΔCT方法计算目的基因的相对表达量[34]。引物序列见表1。

表1 论文中所用引物序列
1.5 数据分析
所获得的原始数据在Microsoft office Excel中处理并作图,利用IBM SPSS Statistics 20.0软件进行统计分析,采用单因素ANOVA方法进行Duncan’s检验(P<0.05),数据全部以平均值±标准偏差(SE)表示。
2 结果与分析
2.1 盐胁迫下MdGH3-2/12干扰苹果植株表型的变化
在正常条件下,WT和RNAi各株系植株的生长和表型无明显差异,经过盐处理后,所有的植株叶片表面都出现了比较明显的伤害,RNAi植株的叶表面比WT明显出现更多褐斑,叶片坏死的程度也要明显高于WT植株(图1a)。盐处理后各株系MDA含量均上升,RNAi植株株系(GR-1,GR-9,GR-10)MDA含量分别为WT植株的1.15、1.25倍和1.16倍,差异显著(图1b)。REL也有相同变化规律,RNAi植株株系内REL分别为WT植株的1.23、1.39倍和1.48倍(图1c)。盐处理后植株的总叶绿素含量都显著降低,RNAi植株株系内总叶绿素含量分别为WT植株的90.7%、86.2%和81.9%(图1d)。观测植株根系发现低浓度盐胁迫促进了苹果植株发新根(图1f),测定后发现各株系根系活力增加,但RNAi植株各株系的根系活力显著低于WT植株,分别为WT植株的93.8%、77.5%和90.0%(图1e)。
2.2 盐胁迫下MdGH3-2/12干扰苹果植株的生长量变化
如表2所示,盐处理15 d后分别对处理组和对照组植株的鲜重进行测量后发现,与对照处理相比,盐处理后各组织的鲜重均下降,各株系(WT,GR-1,GR-9,GR-10)叶片鲜重分别为对照组的73.9%、81.5%、72.6%和77.8%,显著下降;植株茎重也有相同趋势;根鲜重变化无显著差异。正常条件下,RNAi植株各株系的总鲜重与WT植株无显著差异。盐处理后,RNAi植株各株系的总鲜重分别为WT植株的86.7%、82.4%和87.9%,显著下降。
如表3所示,与对照处理相比,盐处理后,各株系根部的干重显著增加,分别为对照组的119.8%、117.7%、102.9%及109.0%;茎干重、叶片干重显著下降。盐处理后,RNAi材料各株系的根干重分别为WT材料的88.2%、85.0%和89.5%,茎干重分别是WT材料的87.7%、91.8%和89.7%,叶片干重分别为WT材料的96.2%、87.9%、和97.6%,均显著下降。综上可知,盐处理会对植株生物量的积累产生不利影响,但一定程度盐浓度可促进植株根部物质积累。与WT植株相比,RNAi植株各株系在盐胁迫下受到的不利影响更大,将MdGH3-2/12基因干扰后会导致植株的干重和鲜重均下降。
2.3 盐胁迫下MdGH3-2/12干扰苹果植株光合荧光参数的变化
在正常条件下,对照组各株系之间的光合参数,包括Pn、Gs和Ci值均无显著差异(图2)。盐处理后植株(WT,GR-1,GR-9,GR-10)的Pn、Gs和Ci值都表现出显著的下降趋势,Pn值分别下降至对照处理的51.3%、33.0%、40.3%和43.1%,RNAi植株各株系显著低于WT植株(图2a);Ci和Gs值也有类似的变化趋势(图2b,2c)。对植株的最大光化学效率(Fv/Fm)的测量结果表明,经过盐处理后,RNAi植株各株系的Fv/Fm值显著降低,分别为WT植株的97.0%、96.4%和97.5%(图2d),植株的活体荧光图也能证明干扰株系在盐胁迫下受到的伤害更大(图2e,荧光数值越小,颜色越接近黑色,受伤害越严重)。
2.4 盐胁迫下MdGH3-2/12干扰苹果植株叶片气孔的变化
在扫描电镜下300倍和3 000倍镜头视野下对苹果野生型和转基因植株的气孔形态进行了观测,发现正常条件下的野生型和转基因苹果植株的气孔开度没有明显差异;在盐处理后,RNAi植株各株系和WT植株的气孔开度分别缩小了35.0%、39.0%、55.0%和46.2%,与WT植株相比,RNAi植株各株系的气孔开放程度显著降低,部分气孔甚至出现闭合状态 (图3a,3d)。盐处理后,气孔变短,但各株系之间无显著差异(图3b);RNAi植株各株系的气孔密度显著高于WT植株,气孔密度分别增加了15.0%、40.8%、21.2%和26.5%(图3c)。
2.5 盐胁迫下MdGH3-2/12干扰苹果植株中氨基酸代谢的变化
检测MdGH3-2/12基因干扰后苹果叶片各材料中15种氨基酸水平的变化,结果显示,盐处理后,各株系中甘氨酸(Gly)、异亮氨酸(Ile)、脯氨酸(Pro)、丝氨酸(Ser)和酪氨酸(Tyr)的含量均显著增加(图4e,4g,4k,4l,4n),其中WT植株中Pro的含量增加了2.6倍,而相比于WT植株,RNAi植株GR-9中Pro的含量增加了10.3倍,GR-10和GR-1也分别增加了6.3和7.1倍(图4k)。此外,盐处理后,各植株各株系中精氨酸(Arg)、天冬氨酸(Asp)、谷氨酸(Glu)、组氨酸(His)、赖氨酸(Lys)和苏氨酸(Thr)的含量都显著下降(图4b,4c,4d,4f,4i,4m),其中WT植株中Asp含量下降了2倍,相比于WT植株,RNAi植株各株系分别下降了1.5、2.4、1.2倍(图4c)。
2.6 盐胁迫下MdGH3-2/12干扰苹果植株中活性氧含量及抗氧化系统的变化

2.7 盐胁迫下MdGH3-2/12干扰苹果植株中Na+和K+积累的变化
对处理组和对照组各株系的根、茎、叶中Na+和K+的浓度进行了测定,发现盐处理后各组织尤其根中Na+有大量积累,分别增加至对照后9.5、5.9、12.2倍和10.3倍,RNAi植株GR-9和GR-10的Na+积累量显著高于WT植株(图6a-6c);而各组织中的K+的含量都显著降低,如各植株叶片中K+的含量分别降低了31.2%、48.2%、40.5%和39.3%,差异显著(图6d~6f)。盐处理后,各组织Na+/K+比值显著高于对照处理,各株系根中的Na+/K+比值分别为0.497、0.558、0.525和0.577,RNAi植株各株系显著高于WT植株(图6g~6i)。
为了探究植株中Na+/K+比值变化与离子转运相关基因表达量的关系,对各株系根系中离子转运相关基因的表达量进行检测,结果发现盐处理后各株系根中MdSOS1、MdSOS2和MdSOS3以及MdNHX1的表达量都显著上调,但RNAi植株各株系内各基因表达量显著低于WT植株(图7a~7d),其中MdSOS1分别上调3.97、2.31、1.91倍和2.81倍;MdSOS2分别上调2.37、1.44、1.26倍和2.34倍;MdSOS3分别上调1.74、1.56、2.21倍和1.68倍;MdNHX1分别上调1.59、1.74、1.45倍和1.40倍,而植株中MdAKT2-3(K+transporter 2-3)基因的表达量分别下调61.7%、44.4%、46.8%和35.9%,RNAi植株各株系显著低于WT植株(图7e)。
3 讨 论
大量研究表明盐胁迫会改变植物的形态、生理、生化和代谢特征,对植物的生长和生物量的积累会产生不利影响[36-39]。本试验结果表明,在正常条件下,转基因植株和野生型植株的生长状况和表型无明显差异,经过盐处理后,所有的植株叶片表面都出现了比较明显的受伤害特征,这与前人研究一致。与对照处理相比,盐胁迫后,将MdGH3-2/12基因干扰后的苹果植株叶面存在比野生型植株更多的褐斑和坏死现象,且各株系的叶片干、鲜重也都显著低于野生型。细胞中的MDA含量高低可以代表膜脂过氧化程度,相对电导率可以衡量生物膜的透性,二者的含量可以在一定程度上直接反映植物细胞膜在受到胁迫时生物膜的完整程度和损伤程度[40]。盐处理后,转基因植株较野生型植株中总叶绿素含量显著下降,转基因株系内总叶绿素含量分别为野生型的90.7%、86.2%和81.9%;MDA含量和REL则显著增加,转基因株系内MDA含量分别为野生型的1.15、1.25倍和1.16倍,REL分别为野生型的1.23、1.39倍和1.48倍,这表明相比于野生型植株,干扰MdGH3-2/12转基因苹果植株在盐胁迫下生物膜受损伤程度更大。有研究表明拟南芥GH3家族的一个基因ydk1-D可参与调控拟南芥下胚轴生长和根的伸长[41],本试验中观察到转基因植株根系小于野生型。在对植株的根系活力进行测定后发现,经过盐处理后各株系的根系活力上升,但转基因植株各株系的根系活力显著低于野生型植株,分别为野生型的93.8%、77.5%和90.0%,可能导致在盐胁迫下苹果植株根部吸收能力下降。
盐胁迫会抑制植物的生长、生物量的积累。在本试验中,正常条件下各株系鲜重之间无显著差异,盐处理后,转基因植株各株系总鲜重分别为野生型的86.7%、82.4%和87.9%,显著下降。盐处理后各株系(WT,GR-1,GR-9,GR-10)叶片的鲜重下降,分别为对照组的73.9%、72.9%、72.6%和77.8%,转基因植株各株系鲜重分别为野生型的89.9%、85.0%和92.5%,显著下降;植株茎重也有相同趋势。从各株系的干重变化来看,与对照组相比,盐处理后各株系根部的干重都显著增加,分别为对照组的119.8%、117.7%、102.9%及109.0%, RNAi各株系根的干重相比于野生型都显著下降,分别为野生型的88.2%、85.0%和89.5%。盐处理后,各株系的茎干重也显著下降,转基因植株各株系茎干重分别是野生型的87.7%、91.8%和89.7%。转基因植株各株系叶片干重分别为野生型的96.2%、87.9%和97.6%,也显著下降。以上结果表明,盐胁迫会影响苹果生物量积累,而将MdGH3-2/12干扰后,苹果植株在盐胁迫下生物量积累较野生型下降。
研究表明,盐处理会导致不同植物的叶片气孔开度变小[42],影响气体交换参数、叶绿素含量和叶绿素荧光值,因此叶片吸收外界CO2的能力下降,进而使植物光合能力下降。本试验中,与对照相比,盐胁迫下植株的Pn、Ci、Gs值和Fv/Fm值都显著下降,其中Pn值分别下降至对照组的51.3%、33.0%、40.3%和43.1%;转基因植株各株系Pn值显著低于野生型植株;叶片受损严重,盐处理后转基因植株的最大光化学效率显著降低,分别为野生型的97.0%、96.4%和97.5%,植株的活体荧光图也证明转基因植株各株系在盐胁迫下受到的伤害更大,这同Alam等[43]对大豆的研究结果相一致。以上结果表明在盐胁迫下,转基因植株较野生型植株的光合系统受到更严重的伤害,植株光合能力显著下降。气孔开度是衡量植物与环境间的水分、CO2平衡以及循环的重要生理指标,也是影响蒸腾速率的主要原因之一[44]。在扫描电镜下对野生型和MdGH3-2/12干扰苹果植株的气孔进行了观测,发现在正常条件下,株系间气孔开度没有明显差异,而经过盐处理后,各株系的气孔开度分别缩小了35.0%、39.0%、55.0%和46.2%,转基因植株各株系部分气孔甚至出现闭合状态;各株系的气孔密度分别增加了15.0%、40.8%、21.2%和26. 5%,转基因植株各株系的气孔密度显著高于野生型。因此转基因植株各株系气孔缩小甚至部分关闭,可能导致植株在受到盐胁迫时净光合速率显著低于野生型。
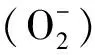
植物在遭受胁迫时,细胞内的游离氨基酸会对胁迫做出响应,Pro就是其中的一种多功能氨基酸,常被认为是一种渗透胁迫信号[48-49],在各种逆境条件下都会参与植物的生长发育。研究表明,很多植物组织中游离氨基酸含量,尤其是Pro的含量在盐胁迫下会显著增加[50]。对各株系叶片材料中氨基酸的含量测定结果显示,盐处理后,各株系中Gly、Ile、Pro、Ser和Tyr的含量均显著增加,其中转基因植株各株系中Pro的含量相比于野生型分别增加了7.1、10.3倍和6.3倍,差异显著。大部分GH3家族成员具有不止一种生长素氨基酸合成酶,能通过激活水杨酸、茉莉酸和乙烯信号途径从而提高植物对逆境胁迫的抗性[19]。Khan等[51]发现拟南芥突变体AtGH3.9可能通过氨基酸来控制生长素的活性,在IAA和JA之间的信号通路发挥作用。有研究表明GH3.5蛋白可以催化水杨酸与天冬氨酸的结合[52],因此本试验中将MdGH3-2/12干扰后,苹果植株耐盐性下降,可能是因为盐胁迫下转基因植株各株系内氨基酸的数量分布发生了改变,进而改变了植株体内激素的含量及分布,影响了激素信号通路的激活,因此转基因植株各株系较野生型受到更大程度的胁迫。
植物细胞对盐离子的毒害作用高度敏感,Na+进入细胞后,会引起植物的细胞膜功能改变,相关代谢酶活性降低,渗透性增加导致渗透胁迫、K+外流,还会造成氧化胁迫、离子毒害等[53]。在正常情况下, Na+和K+在膜内外进行交换,K+在植物体内具有渗透调节作用,两者存在拮抗关系。当胞内Na+过多就会导致Na+、K+竞争K+的结合位点[54],抑制植物对K+的吸收,造成Na+毒害[55]。在受到盐胁迫时,耐盐植物对K+的吸收量会增加,从而减少对Na+的吸收,降低Na+/K+比值,提高植物对盐胁迫的耐受性[56]。因此调节其Na+/K+比值的稳态对植物耐盐性非常重要。本研究在对各株系的根、茎、叶中Na+和K+的含量进行测定以后发现,盐处理后植株中Na+都大量积累,而根和叶中的K+的含量都显著降低,且转基因植株各株系叶片中的K+含量显著低于野生型,各株系根中的Na+/K+比值分别为0.497、0.558、0.525和0.577。盐处理后,转基因植株各株系中的Na+/K+比值都显著高于野生型,导致植株对盐的耐受性下降。对根系中离子转运关键基因的定量表达分析发现,MdSOS1、MdSOS2、MdSOS3和MdNHX1的表达量都显著上调,其中MdSOS1分别上调3.97、2.31、1.91倍和2.81倍;MdSOS2分别上调2.37、1.44、1.26倍和2.34倍;MdSOS3分别上调1.74、1.56、2.21倍和1.68倍;MdNHX1分别上调1.59、1.74、1.45倍和1.40倍,而植株中MdAKT2-3基因的表达量分别下调61.7%、44.4%、46.8%和35.9%,各个基因在转基因植株株系中的表达量显著低于野生型,这可能也导致MdGH3-2/12干扰植株在面对盐胁迫时,体内的Na+不能及时外排,K+不能及时内流,加剧了Na+积累,Na+/K+比值升高,干扰植株的耐盐性降低。
4 结 论
本研究探讨了苹果生长素响应基因MdGH3-2/12在盐胁迫下的功能,研究发现:
1)相比于WT植株,干扰MdGH3-2/12转基因苹果植株在盐胁迫下的生长以及生物量都显著降低,干扰植株叶片的Pn、Gs和Ci值和最大光化学效率(Fv/Fm)也都显著下降;植株气孔开度缩小;盐胁迫下干扰植株光合系统受损更严重,导致其光合能力显著低于WT植株。
2)干扰植株较WT植株对盐胁迫更敏感,表现为ROS积累更多,而抗氧化酶活性显著低于WT,因此干扰植株在盐胁迫下不能有效清除活性氧而造成更大伤害。
3)盐处理后干扰植株各株系内Pro含量较WT植株显著增加;根中的Na+/K+比值也显著高于WT植株,而盐通路相关离子转运基因的表达量显著低于WT植株,导致Na+不能高效外排,植株受到Na+毒害;干扰株系根系活力也显著低于WT,可能导致植株对周围环境离子吸收能力下降,加剧了离子毒害。
以上研究结果表明,MdGH3-2/12基因在苹果植株的抗盐性方面发挥着重要作用,将MdGH3-2/12基因干扰后苹果植株对盐胁迫的耐受性下降。
