膀胱影像报告和数据系统在膀胱癌中的应用进展
2021-12-08尹宏宇张继
尹宏宇 张继
膀胱癌是泌尿系统最常见的恶性肿瘤,男女发病比率为3~4∶1[1],膀胱癌的发病率和死亡率在不同国家之间存在差异,其作为我国男性的第七大好发癌症,死亡率居泌尿系统恶性肿瘤首位[2-3]。膀胱癌复发率高,非肌层浸润性膀胱癌(nonmuscleinvasive bladder cancer,NMIBC)5年 内 复 发 率 约80%[4]。高危NMIBC病人进展为肌层浸润性膀胱癌(muscle-invasive bladder cancer,MIBC)概率为25%~75%,病人预后与膀胱癌首次评估的准确性及治疗方式的选择密切相关[5-6]。
经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)是目前评估膀胱癌局部分期的标准方法,但其为有创检查,不仅可能会增加肿瘤扩散风险,并且在临床实践中可能会低估病人的分期[7]。近年来,随着影像技术的发展,引入了一种将解剖与功能序列相结合的MR技术——多参数磁共振成像(multiparametric MRI,mp-MRI),其可较好地用于膀胱癌的分期分级。基于mp-MRI的重要价值,2018年日本腹部放射学年会、欧洲泌尿学会及欧洲泌尿影像学会共同发表了膀胱影像报告和数据系统(vesical imaging-reporting and data system,VI-RADS)[8]。本文介绍mp-MRI在膀胱癌中的应用及VI-RADS在评估膀胱癌肌层浸润中的应用进展及未来发展方向。
1 mp-MRI在膀胱癌中的应用
膀胱癌的治疗和监测主要取决于肿瘤的分期、分级及侵袭性。根据肿瘤浸润深度,可将膀胱癌分为NMIBC及MIBC。美国癌症联合委员会(AJCC)分期手册(第8版)描述了膀胱癌TNM分期[9]:Ta,非浸润性乳头状癌;T1,肿瘤侵犯上皮下结缔组织,但并未侵犯固有肌层;T2,肿瘤侵犯固有肌层,T2a侵犯浅肌层,T2b侵犯深肌层;T3,肿瘤侵犯膀胱周围组织,T3a和T3b分别代表显微镜下和肉眼可见的浸润;T4,肿瘤扩散至膀胱外,T4a侵犯邻近器官,T4b侵犯远处组织、骨盆外及腹部。临床上,将TNM分期≤T1定义为NMIBC,≥T2a定义为MIBC。两者在治疗方式的选择及预后方面有显著差异,NMIBC主要采取TURBT及术后化疗;而MIBC多采用根治性膀胱切除术,必要时联合使用辅助治疗、新辅助化疗和放疗[10-11]。此外,NMIBC相较于MIBC有更好的预后。因此,在指导治疗及监测预后方面,评估是否存在肌层浸润具有重要临床意义。
mp-MRI由常规序列T2WI和功能序列扩散加权成像(DWI)及动态增强M RI(DCE-MRI)组成,对于膀胱癌是最有价值的影像学检查手段,该技术不仅能发现膀胱肿瘤,还能评估肿瘤浸润深度,同时在预测肿瘤侵袭性、治疗反应以及监测肿瘤复发方面也具有重要作用[12-13]。T2WI影像信噪比高,显示解剖结构清晰,可用于评估病变的位置、大小和形态,减少分期错误。结合功能序列进一步提高了评估膀胱癌肌层浸润的诊断准确性[14]。正常肌层在T2WI上呈低信号,在DWI上呈等信号,DCE-MRI上呈缓慢、渐进性强化。当肌层信号中断,DCE-MRI呈早期强化时,提示肿瘤侵犯肌层(T2期);当存在肉眼可见的周围组织侵犯(T3b期)时,表现为膀胱周围脂肪组织信号异常,并伴有膀胱壁不均匀强化。当mp-MRI上显示邻近脏器的形态及信号有改变并伴早期强化时,应怀疑肿瘤侵犯邻近脏器(T4期)。然而,mp-MRI无法对T2a、T2b、T3a肿瘤进行详细分期,但三者的病人管理并没有差异。
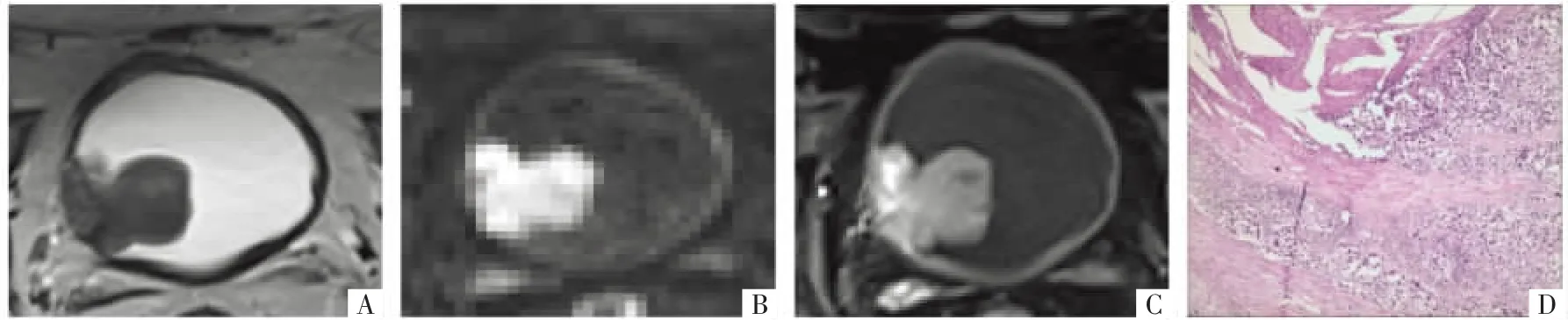
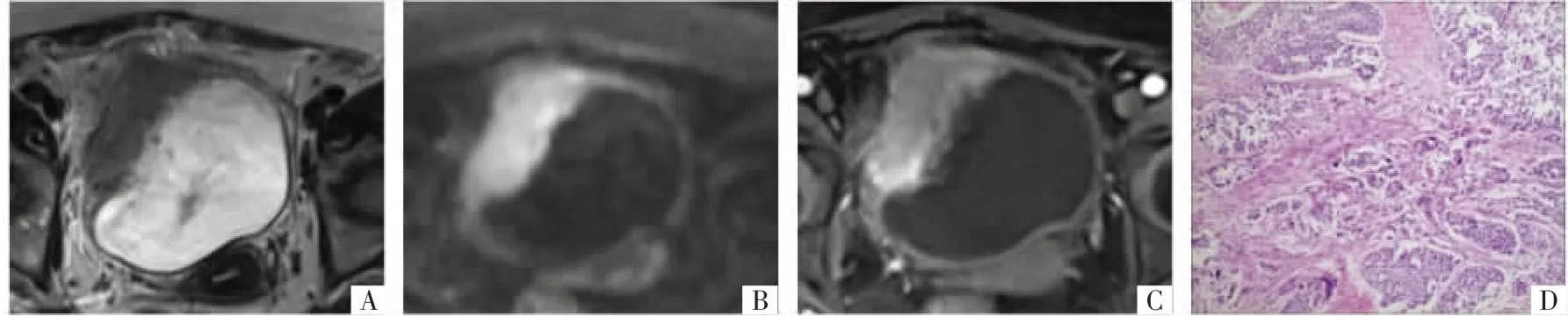
有研究[15]显示,mp-MRI可以较准确地评估膀胱癌分期,主要包括有无肌层侵犯(T1、T2期)、膀胱周围脂肪组织侵犯(T3期)、邻近组织受累(T4期)、盆腔淋巴结受累(N期)和骨转移(M期)。一项系统回顾及Meta分析研究了mp-MRI对于膀胱癌局部分期的准确性,结果显示mp-MRI鉴别≤T1和≥T2肿瘤的敏感度为92%,特异度为88%,区分≤T2和≥T3肿瘤的敏感度为71%,特异度为77%[16]。在另一项Meta分析中,mp-MRI区分≤T1和≥T2膀胱肿瘤的敏感度和特异度分别为87%和79%,区分≤T2和≥T3膀胱肿瘤的敏感度和特异度为83%和87%,区分 Takeuchi等[18]根据DWI上的信号特征描述了膀胱癌的“尺蠖征”,表现为高信号拱形肿瘤及低信号黏膜下蒂,这种低信号肿瘤蒂由水肿的黏膜下层、纤维组织及毛细血管组成。该研究表明“尺蠖征”可以作为评估膀胱癌肌层浸润的重要指标,即存在低信号肿瘤蒂的肿瘤分期通常≤T1期,而缺乏低信号肿瘤蒂的肿瘤分期通常≥T2期。近年,Razik等[19]提出无论是否存在肌层浸润,较小的肿瘤通常缺乏肿瘤蒂,并且部分MIBC存在肿瘤蒂,但与NMIBC不同,这些肿瘤蒂通常扭曲、偏心。此外,有研究[20]表明“尺蠖征”是预测T1期膀胱癌进展的重要因子,缺乏“尺蠖征”的病人进展率明显升高。 2018年日本腹部放射学年会、欧洲泌尿学会和欧洲泌尿影像学会借鉴mp-MRI的研究成果,联合发布了VI-RADS。该系统明确了膀胱MRI检查设备和技术要求,规范了检查和评估分类标准。该评分系统是5分分类量表,1-5分分别代表了极不可能、不太可能、模棱两可、可能、极有可能的膀胱肌层浸润[9]。影像医师据此对膀胱癌病灶评分,从而确定肌层侵犯的风险。VI-RADS≥3分通常被认为存在肌层侵犯。VI-RADS评分标准与T分期对应关系见表1[15,21]。 VI-RADS建议在TURBT及放化疗之前行mp-MRI检查,使用膀胱示意图来标准化报告,若是多发性肿瘤应记录病灶数目、最大肿瘤的大小以及分期最高的肿瘤。膀胱肿瘤在T2WI上显示为介于尿液和肌肉之间的等信号,DWI上呈高信号,表观扩散系数(ADC)图上呈低信号,DCE-MRI上呈早期强化。VI-RADS提出影像医师应根据低信号肌层的连续性、高信号肿瘤的浸润程度以及肿瘤的早期强化程度在T2WI、DWI和DCE-MRI上对病灶单独进行评估,最终得到膀胱癌肌层侵犯的整体风险评分[22]。对于VI-RADS≤3分的肿瘤,通常将T2WI作为评分第一步,然后依次是DWI和DCE-MRI;对于VIRADS≥4分或T2WI与DCE-MRI评分不一致的肿瘤,应选择高质量DWI作为主要评分依据。小体积、扁平的无蒂肿瘤常表现为与膀胱内层相同的强化模式,这可能会导致DCE-MRI评分过高,这种情况下,T2WI和DWI可以提高诊断准确性[23-24]。VI-RADS 1-5分病灶的MRI影像及病理表现见图1-8。 3.1 VI-RADS在膀胱癌分级、分期和肌层评估的诊断效能 VI-RADS常用于治疗前明确膀胱癌分期。国内外研究表明VI-RADS在判断MIBC方面具有良好的诊断性能。2019年,Ueno等[25]首次采用受试者操作特征(ROC)曲线评估VI-RADS的诊断准确性,对74例膀胱癌病人进行回顾性研究,结果发现5名阅片者使用VI-RADS评估MIBC的合并ROC曲线下面积(AUC)为0.90。Wang等[26]对340例膀胱癌病人进行回顾性研究,结果显示VI-RADS检测肌层侵犯的AUC为0.94,VI-RADS≥3分时敏感度为87.1%,特异度为96.5%。Kim等[27]进行了类似的研究,结果显示VI-RADS≥3分时准确度、敏感度、特异度分别为63.7%、94.6%、43.9%,VI-RADS≥4分时分别为80.2%、91.3%、76.0%。2020年Woo等[28]首次对使用VI-RADS评估膀胱癌分期的研究进行了Meta分析,包括6项研究共1 770例病人,结果显示合并敏感度和合并特异度分别为0.83和0.90,AUC为0.94。Liu等[29]研究表明,当VI-RADS≥4分时,敏感度和特异度分别为94.0%和92.1%,AUC为0.97;同时对肿瘤大小、肾积水、病灶数量、VI-RADS评分等多种因素进行Logistic回归分析,结果表明VI-RADS评分是预测肌层浸润的唯一因素。国内研究者张等[30]汇总12项国内外研究进行Meta分析,研究共纳入1 508例膀胱癌病人,结果表明VIRADS诊断MIBC的合并敏感度与合并特异度分别为0.85与0.92,综合受试者操作特征(SROC)相应AUC为0.89。目前的研究大部分为回顾性,仅有几项研究前瞻性评估了VI-RADS的有效性和准确度,如2020年Del Giudice等[31]首次对231例膀胱癌病人进行前瞻性研究,结果显示VI-RADS在区分NMIBC和MIBC的准确度、敏感度及特异度分别为0.94、85.7%、86.9%。Marchioni等[32]对38例膀胱癌病人共68个病灶进行前瞻性研究,结果显示VIRADS预测MIBC的准确度为90%,敏感度和特异度分别为85.7%、86.9%。2021年Metwally等[33]纳入了多中心的331例疑似或未经治疗的膀胱癌病人,以2次TURBT病理结果为参考标准来评估VIRADS诊断膀胱癌肌层侵犯的效能,结果显示第1次VI-RADS评分预测肌层浸润的最佳截断值为3分(敏感度为84.1%,特异度为92.3%),第2次的最佳截断值为2分(敏感度为89.9%,特异度为90.1%),但VI-RADS评分为2分和3分时2次评估膀胱癌肌层侵犯的准确度分别为21.8%、45.8%和24.4%、58.3%,表明当VI-RADS评分为2和3分时预测肌层浸润的能力较局限,并不能完全替代TURBT。 图3 T1期膀胱癌病人,VI-RADS评分为2分。A图,横断面T2WI显示膀胱右后壁一13 mm×13 mm的肿物,固有肌层低信号的连续性无明确中断,评分为3分;B图,横断面DWI显示膀胱前壁高信号肿物,基底部呈低信号的增厚内层,评分为2分;C图,横断面DCE-MRI显示病灶及内层明显强化,邻近肌层无强化,评分为2分;D图,病理图上未见肌层浸润(HE,×40)。 图4 T1期膀胱癌病人,VI-RADS评分为3分。A图,横断面T2WI显示膀胱右侧壁一16 mm×11 mm的无蒂肿物,固有肌层低信号的连续性无明确中断,评分为3分;B图,横断面DWI显示膀胱右侧壁高信号肿物,评分为3分;C图,横断面DCE-MRI显示病灶明显强化,肌层无明确中断,评分为3分;D图,病理图上未见肌层浸润(HE,×40)。 图5 T2期膀胱癌病人,VI-RADS评分为4分。A图,横断面T2WI显示膀胱左侧壁一13 mm×6 mm无蒂肿物,固有肌层低信号的连续性无明确中断,评分为3分;B图,横断面DWI显示膀胱左侧壁高信号局部浸润肌层,评分为4分;C图,横断面DCE-MRI显示早期肿瘤强化,局部浸润肌层,评分为4分;D图,病理图上可见肿瘤浸润浅肌层(HE,×100)。 图6 T2期膀胱癌病人,VI-RADS评分为4分。A图,横断面T2WI显示膀胱左侧壁一12 mm×10 mm肿物,局部侵犯肌层,评分为4分;B图,横断面DWI显示膀胱左侧壁高信号肿瘤局部浸润肌层,评分为4分;C图,横断面DCE-MRI显示肿瘤早期强化,局部浸润肌层,评分为4分;D图,病理图上可见肿瘤局部浸润肌层(HE,×400)。 图7 T2期膀胱癌病人,VI-RADS评分为4分。A图,横断面T2WI显示膀胱右侧壁一36 mm×34 mm肿物,局部侵犯膀胱壁及周围脂肪组织,评分为5分;B图,横断面DWI显示膀胱右侧壁高信号肿瘤侵犯肌层,评分为4分;C图,横断面DCE-MRI显示肿瘤早期强化,局部浸润肌层,评分为4分;D图,病理图上可见肿瘤浸润肌层(HE,×100)。 图8 T3期膀胱癌病人,VI-RADS评分为5分。A图,横断面T2WI显示膀胱右侧壁一48 mm×82 mm肿物,侵犯膀胱壁及周围脂肪组织,评分为5分;B图,横断面DWI膀胱右侧壁高信号肿瘤侵犯膀胱壁及周围脂肪组织,评分为5分;C图,横断面DCE-MRI显示肿瘤早期强化,侵犯膀胱壁及周围脂肪组织,评分为5分;D图,病理图上可见肿瘤侵犯膀胱壁全层达周围脂肪组织(HE,×100)。 3.2 不同阅片者应用VI-RADS的一致性评估 可重复性是临床实践应用的重要基础,因此VI-RADS是否具有良好的观察者间一致性引起了国内外研究者的广泛关注。在大多数研究中,不同年资阅片者使用VI-RADS评估膀胱癌肌层浸润具有中度到优良的一致性,kappa值范围为0.67~0.93,组内相关系数范围为0.76~0.98[34],但大部分研究都只评估2名阅片者的一致性。Ueno等[25,35]在2019年首次评估了多名阅片者使用VI-RADS的观察一致性,5名有经验阅片者的组内相关系数为0.85;研究进一步评估了不同年资(5名有经验,2名无经验)阅片者使用VI-RADS的观察一致性,结果显示,有经验的阅片者之间、无经验的阅片者之间、有经验的阅片者与无经验的阅片者之间的观察一致性均为中等至优良,有经验的阅片者的观察一致性普遍高于无经验的阅片者。以上研究均表明VI-RADS用于评估膀胱癌肌层浸润具有较高的临床实用价值。随着多学科诊疗项目的普遍开展,泌尿科医师与影像医师对VI-RADS的解读是否一致也引起了研究者的关注。Arita等[36]比较了泌尿科医师与影像医师术前利用mp-MRI和3D T2WI评估膀胱癌是否存在肌层浸润的一致性,结果发现泌尿科医师在DCE-MRI上评估的敏感度和特异度低于影像医师,但总体VIRADS评分无显著差异。但是,目前的各项研究结果仍存在一定的差异,这可能与纳入病例数量、MR设备磁场强度、影像的层厚及VI-RADS截断值选取有关。使用VI-RADS≥3分为截断值可能有更高的敏感度,VI-RADS≥4分为截断值可能会有更高的准确度,因此不同截断值可用于不同临床情况,以减少漏诊或误诊。综上,目前尽管仍以病理结果作为参考标准,但VI-RADS能较准确评估肌层浸润状态,可用于指导临床决策和治疗。 VI-RADS的主要目的是规范膀胱癌MRI检查要求及影像报告,初步研究结果表明VI-RADS可作为评估膀胱癌局部分期的可靠诊断工具,指导临床治疗,并有可能评估病人的风险层级以及预测病人的治疗反应[21]。是否可以使用VI-RADS替代TURBT来评估膀胱癌分期,目前尚无明确结论。此外,VI-RADS有可能使部分病人避免行第2次TURBT。欧洲泌尿外科协会指南建议高危NMIBC病人或TURBT活检标本中没有肌肉的T1期膀胱癌病人行第2次TURBT[37]。Del Giudice等[31]选择114例高危NMIBC病人,比较了术前VI-RADS评分和第2次TURBT的病理结果,结果显示使用VI-RADS预测第2次TURBT病理结果具有较高的准确度。 一些研究表明MRI能较准确地预测膀胱癌侵袭性。Kobayashi等[38]采用ADC作为生物标记,结果发现鉴别高级别和低级别膀胱癌的ADC截断值为0.86×10-3mm2/s。在治疗不同阶段可以评估治疗反应。治疗前使用mp-MRI可以预测放化疗敏感性,也可以对化疗早期失败的病人进行分层,但mp-MRI对治疗反应预测范围较局限,T2WI难以区分膀胱癌和治疗后的炎症与纤维化,T2WI、DWI及DCEMRI在检测残余病灶时敏感度不佳;此外,mp-MRI对于治疗反应仅能描述为“是”或“否”[39-40]。因此,VI-RADS提供了后续发展方向,有望用5个等级反映不同程度的治疗反应。对于膀胱外组织受侵的病人,VI-RADS还被用于判断是否适合行延迟根治性膀胱切除术。Del Giudice等[41]回顾性研究表明,当肿瘤VI-RADS评分为5分时不宜采取延迟膀胱切除术,这有助于泌尿科医师筛选需要紧急根治性干预的病例。 膀胱癌的几个定量指标已被证明与肿瘤分期、分级相关,包括肿瘤大小、ADC值、DCE-MRI半定量及定量参数、纹理分析特征参数、扩散张量成像参数等。Ahn等[42]研究发现肿瘤大小、肿瘤-膀胱壁接触长度(t umor contact length,TC L)与肌层浸润有显著相关性,可以用于辅助VI-RADS。但是,肿瘤直径≥3 cm与肌层侵犯是否相关尚无统一的结论。Akcay等[43]研究发现,肿瘤ADC、TCL和肿瘤最大直径与肿瘤组织学分级显著相关,在VI-RADS评分≥3分的病人中采用TCL>19.5 mm的阈值时,诊断准确度明显提高。目前,VI-RADS中唯一考虑的定量指标是肿瘤大小(1 cm),这是VI-RADS评分为1分或2分的依据。虽然尚未将其他定量参数纳入VI-RADS,但其可作为VI-RADS的补充,以减少阅片者的主观影响。此外,有专家提出在新型冠状病毒肺炎(COVID-19)大流行期间使用VI-RADS评估膀胱癌肌层浸润可以避免有创检查,从而最大限度地减少COVID-19感染的潜在风险[44]。 综上所述,VI-RADS是鉴别MIBC及NMIBC的可靠工具,可以考虑用于临床实践;但目前该评分尚缺乏多中心、前瞻性、随机试验的大规模研究,需要进一步验证。2 VI-RADS建议与评分标准
3 VI-RADS在膀胱癌诊断中的应用




4 VI-RADS在膀胱癌中应用前景
5 小结
