胰腺腺泡细胞癌的CT及MRI表现
2021-12-08叶露李之珺李绪斌冯頔叶兆祥
叶露 李之珺 李绪斌 冯頔 叶兆祥
胰腺腺泡细胞癌(pa ncreatic acinar cell carcinoma,PAC C)是一种罕见的胰腺外分泌恶性肿瘤,占胰腺肿瘤的1%~2%[1-2],临床症状不典型,比其他常见的胰腺恶性肿瘤(如导管腺癌)预后好[3],且对化疗药物更敏感[4]。本文回顾性分析11例经病理证实的PACC的CT及MRI表现,并结合病人临床表现、实验室检查等资料,旨在提高该病术前诊断水平,从而对指导临床治疗和预后评估提供一定的影像学帮助。
1 资料与方法
1.1 一般资料 回顾性分析天津医科大学肿瘤医院2011年6月—2020年1月经手术或穿刺活检病理证实的11例PACC病人的临床、实验室检查及影像学资料。其中,男6例,女5例,年龄27~65岁,平均(49.27±14.04)岁。纳入标准:①影像检查前未行手术或穿刺等创伤性操作;②检查前未行放疗及化疗。排除标准:①影像资料不全或部分缺失;②CT或MRI影像质量不佳,影响病灶观察。11例中9例为手术病理证实,2例经转移灶穿刺活检证实。临床表现为8例腹痛,其中3例伴黄疸;3例无明显临床症状,其中2例体检发现,1例为因酒后房颤就诊偶然发现。实验室检查:3例甲胎蛋白(AFP)升高(正常值范围≤25μg/mL),4例糖类抗原19-9(CA19-9)升高(正常值范围≤37 U/mL),1例癌胚抗原(CEA)升高(正常值范围≤5μg/mL),6例血清铁蛋白(Ferr)升高(正常值范围:男性,15~200μg/L;女性,12~150μg/L),2例AFP、CA19-9、糖类抗原24-2(CA24-2)、CEA及Ferr检查均未见明显异常。5例行CT平扫及增强检查,6例行MRI平扫及增强检查。
1.2 设备与方法
1.2.1 CT平扫及增强检查 采用GE Discovery 750HD 64层螺旋CT或Siemens Definition AS+64层螺旋CT行上腹平扫及增强检查。病人检查前禁食8 h,取仰卧位,扫描范围从膈顶至左肾下极。扫描参数:管电压120 kV,自动管电流调节(50~300 mA),重建厚度为1.25~1.5 mm,层间距0,旋转时间0.6 s/r,螺矩0.984∶1,准直器宽度64×0.6 mm,视野40 cm×40 cm,矩阵512×512。增强检查采用高压注射器经肘前静脉注射碘海醇(含碘300 mg/mL,GE Healthcare),剂量为1.5 mL/kg体质量,注射流率3.0 mL/s,注射后25~30 s、50~60 s、120 s依次行动脉期、静脉期、延迟期扫描。
1.2.2 MR平扫及增强检查 采用GE HDSigna 1.5 T超导型MR成像设备,采用8通道TORSOPA腹部相控阵表面线圈。病人检查前禁食6 h,取仰卧位,腹部加压固定限制呼吸幅度,检查范围自膈上10 cm至肝下极。扫描序列及参数:①扰相梯度回波T1WI同、反相位及脂肪抑制快速恢复快速自旋回波(FR-FSE)T2WI,扫描参数:TR/TE=7 500 ms/86.66 ms,翻转角90°,层厚7 mm,层间距1 mm,激励次数(NEX)2,回波链长度(ETL)18,FOV 40 cm×40 cm,矩阵512×512;②DWI采用单次激发自旋回波-回波平面成像序列(SE-EPI)(b=0、800 s/mm2);③多期动态增强扫描(横断面及冠状面)采用三维肝脏快速容积采集(liver acceleration volume acquisition,LAVA)成像序列,高压注射器经肘前静脉以2.0 mL/s的流率推注对比剂钆喷酸葡胺(Gd-DTPA,浓度0.5 mmol/mL,德国拜尔公司),剂量0.2 mmol/kg体质量,之后以同样注射流率注入20 mL生理盐水。注射对比剂后25 s、60~70 s及120 s分别行动脉期、静脉期及延迟期扫描,延迟期后加行1次冠状面扫描,扫描参数:TR/TE=3.6/1.71 ms,翻转角15°,层厚4.6 mm,层间距2.3 mm,FOV=38 cm×38 cm,矩阵512×512。
1.3 影像分析 由1名主治医师和1名副主任医师共同阅片,意见不一致时商议后确定。观察分析内容包括:肿瘤发生部位、大小、形态、边界、密度/信号、强化方式、坏死囊变、血管、钙化、包膜、周围侵犯、淋巴结及远处转移、胆系及胰管扩张等。
1.4 病理学检查 对手术或穿刺标本行常规固定包埋、石蜡切片、HE染色及免疫组化检查。由2名具有5年以上病理诊断经验的病理科医师共同观察分析得出诊断结果。
2 结果
2.1 CT和MRI表现
2.1.1 肿瘤位置及形态 11例均为单发,表现为形态不规则结节或肿物,平扫边界显示欠清,与邻近胰腺组织分界不清。8例为实性,3例为囊实性;6例病灶位于胰头部,3例位于胰体,2例位于胰尾。病灶直径1.5~11.8 cm,平均(5.69±3.53)cm,其中>5 cm者7例,均呈外生性生长,<3 cm者3例。
2.1.2 CT表现 CT平扫影像显示,5例病变实性成分密度均较正常胰腺组织稍低且不均匀,其中1例病灶内可见钙化(图1)。增强检查显示,5例中4例病变实性成分呈不均匀渐进式强化,1例于延迟期强化程度略减低。1例因胰腺严重萎缩无法测量CT值,余4例动脉期强化程度均低于胰腺组织;延迟期3例强化程度仍低于胰腺组织(图2、3),1例略高于胰腺组织(图4)。5例病灶内均可见无强化的囊变坏死区(图2、4-6),其中3例可见供血动脉(图7),5例可见包膜,呈边缘环形或线样强化,于增强延迟期强化明显,其中4例病灶包膜局部显示不完整(图5、6)。1例胆管、胰管扩张,2例仅胰管扩张伴胰腺实质萎缩(病变均位于胰头)。1例侵犯脾动、静脉(图5)。1例累及邻近胃壁及肾上腺(图6);1例伴淋巴结转移,3例伴肝转移,1例发生膈肌、结肠壁远处转移。
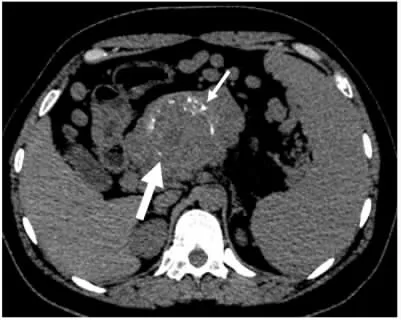
图1 病人女,31岁,胰头腺泡细胞癌。CT平扫横断面影像可见钙化(细箭)及低密度坏死区(粗箭)。

图2 病人女,48岁,胰尾腺泡细胞癌。A图,CT增强扫描动脉期横断面影像,显示胰腺组织(圈1)CT值为83.54 HU,胰尾病灶实性成分(圈2)CT值为44.92 HU,其内可见低密度囊变坏死(箭头);B图,CT增强扫描延迟期横断面影像,显示胰腺组织(圈1)CT值为97.50 HU,病灶实性成分(圈2)CT值为94.31 HU;C图,CT增强扫描时间-密度曲线显示病灶实性成分(线2)动脉期及静脉期强化程度低于正常胰腺组织(线1),至延迟期强化程度仍略低于胰腺组织。

图3 病人女,39岁,胰颈腺泡细胞癌。A图,CT增强扫描静脉期横断面影像,显示胰腺组织(圈1)CT值为130.33 HU,胰体病灶实性成分(圈2)CT值为100.64 HU;B图,CT增强扫描时间-密度曲线显示病灶实性成分(线2)强化程度至延迟期减低,各期强化程度均低于胰腺组织(线1)。

图4 病人男,62岁,胰体腺泡细胞癌。A图,CT增强扫描动脉期横断面影像,显示胰腺组织(圈1)CT值为74.88 HU,胰体病灶实性成分(圈2)CT值为51.78 HU;B图,CT增强扫描延迟期横断面影像,显示胰腺组织(圈1)CT值为69.56 HU,病灶实性成分(圈2)CT值76.74 HU,可见低密度囊变坏死(箭头);C图,CT增强扫描时间-密度曲线显示病灶实性成分(线2)呈渐进式强化,动脉期及静脉期强化程度低于胰腺组织(线1),至延迟期强化程度高于胰腺组织。

图5 病人女,31岁,胰体腺泡细胞癌。CT增强扫描静脉期横断面影像可见病变累及脾静脉伴瘤栓形成(细长箭),肿物突破包膜(细短箭),其内可见低密度坏死(粗箭)。
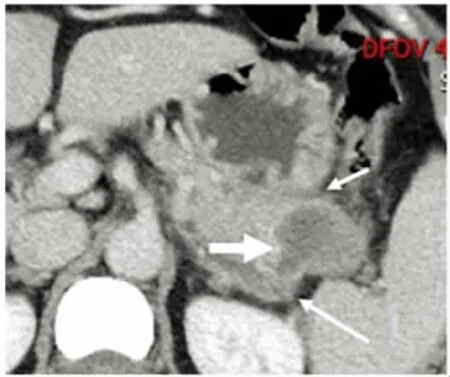
图6 病人女,48岁,胰尾腺泡细胞癌。CT增强扫描延迟期横断面影像可见肿物突破包膜,累及邻近胃壁(细短箭)及左侧肾上腺(细长箭),其内可见低密度坏死(粗箭)。

图7 病人女,63岁,胰头腺泡细胞癌。A图,手术病理标本,切面呈灰黄色,质稍脆,内可见暗红色坏死区(粗箭)及鲜红色供血动脉(细长箭),可见包膜(细短箭);B图,镜下可见肿瘤细胞呈卵圆形,排列呈腺泡状(HE,×100);C图,CT增强扫描静脉期显示大体病理标本对应的坏死灶(粗箭)、供血动脉(细长箭)及包膜(细短箭)。
2.1.3 MRI表现 6例MRI平扫影像显示,T1WI上病变实性成分较正常胰腺组织呈等或稍低信号,抑脂T2WI上呈稍高信号,DWI上呈稍高或高信号。增强检查显示,6例中5例病变实性成分呈不均匀渐进性强化,1例于延迟期强化程度略减低。6例病变动脉期强化程度均低于正常胰腺组织;5例延迟期强化程度略高于胰腺组织,1例略低于胰腺组织。3例病灶内可见无强化的囊变坏死区(图8),另外3例未见明显坏死区(病变直径1.5~2.6 cm);1例病灶内可见供血动脉。3例可见包膜,呈边缘环形或线样强化,于增强延迟期强化明显,其中2例病灶包膜局部显示不完整(图8);另外3例未见明显包膜(病变直径1.5~2.6 cm)。2例胆管、胰管均扩张(病变位于胰头),1例胰管扩张胰腺实质萎缩(病变位于胰头),1例仅远端胰管扩张(病变位于胰体)。1例侵犯肠系膜上动、静脉,1例侵犯脾动、静脉(图8)。1例累及十二指肠,2例伴淋巴结转移。

图8 病人女,65岁,胰尾腺泡细胞癌。MRI增强扫描动脉期LAVA序列横断面影像可见病灶包绕并侵犯脾动脉(细长箭),包膜不完整(细短箭),其内可见低信号坏死(粗箭)。
2.2 手术与病理 术中观察部分肿瘤可见包膜,切除肿物质硬、稍脆,切面示实性或囊实性,呈灰白、灰黄或灰红色,7例肿物内可见坏死区,呈暗红色。镜下见丰富肿瘤细胞,呈立方形或柱状,胞质丰富且含有强嗜酸性颗粒,核分裂象常见;细胞被细薄的纤维血管间质分隔,排列呈腺泡状或小梁状,间质可见出血、坏死等改变(图7B)。其中有2例伴神经内分泌癌,1例伴低分化导管腺癌。
2.3 随访结果 所有病人复查随访至2020年6月。9例行肿物完全切除术,其中4例复查未超过1年或未在本院复查而失访,5例随访病人分别在0.5~2.5年间肿瘤复发。2例穿刺确诊病人中,1例随访过程中肿瘤进展,1例未在本院复查而失访。
3 讨论
3.1 临床表现 PACC是一种十分罕见的胰腺恶性肿瘤,其发病机制及临床特点尚不明确,有研究[5]表明其与胰腺腺泡细胞在致癌因素刺激下发生基因突变有关。有文献[6-8]报道本病好发于中老年,男性多见,发病年龄为50~70岁,也可偶发于青年或儿童;而另有研究者[7,9]认为PACC发病年龄较导管细胞癌相对年轻,平均年龄仅47.8岁。本组病例平均年龄为49.27岁,与文献[9]报道结果基本相符。PACC临床表现缺乏特异性,多因腹痛、腹胀就诊,本组病例中8例因腹痛或黄疸就诊,2例体检发现,1例为酒后房颤就诊发现。PACC因肿瘤较少直接侵犯胆管,黄疸出现率较低或者出现较晚[10],本组病例中有3例发生胆系扩张并表现为黄疸,病变均位于胰头,可能与其压迫邻近胆总管有关。既往普遍认为PACC缺乏特异性肿瘤标志物,但近年研究[11]表明,部分PACC可伴有AFP升高,特别是病灶较大时,相较于其他胃肠道肿瘤标志物,如CA19-9等,AFP具有更高的特异性,PACC也被认为是少见的可引起AFP升高的胰腺原发肿瘤。本组病例中AFP升高共3例,也证实了APF对于PACC具有一定诊断价值。CA19-9的升高通常出现在胰腺肿瘤的晚期,也可以认为是PACC发生转移的重要诊断指标[12],本组4例CA19-9升高病人中3例发生淋巴结或肝脏转移。
3.2 影像表现
3.2.1 位置、大小及形态 PACC多发生于胰体尾[13],也有文献[14]报道其多发生于胰头,这可能与发生在胰头的肿瘤通常会压迫胆、胰管,临床症状较明显,从而导致收集到的病例数较多有关。本组6例位于胰头、5例位于胰体尾,发病部位无明显差异。PACC肿瘤体积通常较大,最大直径可达7.6~10.0 cm[15],这可能与其膨胀性缓慢生长的生物学行为有关[16],也与其发病部位、症状出现时间、就诊早晚有关[17]。本研究11例肿瘤平均直径(5.69±3.53)cm,>5 cm者7例,与文献[12]报道结果相符。有研究[18]显示PACC可为实性或囊实性,形态多呈不规则或分叶状,可能与其各个方向的生长速度不均匀有关,肿瘤通常呈外生性生长,突出胰腺轮廓外,边界显示不清,与周围胰腺组织分界欠清,具有一定侵袭性。本研究中8例病灶呈实性,3例呈囊实性;7例呈外生性生长,平扫边界不清。与上述文献报道的结果基本一致。
3.2.2 坏死、钙化及包膜 PACC的特征性表现为病灶内多见囊变坏死,形态不规则,无明显强化,这可能是由于腺泡细胞来源的癌细胞分泌的胰酶导致组织坏死或由于肿瘤较大而血供不足所致[13],肿瘤细胞液化坏死后形成囊变[19]。本组病例中8例可见囊变坏死,而3例直径<3 cm的病例未见有坏死。有文献[15,20]报道PACC中10%~50%可出现点状钙化,本组行CT检查的5例中,仅1例病灶内可见钙化。此外,PACC多可见包膜[21],本组病例中8例增强后可见包膜,呈线样或环形延迟强化,强化程度略高于肿瘤实性成分,可能是由于肿瘤增大导致邻近组织受压、周围反应性纤维组织增生所致,提示PACC生长方式多具有膨胀性,包膜不完整则提示肿瘤具有潜在侵袭性[15]。本组3例未见明显包膜,病变直径均<3 cm,可能与其周围组织受压、增生不明显有关;6例显示包膜不完整,部分手术病理结果显示病变侵犯包膜,累及周围脂肪组织或脏器。
3.2.3 强化特征 PACC增强表现多呈乏血供,少数呈富血供[22]。本组病例多数为轻度不均匀强化,4例各期强化程度均低于周围胰腺实质,6例延迟期强化程度略高于周围胰腺组织,其中5例为MRI增强检查显示,可能与病例采用肝脏动态增强扫描,延迟期时正常胰腺实质强化程度减低有关[23]。PACC强化方式多为渐进式持续强化,少数于延迟期轻度廓清[24],本组9例呈渐进式强化,2例至延迟期强化程度略减低,这可能与其间质内的血窦样结构及少量的纤维组织有关[11]。增强扫描后部分病变内可见穿行的供血动脉,多为脾动脉、肝固有动脉和肠系膜上动脉发出的细小分支[22],本组病例中4例可见穿行小血管。
3.2.4 胰管、胆管扩张及转移 PACC较少引起胰管及胆管扩张[25],可能由于其多呈外突膨胀性生长,并且较少沿胰管浸润性生长,本研究共7例发生胰管扩张,可能是由于肿瘤体积较大,压迫胰管所致;肿物位于胰头部则较易出现“双管征”,可能由于胰头部周围空间较小,当瘤体较大时压迫邻近走行的胆总管所致。本组病例中3例发生胆、胰管扩张,病变均位于胰头。与胰腺导管细胞癌相似,PACC易发生脾血管受累及腹膜后淋巴结转移[26],本组中有2例侵犯脾动、静脉,1例侵犯肠系膜上动脉,3例出现淋巴结转移。远处转移最常见的部位是肝脏,本研究中有3例,与文献[26]报道结果基本相符。
3.3 预后及复发 PACC的治疗以手术切除为首选方法,术后复发率较高,配合化疗、放疗等综合治疗可显著改善病人预后。有研究[3]显示PACC病人5年生存率为21.4%,高于胰腺导管细胞癌5年生存率9.7%。本研究中6例病人在2.5年内发生肿瘤复发、转移或进展,这可能由于部分病人随访时间不足1年或失访,导致本组随访例数较少,加上部分病例发现时肿瘤体积较大且已累及周围结构,导致本组病例预后不佳。
3.4 鉴别诊断 ①胰腺导管细胞癌:是最常见的胰腺原发恶性肿瘤,多见于老年男性,好发于胰头,肿瘤体积较小,边界不清,无包膜,多呈浸润性生长,具有噬神经、血管生长特征,多伴胆系及胰管扩张,形成“双管征”;乏血供肿瘤,增强检查呈轻度强化,少见钙化;常伴有淋巴结及远处器官转移。②胰腺实性假乳头状瘤:多见于青年女性,体积较大,多呈类圆形,呈外生性生长,边界较清,有包膜,富血供肿瘤,增强后呈渐进式延迟强化;可见囊变、坏死;较少出现胆管、胰管扩张。③胰腺神经内分泌肿瘤:富血供肿瘤,增强检查呈明显强化,功能性内分泌肿瘤体积较小、密度均匀;无功能性内分泌肿瘤体积较大,其内可见囊变、坏死。④胰腺囊腺瘤:分为浆液性和黏液性,多见于中年女性,多呈类圆形囊性为主肿块,体积较大,边界清,增强后其内可见分隔及壁结节,囊性成分无强化;黏液性囊腺瘤可见囊壁钙化。
综上所述,PACC发病率低,临床及影像表现缺乏特异性,以下表现对其诊断具有一定提示作用:体积较大、呈不规则或分叶状、外生性生长肿块,可见包膜、多不完整,多见囊变、坏死,增强检查多呈乏血供,渐进性强化,动脉期强化程度低于胰腺组织,至延迟期强化程度低于或略高于胰腺实质,位于胰头部肿物可伴胆胰管扩张,位于胰体尾可伴脾动、静脉受累,可发生淋巴结及远处转移;实验室检查可见肿瘤标志物,尤其是AFP升高。
