多组分运动处方对认知衰弱老年人的影响研究
2021-12-07叶明李书国朱正庭朱慧铭
叶明,李书国,朱正庭,朱慧铭
老年人健康管理的重点是功能状态,而不是仅关注疾病或共病。衰弱和认知障碍是常见的影响功能状态的老年综合征,两者常同时发生,相互作用,有共同的病理生理基础,同时影响患者的多个生理系统,导致跌倒、骨折、功能缺损,甚至死亡等后果[1]。国际营养与衰老学会及国际老年医学协会提出“认知衰弱”的概念[2]。认知衰弱表现为双向进程,通过合适的干预可逆转轻度认知功能障碍和衰弱前期[3],但发展到残疾或失能,则很难逆转。认知障碍和衰弱,是包含了生理、心理、环境、社会等因素的多维度综合征,但目前很多的临床干预研究都局限在药理、营养等方面,TSUGAWA等[4]研究发现运动处方可以改善老年患者的心肺功能、心理状态、日常生活能力、社交能力,减少住院费用等,有生物-心理-社会综合干预的部分特点,可能是防治老年人认知衰弱的一种有效方法。本研究对比分析不同时间点对照组和多组分运动处方组认知衰弱患者衰弱指标、认知功能评分、膳食摄入量、营养指标的差异,以期对认知衰弱患者的干预提供新的思路。
1 对象与方法
1.1 研究对象 2017年1月—2018年12月在宜昌市中心人民医院选取符合研究要求的老年科住院及门诊老年患者90例为研究对象,采用随机数字法将所有患者分为对照组45例和运动组45例。纳入标准:(1)确诊为轻度认知障碍,参照Petersen标准诊断:①主诉记忆力障碍,且有知情者证实;②总体认知功能正常;③日常生活能力正常;④客观检查(如神经心理检查)存在某一认知方面的变化,或与年龄、受教育程度不相符的记忆损害;⑤未达到痴呆诊断[5]。每个病例认知功能评估由3位中、高年资老年神经科医师根据病史、体检、量表测试成绩共同诊断。(2)Fried衰弱表型得分≥3分[2]。排除标准:(1)有晚期、严重、急性、亚急性,或不稳定的其他疾病,影响指标观察和安全性(如肿瘤、严重心脑疾病,近6个月内有过严重感染、消化道出血、骨折、深静脉血栓、活动性癫痫等);(2)诊断为阿尔茨海默病或其他类型痴呆,阿尔茨海默病或其他类型痴呆诊断标准:满足美国国立衰老研究所和阿尔茨海默病协会(NIA-AA)2011年痴呆的临床核心诊断标准及美国精神障碍诊断与统计手册第五版(DSM-Ⅴ)重度神经认知障碍诊断标准[6];(3)患有抑郁症;(4)近2周曾服用可引起认知改变、平衡障碍或损害重要脏器的药物,或长期服用5种以上药物;(5)Barthel指数<50分,独立站立行走能力<10 m。本研究所有入组患者及家属知情同意。
1.2 方法
1.2.1 对照组 由老年病科营养师进行老年营养健康宣教,内容包括:推荐进餐频率为三餐两点,相对固定进餐时间,加餐主要以奶类、坚果类为主。推荐进餐种类及量约为每日谷薯类 300 g,蔬菜 400 g,水果 300 g,液态奶 300 g,鱼虾 150 g,禽肉 /畜肉 150 g,蛋 50 g,豆或豆制品30 g,适量菌藻类。推荐制作方法为炖、煮、蒸、烩、焖、烧等烹调方法,少煎炸、熏烤等。建议水果切块,鱼虾肉制成食糜,坚果借助工具及烹饪,便于老年患者咀嚼,增加依从性。
1.2.2 多组分运动处方组 在老年营养健康宣教的基础上,进行多组分运动处方12周。最初2周,由老年科康复师每天指导,社区全科医师及家属全程参与;第3~12周,在社区卫生服务中心或家庭进行,社区全科医师及家属陪护、指导,老年病科康复师每2周随访一次。多组分运动处方包括有氧运动、抗阻运动、平衡训练和柔韧训练。每周3次,45 min/次;强度:Borg主观用力程度分级量表(rating of perceived exertion,RPE)[7]得分为12~14分。运动方式及步骤:第1步有氧运动5 min,采取快步走或慢跑;第2步抗阻运动20 min,采用弹力带训练,由老年科康复师设计具体肌群的训练方法,随着患者抗阻运动能力的提高,逐步提高阻力负荷,期间依据患者情况可休息2~3 min;第3步平衡训练10 min,患者自由组合双足尖站立、直线行走、单腿站立等;第4步柔韧训练10 min,太极拳练习。
1.3 观察指标 分别在基线期、干预3个月和6个月时,由经过老年综合评估集中培训的老年科医师、社区全科医师(评估医师不参与试验干预),对对照组和多组分运动处方组患者进行评估。
1.3.1 衰弱指标 (1)6 m步行时间,评估下肢肌肉功能,>7.5 s为步速减退[8];(2)握力,评估上肢肌肉功能,男性<30 kg,女性<20 kg为肌力减低,握力正常值随年龄增长而递减[9];(3)Fried衰弱表型评分,共5个项目,包括自然体质量下降、自我感觉疲乏、活动减少、步速减慢和握力减弱,每个项目评测异常得1分,正常得0分,通过计算5个项目总得分来判断衰弱情况。Fried衰弱表型评分≥3分则评估为衰弱[2]。
1.3.2 蒙特利尔认知评定量表(montreal cognitive assessment test,Mo-CA)评分 采用 2015 Mo-CA 基本版包括:执行功能(1分)、即刻记忆(不计分)、词语流畅性(2分)、定向力(6分)、计算(3分)、抽象推理(3分)、延迟回忆(5分)、视知觉(3分)、命名(4分)、注意(3分),总分30 分。受教育年限<4年加1分,不识字加1分,测试时间约10 min。轻度认知障碍的分界值为:受教育年限≤6年为19分,受教育年限7~12年为22分,受教育年限>12年为24 分[10]。
1.3.3 食物频率法问卷调查(food frequency questionnaire,FFQ) 回顾评估患者的膳食摄入量[11]。
1.3.4 营养指标 (1)实验室检查:抽取静脉血,采用日本日立7600(020)全自动生化分析仪测定清蛋白、前清蛋白、转铁蛋白、淋巴细胞计数等;(2)简易营养评估评分(mini nutritional assessment,MNA):①人体测量包括体质指数、肱三头肌皮皱厚度、上臂围、上臂肌围、小腿围和体质量丢失情况6项;②综合评价包括生活类型、医疗情况、用药情况、活动能力4项;③膳食问卷包括餐次、食物种类、摄入量、自主进食情况4项;④主观评定:对自身健康及营养状况的评价。上述16个评分相加为MNA总分。结果判定标准为MNA>24分为营养状况良好,17分<MNA<23.5分为有营养不良风险,MNA<17分为营养不良[12]。
1.4 统计学方法 采用SPSS 19.0统计软件对所有数据进行分析。计数资料以相对数表示,组间比较采用χ2检验;计量资料以(±s)表示,两组间比较采用两样本t检验,两组不同时间点比较采用重复测量方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料 研究对象年龄在60~85岁,平均年龄(72.6±6.7)岁;受教育年限9~15年,平均受教育年限为(11.0±1.9)年。两组认知衰弱患者性别、年龄、受教育年限、体质指数(BMI)及基线期收缩压、空腹血糖、糖化血红蛋白、血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、内生肌酐清除率(Ccr)比较,差异无统计学意义(P>0.05,见表1)。
2.2 两组认知衰弱患者的衰弱指标比较 两组6 m步行时间、握力、Fried衰弱表型评分比较,差异有统计学意义(P<0.05);不同时间点3个指标比较,差异有统计学意义(P<0.05);组别和时间在各指标得分上存在交互作用(P<0.05)。干预3个月、6个月,运动组的6 m步行时间、Fried衰弱表型评分均低于对照组(P<0.05),握力均高于对照组(P<0.05);干预3个月、6个月,运动组的6 m步行时间、Fried衰弱表型评分均低于基线(P<0.05),握力均高于基线(P<0.05,见表2)。
2.3 两组认知衰弱患者的Mo-CA评分比较 两组认知衰弱患者的Mo-CA评分比较,差异有统计学意义(P=0.016);不同时间点Mo-CA评分比较,差异有统计学意义(P<0.001);组别和时间在得分上无交互作用(P>0.05)。干预3个月、6个月,运动组的Mo-CA评分高于对照组,差异有统计学意义(P<0.05);干预3个月、6个月,运动组的Mo-CA评分高于基线(P<0.05,见表3)。

表1 两组认知衰弱患者的一般资料比较Table 1 Comparison of general information between two groups of cognitive frailty patients
表2 两组认知衰弱患者的衰弱指标比较( ±s)Table 2 Comparison of pre- and post-intervention frailty indicators of two groups of cognitive frailty patients

表2 两组认知衰弱患者的衰弱指标比较( ±s)Table 2 Comparison of pre- and post-intervention frailty indicators of two groups of cognitive frailty patients
注:与对照组比较,aP<0.05;与基线比较,bP<0.05
images/BZ_88_1057_1556_1079_1586.pngimages/BZ_88_1665_1556_1687_1586.png组别 例数 6 m步行时间(s) 握力(kg) Fried衰弱表型评分(分)基线 干预3个月 干预6个月 基线 干预3个月 干预6个月 基线 干预3个月 干预6个月对照组 45 9.18±1.89 8.94±1.91 9.32±1.31 17.19±4.75 18.77±3.72 18.21±5.37 3.96±0.71 3.93±0.62 4.01±0.32运动组 45 9.21±2.11 5.73±1.72ab 5.31±1.10ab 17.83±5.11 25.13±4.97ab 25.27±3.14ab 3.95±0.61 1.89±0.51ab 1.01±0.21ab F值 F组间=5.605,F时间=48.828,F交互=5.673 F组间=13.300,F时间=21.254,F交互=3.541 F组间=7.069,F时间=12.462,F交互=9.243 P值 P组间=0.020,P时间<0.001,P交互=0.001 P组间=0.001,P时间=0.001,P交互=0.021 P组间=0.005,P时间<0.001,P交互<0.001
表3 两组认知衰弱患者的Mo-CA评分比较( ±s,分)Table 3 Comparison of pre- and post-intervention Mo-CA scores of two groups of cognitive frailty patients

表3 两组认知衰弱患者的Mo-CA评分比较( ±s,分)Table 3 Comparison of pre- and post-intervention Mo-CA scores of two groups of cognitive frailty patients
注:Mo-CA=蒙特利尔认知评定量表;与对照组比较,aP<0.05;与基线比较,bP<0.05
组别 例数 基线 干预3个月 干预6个月对照组 45 21.39±1.17 21.27±1.39 22.21±3.05运动组 45 21.19±1.01 24.01±1.68ab 26.89±1.91ab F值 F组间=4.328,F时间=8.456,F交互=0.751 P值 P组间=0.016,P时间<0.001,P交互=0.475
2.4 两组认知衰弱患者的膳食摄入量比较 两组蔬菜、水果、鱼虾、禽肉/畜肉、蛋、液态奶、坚果类的摄入量比较,差异有统计学意义(P<0.05);不同时间点上述7个指标比较,差异有统计学意义(P<0.05);组别和时间在上述7个指标存在交互作用(P<0.05)。干预3个月,运动组的蔬菜、水果、鱼虾、蛋、液态奶摄入量均高于对照组(P<0.05);干预6个月,运动组蔬菜、水果、鱼虾、禽肉/畜肉、蛋、液态奶、坚果类的摄入量均高于对照组(P<0.05)。干预3个月、6个月,运动组的蔬菜、水果、鱼虾、禽肉/畜肉、蛋、液态奶、坚果类摄入量均高于基线(P<0.05);干预3个月时,对照组的蔬菜、水果、鱼虾、禽肉/畜肉、蛋、液态奶、坚果类摄入量较基线增加(P<0.05);干预6个月时,对照组的水果、鱼虾、禽肉/畜肉、蛋、坚果类摄入量较基线增加(P<0.05,见表4)。
2.5 两组认知衰弱患者的营养指标比较 两组清蛋白、前清蛋白、转铁蛋白、淋巴细胞计数、MNA评分比较,差异有统计学意义(P<0.05);不同时间点5个指标比较,差异有统计学意义(P<0.05);组别和时间在各指标得分上存在交互作用(P<0.05)。干预3个月、6个月,运动组的清蛋白、前清蛋白、转铁蛋白、淋巴细胞计数、MNA评分均高于对照组,差异有统计学意义(P<0.05)。干预3个月、6个月,运动组的清蛋白、前清蛋白、转铁蛋白、淋巴细胞计数、MNA评分均高于基线(P<0.05);3个月时,对照组的清蛋白、前清蛋白、转铁蛋白高于基线(P<0.05,见表5)。
表4 两组认知衰弱患者的膳食摄入量比较( ±s,g/d)Table 4 Comparison of pre- and post-intervention dietary intakes of two groups of cognitive frailty patients
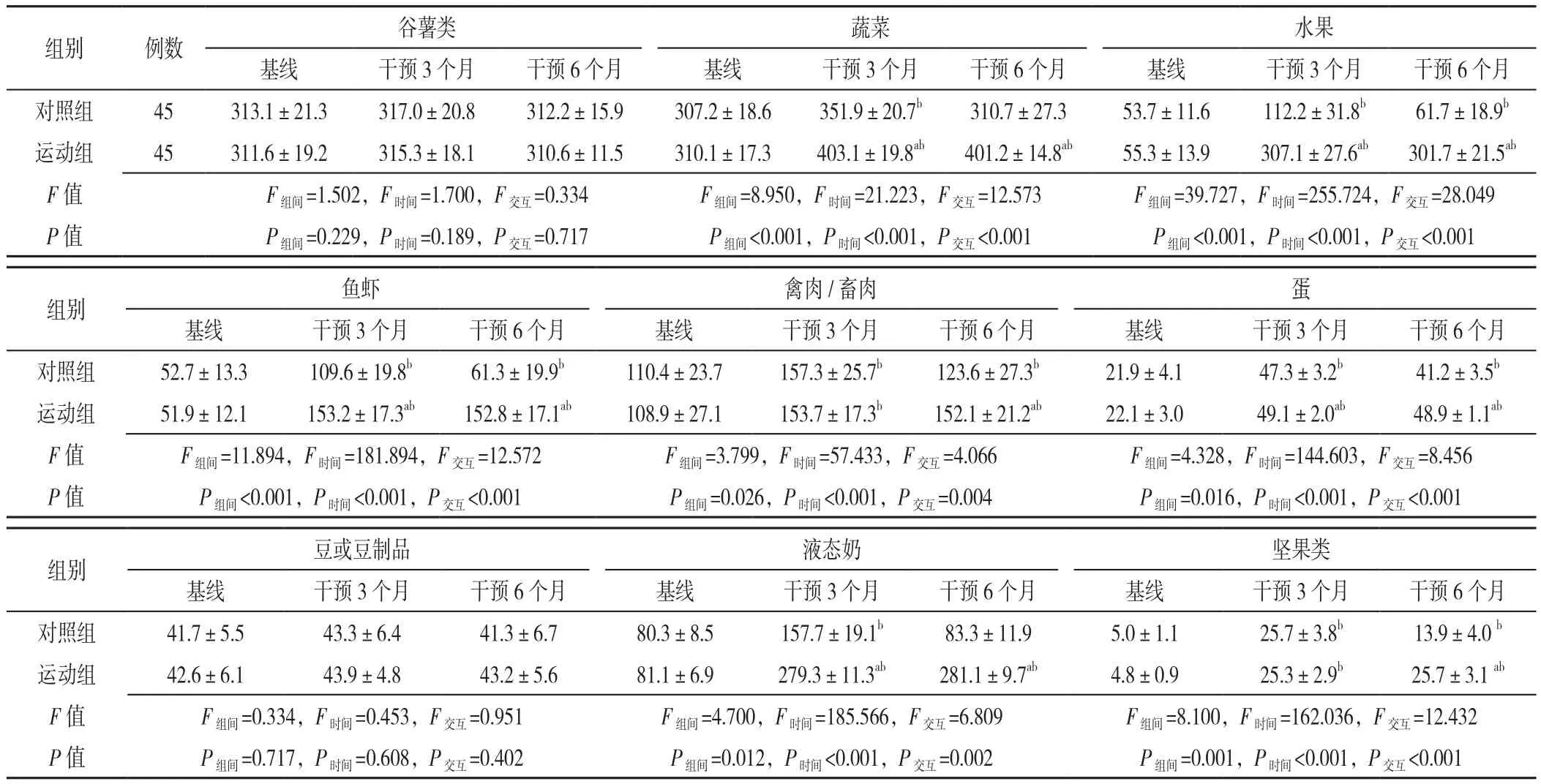
表4 两组认知衰弱患者的膳食摄入量比较( ±s,g/d)Table 4 Comparison of pre- and post-intervention dietary intakes of two groups of cognitive frailty patients
注:与对照组比较,aP<0.05;与基线比较,bP<0.05
组别 例数 谷薯类 蔬菜 水果基线 干预3个月 干预6个月 基线 干预3个月 干预6个月 基线 干预3个月 干预6个月对照组 45 313.1±21.3 317.0±20.8 312.2±15.9 307.2±18.6 351.9±20.7b 310.7±27.3 53.7±11.6 112.2±31.8b 61.7±18.9b运动组 45 311.6±19.2 315.3±18.1 310.6±11.5 310.1±17.3 403.1±19.8ab 401.2±14.8ab 55.3±13.9 307.1±27.6ab 301.7±21.5ab F值 F组间=1.502,F时间=1.700,F交互=0.334 F组间=8.950,F时间=21.223,F交互=12.573 F组间=39.727,F时间=255.724,F交互=28.049 P值 P组间=0.229,P时间=0.189,P交互=0.717 P组间<0.001,P时间<0.001,P交互<0.001 P组间<0.001,P时间<0.001,P交互<0.001images/BZ_88_1057_2105_1079_2135.pngimages/BZ_88_1665_2105_1687_2135.png组别 鱼虾 禽肉/畜肉 蛋基线 干预3个月 干预6个月 基线 干预3个月 干预6个月 基线 干预3个月 干预6个月对照组 52.7±13.3 109.6±19.8b 61.3±19.9b 110.4±23.7 157.3±25.7b 123.6±27.3b 21.9±4.1 47.3±3.2b 41.2±3.5b运动组 51.9±12.1 153.2±17.3ab 152.8±17.1ab 108.9±27.1 153.7±17.3b 152.1±21.2ab 22.1±3.0 49.1±2.0ab 48.9±1.1ab F 值 F组间=11.894,F时间=181.894,F交互=12.572 F组间=3.799,F时间=57.433,F交互=4.066 F组间=4.328,F时间=144.603,F交互=8.456 P 值 P组间<0.001,P时间<0.001,P交互<0.001 P组间=0.026,P时间<0.001,P交互=0.004 P组间=0.016,P时间<0.001,P交互<0.001images/BZ_88_985_2459_1007_2489.pngimages/BZ_88_1626_2459_1648_2489.pngimages/BZ_88_985_2818_1007_2848.png组别 豆或豆制品 液态奶 坚果类基线 干预3个月 干预6个月 基线 干预3个月 干预6个月 基线 干预3个月 干预6个月对照组 41.7±5.5 43.3±6.4 41.3±6.7 80.3±8.5 157.7±19.1b 83.3±11.9 5.0±1.1 25.7±3.8b 13.9±4.0 b运动组 42.6±6.1 43.9±4.8 43.2±5.6 81.1±6.9 279.3±11.3ab 281.1±9.7ab 4.8±0.9 25.3±2.9b 25.7±3.1 ab F 值 F组间=0.334,F时间=0.453,F交互=0.951 F组间=4.700,F时间=185.566,F交互=6.809 F组间=8.100,F时间=162.036,F交互=12.432 P 值 P组间=0.717,P时间=0.608,P交互=0.402 P组间=0.012,P时间<0.001,P交互=0.002 P组间=0.001,P时间<0.001,P交互<0.001images/BZ_88_1626_2818_1648_2848.png
3 讨论
认知障碍和衰弱相互作用,导致老年患者渐进性失能,两者有一些共同的生物学和临床基础,如:基因突变(如APO-E4),海马、前额叶皮质的氧化损伤与功能改变,慢性低度炎症,常见脑病理改变(如阿尔茨海默病病理、微梗死、黑质神经元丢失等),心脑血管病危险因素的暴露,行为因素(例如低学历、不健康饮食模式、低体力和脑力活动、吸烟、嗜酒),抑郁等[13]。2013年国际营养与衰老学会和国际老年医学协会提出了“认知衰弱”概念。针对上述生物、临床基础,早期干预认知衰弱患者,可能逆转病程。既往对认知衰弱实行干预的研究主要集中在神经标志物、药理、神经认知、营养等方面[14]。关于运动处方对认知衰弱的潜在疗效和功能维持,研究结论并不多。
有研究认为多组分运动是老年衰弱患者最有益的运动类型,CADORE等[15]发现有氧运动(如步行),对合并痴呆的衰弱患者有保护作用,增加每天的步行距离和强度(减少辅助器械),老年患者可获益;抗阻运动对衰弱患者有增强力量的作用,老年衰弱患者12周抗阻运动不仅改善步速,也可改善自主生活能力,避免跌倒。平衡训练对衰弱前期和衰弱期都很重要[16],尤其是衰弱前期。柔韧训练对轻度认知障碍、衰弱有积极影响[17]。多项研究显示:老年衰弱前期患者应每周运动2~3次,每次45~60 min,包括有氧运动、抗阻运动、平衡训练和柔韧训练,强调抗阻运动、平衡训练。老年衰弱患者应每周运动3次,每次30~45 min,包括有氧运动、抗阻运动、平衡训练和柔韧训练,强调有氧运动。衰弱前期和衰弱期患者的运动强度均推荐RPE得分12~14分之间(“稍费力”)[18]。专业人士指导的多组分运动对老年衰弱和认知最有利[19]。家庭运动可以补充但不能完全取代专业人士监管,家属需足够配合监督老年患者运动的安全和有效实施[20]。本研究多组分运动处方设计参考了上述研究结果,包含有氧运动、抗阻运动、平衡训练和柔韧训练,设计合理的运动频率、时间、强度、步骤。前期由老年科康复师专业指导,社区全科医师及家属全程参与;中期,由社区全科医师及家属指导、陪护,医院老年病科康复师随访。强调社区全科医师及家属对患者的指导及陪护作用,对老年患者可保持积极的影响,增强患者的运动依从性[21]。本次研究中无老年患者及家属要求中途退出试验,一定程度上表明多组分运动具有可行性、耐受性、依从性[22]。
多组分运动是改善衰弱前期和衰弱期的有效干预措施,可使患者利用自身潜能克服障碍。对长期照护老年患者进行多组分运动干预后,患者功能状态改善,尤其是步行、平衡和有氧运动能力[23]。有研究认为多组分运动是改善老年衰弱患者认知障碍、痴呆、自主生活能力,降低跌倒风险的最佳方法之一[15]。一项针对社区老年衰弱患者的研究证实,与对照组相比,运动组可逆转衰弱,改善认知功能及社会能力等[24-25]。多组分运动对合并轻度认知障碍/痴呆的衰弱前期/衰弱期老年患者的认知功能和衰弱状态均有改善。对衰弱有效的运动也可改善认知功能,反之亦然[15]。本研究显示多组分运动处方组与对照组及基线比较,干预3个月、6个月衰弱指标均有好转,轻度认知障碍减轻,提示多组分运动对认知衰弱患者的衰弱和认知均有改善。研究显示:运动干预的衰弱患者,在多个时间点,患者的移动能力、力量、认知等方面均有明显提高,3个月时大多数指标改善明显,3个月后未再进一步干预,但18个月时改善仍然明显,显示出较长的持续效应[21]。本研究多组分运动干预的时间是12周,结果显示:3个月和6个月都观察到6 m步行时间、Fried衰弱表型评分减少,握力增加,以及Mo-CA评分增高,支持多组分运动改善衰弱和认知具有延续效应。多组分运动改善认知衰弱可能与运动影响部分脑源性神经因子的表达有关,这些神经因子可调节大脑的可塑性和功能。认知修复与衰弱改善之间存在协同效应,可能与患者的社会能力和自主生活能力间接增强有关[24]。
表5 两组认知衰弱患者的营养指标比较( ±s)Table 5 Comparison of pre- and post-intervention nutritional indices of two groups of cognitive frailty patients

表5 两组认知衰弱患者的营养指标比较( ±s)Table 5 Comparison of pre- and post-intervention nutritional indices of two groups of cognitive frailty patients
注:MNA评分=简易营养评估评分;与对照组比较,aP<0.05;与基线比较,bP<0.05
组别 例数 清蛋白(g/L) 前清蛋白(mg/L) 转铁蛋白(g/L)基线 干预3个月 干预6个月 基线 干预3个月 干预6个月 基线 干预3个月 干预6个月对照组 45 30.91±1.39 32.91±3.15b 30.88±1.93 160.39±19.25 171.89±20.31b 167.23±23.51 2.29±0.17 2.99±0.27b 2.31±0.53运动组 45 30.63±1.57 34.73±1.91ab 36.95±1.89ab 160.76±19.01 233.21±20.17ab 253.17±21.93ab 2.33±0.24 3.39±0.12ab 3.41±0.12ab F 值 F组间=5.710,F时间=8.215,F交互=4.258 F组间=19.439,F时间=396.792,F交互=25.164 F组间=9.547,F时间=8.987,F交互=5.590 P 值 P组间=0.034,P时间=0.011,P交互=0.021 P组间<0.001,P时间<0.001,P交互<0.001 P组间=0.013,P时间=0.021,P交互=0.002images/BZ_89_1008_2459_1029_2489.pngimages/BZ_89_1641_2459_1662_2489.png组别 淋巴细胞计数(×109/L)images/BZ_89_1349_2818_1370_2848.pngMNA评分(分)基线 干预3个月 干预6个月 基线 干预3个月 干预6个月对照组 0.43±0.12 0.45±0.19 0.46±0.17 14.83±2.23 15.27±1.97 15.21±1.22运动组 0.41±0.15 1.99±0.19 ab 2.11±0.11 ab 14.81±2.31 20.71±1.12ab 21.13±1.97ab F 值 F组间=19.574,F时间=124.272,F交互=23.587 F组间=16.547,F时间=65.154,F交互=15.548 P 值 P组间<0.001,P时间<0.001,P交互<0.001 P组间<0.001,P时间<0.001,P交互<0.001
认知衰弱患者不同程度地难以维持健康的生活、饮食习惯,很多表现为摄入少、低能耗的特征[26]。常在清醒状态下保持静坐模式,以坐位或半卧位为主[27]。认知衰弱的进展与静坐模式,能量消耗及食物摄入减少,代谢细胞质量降低等有关,而消耗少、静坐模式与食物摄入少互为因果,相互关联[28]。运动不仅对老年患者的消耗少、静坐模式存在直接有益影响,还可改善老年患者的营养风险,改变摄入少、低能耗的生活饮食习惯。一项前瞻性干预研究显示:对患者进行健康教育和定量运动干预可以增加膳食中微量元素的摄入量[29]。巴西的一项研究显示运动可增加能量、镁、钾和磷等的摄入[30]。一项包含了159例老年衰弱患者的研究,对患者进行营养及运动干预,结果显示运动对感觉、食欲、食物摄入量有积极影响,营养干预则对此三项无明显改善[31]。本研究结果显示对照组经营养健康宣教后,食物摄入量、营养指标较基线时有部分提高,但效果明显不如运动组,提示多组分运动对食物摄入量、营养指标均有益;另外,对照组6个月时营养指标比基线无改善,食物摄入量的改善比自身3个月时进一步缩减,提示尽管老年营养健康宣教是管理老年衰弱患者的主要方法之一,但患者对这种单一的干预方式依从性欠佳,健康的饮食习惯难以维持。与对照组不同,运动组患者表现出运动处方停止约3个月后,食物摄入量在6个月时较3个月进一步改善,营养指标好转,考虑经多组分运动处方后,患者更主动地持续改变饮食习惯。NYNKE等[31]研究表明老年患者运动后会主动改变饮食习惯,潜在机制可能是运动提高了全身蛋白质代谢率,缩短胃肠道转运时间,刺激摄入的蛋白在人体内再合成。
本研究表明多组分运动处方是对认知衰弱有效、合理的干预,应用到医疗保健专业人员的临床实践中,可能有利于老年认知衰弱患者逆转病程。多组分运动处方具有实施方法和场所的可延展性,通过加强社区全科医师和家庭的积极作为,可能有效地惠及更多老年患者。然而,本次研究样本量较少,需要更多的临床样本数据来进一步综合分析。
作者贡献:叶明负责文章的构思与设计、数据整理、统计学处理、结果的分析与解释、论文撰写、文章的质量控制及审校,对文章整体负责,监督管理;李书国负责可行性分析、英文修订;朱正庭、朱慧铭负责研究的实施,数据收集;叶明、李书国负责论文的修订。
本文无利益冲突。
