基于星形胶质细胞条件培养基的OPC制备技术探索
2021-12-07许雯铱李聪慧杨俊林
杨 莹,许雯铱,2,李聪慧,2,杨俊林,2
(1. 杭州师范大学生命与环境科学学院,浙江 杭州 311121; 2. 浙江省器官发育与再生技术研究重点实验室,浙江 杭州 311121)
少突胶质细胞(oligodendrocyte,OL)是中枢神经系统中包裹轴突形成髓鞘的大胶质细胞,它们负责产生髓鞘,并且在保持轴突完整性以及电脉冲沿轴突快速有效传导等方面发挥至关重要的作用.少突胶质细胞由少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)分化成熟而来[1].OPCs是一种潜在的干细胞,能分化成为少突胶质细胞,进而促进中枢神经系统髓鞘的形成[2].同时,OPCs是脱髓鞘病变中髓鞘再生的主要种子细胞[3],因此,它们除了被广泛用于脱髓鞘疾病致病机理的研究之外,在移植治疗脱髓鞘疾病方面也具有广阔的应用前景[4].此外,OPCs在发育过程中参与维持血脑屏障的完整性,其移植可以减少血脑屏障的渗漏,是治疗缺血性脑卒中的新途径[5].OPCs移植到受损的中枢神经系统中还可以治疗脊髓损伤[6].目前,小鼠OPCs主要通过培养小鼠大脑皮层组织获得[7],但是所获OPCs的数量和质量依赖于培养时所使用的胎牛血清,即使同一品牌的血清也存在批次间的差异,常常使得OPC的制备充满不确定性[4],导致小鼠OPC的制备充满挑战性[8].鉴于星形胶质细胞在发育过程中能够分泌一些生长因子来促进OPCs的存活和增殖[7],如PDGFaa、bFGF、EGF等,本研究拟利用这一特点,探索建立一种比较稳定的OPC制备体系,以满足对OPCs日益增长的需要.
1 材料和方法
1.1 材料
ICR新生小鼠(P0);D/F20S培养基(79% DMEM/F-12培养基;20%胎牛血清;1% Penicillin-Streptomycin(双抗));星形胶质细胞条件培养基(ACM)、抗体、24孔板、细胞培养瓶等.
1.2 小鼠大脑皮层组织原代培养
解剖、获得ICR小鼠大脑皮层组织的方法参考已有的文献报道[9],所有实验程序都按照实验动物护理和使用的准则进行,该准则得到了杭州师范大学动物伦理委员会的批准.简要概括如下:首先对ICR新生小鼠喷洒70%乙醇后于4 ℃冰箱中低温麻醉,然后取出小鼠再次喷乙醇消毒.用剪刀剪下小鼠脑袋,置于盛有1×PBS缓冲液的培养皿中,洗去多余的血液,然后于一新的盛有1×PBS缓冲液的培养皿中解剖出小鼠大脑皮层,用镊子将皮层组织上的脑膜轻轻撕除.将大脑皮层转移到新培养皿中,用镊子将大脑皮层夹碎成约1 mm3大小的组织块,加入适量的D/F20S培养基后接种于包被有PDL的T75培养瓶中,在37 ℃、5% CO2的培养箱中培养,前两天不移动培养瓶,保证组织能够更好地贴壁.2 d后,首次更换新鲜培养液,之后隔天换液,直到细胞长至汇合.
1.3 ACM的制备
等上述小鼠大脑皮层组织原代培养的细胞长至汇合,将培养瓶置于恒温摇床上以200 r/min的转速摇培2 h,去除小胶质细胞,去上清后换上新鲜培养基,在培养箱中额外培养2 h以上,以平衡培养体系的pH值.然后再次置于摇床上以250 r/min的转速摇过夜(12~15 h),通过去掉培养上清的方式去除OPCs,从而达到纯化小鼠星形胶质细胞的目的[10].接着向培养瓶中加入普通培养基连续培养星形胶质细胞4 d[4],使星形胶质细胞分泌足够多的生长因子到培养液中,收获培养上清之后经孔径为0.22 μm的过滤器过滤即得到ACM.
1.4 小鼠星形胶质细胞饲养层的制备
按照1.3中所描述的方法去除新生小鼠大脑皮层组织原代培养物中的小胶质细胞和OPCs,然后用0.05%的胰蛋白酶将培养瓶中的星形胶质细胞消化下来,经台盼蓝染色及细胞计数之后,按照6×104个/cm2的密度接种活细胞到细胞培养孔内[11],过夜培养使细胞贴壁.第2天更换培养基,除去未贴壁的细胞,然后加入20 μg/mL的丝裂霉素处理星形胶质细胞2 h,使其停止细胞分裂[4,12],即获得纯化处理的小鼠星形胶质细胞饲养层.
1.5 小鼠大脑皮层组织消化成单细胞
经解剖获得小鼠大脑皮层,于培养皿中将其剪碎成约1 mm3大小的组织块,加入0.05%胰蛋白酶于37 ℃、5% CO2培养箱中孵育15 min,期间每隔5 min用1 mL移液枪的枪头吹打液体.15 min后加入含有血清的培养基终止消化[7],之后将细胞悬液转移到15 mL离心管中,以3 000 r/min的转速离心5 min,丢弃上清液,加10 mL培养基重悬细胞,3 000 r/min的转速离心5 min.重复此操作2~3次后,加入适量培养基重悬细胞,细胞悬液用孔径为70 μm的滤网过滤,除去组织碎块,得到单细胞悬液.
1.6 免疫荧光染色
吸出培养孔内的培养基,在孔内加入4% PFA对细胞进行固定,用以保护细胞形态,避免细胞变质[13].30 min后吸出PFA,用1×PBS洗3遍,每遍10 min.然后加入封闭液(含10%山羊血清和0.1% Triton的PBS)后静置1 h,封闭非特异性表位.随后吸出封闭液,加入一抗,在通透性试剂存在条件下,保证一抗接近细胞核内的表位[14],4 ℃过夜以保证抗体与目标表位充分结合.第2天,用1×PBS洗3遍.然后加入针对一抗宿主物种并且有荧光标记的二抗和DAPI[15],室温避光孵育1 h.去掉二抗之后加入1×PBS洗3遍,每遍10 min.从每个条件所对应的培养孔内随机选取3个视野,用荧光显微镜拍照,然后对DAPI、SOX10阳性(SOX10+)信号进行统计分析,得出SOX10+细胞数目与DAPI数目的比值.所使用到的抗体包括:小鼠抗GFAP 抗体(anti-GFAP,1∶1 000),用于标记星形胶质细胞;豚鼠抗SOX10抗体(anti-SOX10,1∶400),用于标记OPCs.
2 研究结果
2.1 ACM促进小鼠大脑皮层单细胞培养获得OPCs
为了验证ACM对通过小鼠大脑皮层单细胞培养制备OPCs的方式是否有促进作用,设置了两种实验条件:在包被有PDL的24孔板中,分别用D/F20S培养基(对照组)和ACM(实验组)培养小鼠大脑皮层单细胞,再比较这两种条件下OPCs形成过程及数目的差异.在培养至第6天时,在显微镜下可观察到明显差异,ACM组中OPC样的细胞明显多于对照组.继续培养至第8天,固定细胞做细胞免疫荧光染色,染色结果显示ACM组SOX10+OPCs数目明显多于对照组(图1A),统计结果表明ACM组SOX10+OPCs占到细胞总数的13.90%,而对照组SOX10+OPCs仅占细胞总数的5.03%,且二者之间存在显著性差异(图1B).另外还观察到ACM组的孔内OPCs分布均匀,培养孔的每个区域都有OPCs的存在,而对照组OPCs则呈集群状分布,只有少部分区域有OPCs的存在.

A:D/F20S组和ACM组代表性图片;B:D/F20S组和ACM组SOX10+细胞占比的统计学分析(*表示P<0.05,以下同).
2.2 ACM促进小鼠皮层组织块制备OPCs
将小鼠大脑皮层切碎成1 mm3大小的组织碎块,接种于包被有PDL的24孔板中,分别用D/F20S培养基(对照组)和ACM(实验组)进行培养.培养至第6天时,在显微镜下观察发现ACM组OPC样的细胞明显多于对照组.培养至第8天时的免疫荧光染色结果显示,ACM组SOX10+OPCs数目明显多于对照组(图2A),其OPCs占细胞总数的26.17%,而对照组OPCs仅占细胞总数的7.17%(图2B),差异显著(P<0.05).这些结果说明,ACM在用小鼠大脑皮层组织块培养制备OPCs的方法中也同样具有促进作用.

A:D/F20S组和ACM组代表性图片;B:D/F20S组和ACM组SOX10+细胞占比的统计学分析.
2.3 星形胶质细胞饲养层促进单细胞培养法制备OPCs
将小鼠大脑皮层组织块消化成单细胞后接种于星形胶质细胞饲养层之上,用D/F20S培养基进行培养,以无饲养层培养作为对照.培养至第8天,免疫荧光染色结果显示饲养层组SOX10+OPCs占细胞总数的10.30%,而对照组孔内的OPCs仅占细胞总数的5.03%,单因素方差分析结果表明两组差异显著(P<0.05),说明小鼠星形胶质细胞饲养层对OPCs的形成具有促进作用(图3).然而相较于上述ACM培养小鼠大脑皮层单细胞所获的OPC产率(约13.90%),星形胶质细胞饲养层支持OPCs产生的作用不如ACM.
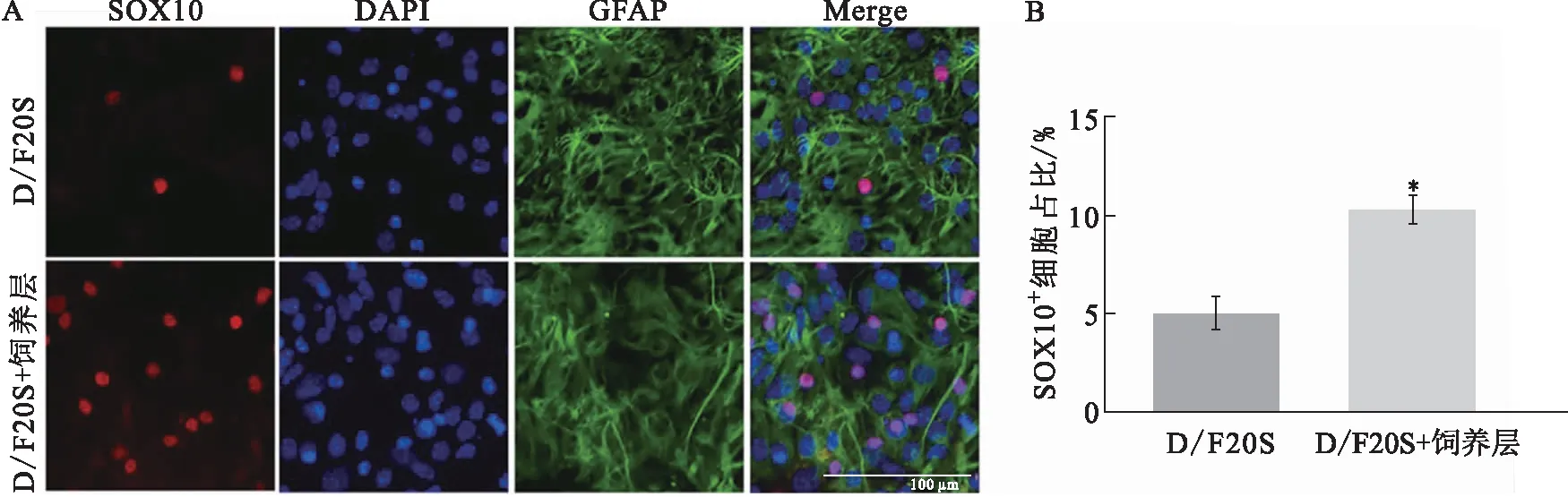
A:有或无星形胶质细胞饲养层培养小鼠大脑皮层单细胞获得OPCs的代表性图片;B:两组SOX10+细胞占比的统计学分析.
2.4 ACM与星形胶质细胞饲养层协同促进OPC的制备
以小鼠星形胶质细胞饲养层协同ACM或D/F20S培养基对小鼠大脑皮层单细胞进行培养,培养至第8天,经细胞免疫荧光染色后拍照,对2个组SOX10+细胞进行计数.统计学分析结果显示,ACM与饲养层组的SOX10+OPCs占细胞总数的16.87%,高于星形胶质细胞饲养层下以D/F20S为培养基的培养组(10.30%),二者之间存在显著性差异(图4).这一结果说明当ACM和星形胶质细胞饲养层共同应用时,对OPCs产生的促进作用大于只应用星形胶质细胞饲养层的情况.

A:D/F20S培养基与ACM培养大脑皮层单细胞获得OPCs的代表性图片;B:两组SOX10+细胞占比的统计学分析.
3 讨论
星形胶质细胞是一种独特的细胞类型,对少突胶质细胞和少突胶质细胞谱系中的其他细胞类型具有关键作用,可以直接影响少突胶质细胞系细胞的存活和产生[16].星形胶质细胞可以通过分泌生长因子支持OPCs的生长[4],因此,用小鼠星形胶质细胞制备ACM,能使星形胶质细胞分泌的各种生长因子扩散于ACM中,当用ACM来培养小鼠大脑皮层细胞时,有利于从这些单细胞培养物中产生OPCs,这跟理论预期相符合.有研究显示,小鼠的OPCs对消化酶比较敏感,导致很多OPCs在组织消化过程中遭受酶的消化损伤而死亡[7].本研究发现ACM有利于小鼠大脑皮层单细胞培养获得OPCs,据此推测ACM可能提高了某些受酶损伤OPCs的存活率,从而有利于获得更多SOX10+OPCs.大脑皮层组织块未经酶的消化损伤,因而有利于OPCs的存活及生长[7].但是本研究发现ACM也有利于皮层组织块培养获得OPCs,可见ACM促进OPCs的制备不仅仅局限于提高细胞的存活率,可能还通过促进OPCs分裂,甚至通过促进其他祖细胞向OPCs分化而获得更多的SOX10+细胞.
星形胶质细胞对OPCs的支持作用有两种途径,其中之一是星形胶质细胞分泌生长因子,扩散于培养基中,即制备ACM的原理;其二是星形胶质细胞能通过细胞之间的直接接触而传递某些有用的信号,从而支持OPCs的产生与分裂[4].因此,本研究设置了将小鼠大脑皮层单细胞接种于小鼠星形胶质细胞饲养层之上的实验条件,与对照组相比,饲养层组获得了更多的SOX10+细胞,印证了星形胶质细胞支持OPCs生长的第二条途径.但是,星形胶质细胞饲养层对OPCs产生的促进作用不如ACM,推测出现此现象的原因是星形胶质细胞通过与OPCs之间的相互接触进行信号转导的促进作用不如其分泌的生长因子强.鉴于ACM和小鼠星形胶质细胞饲养层对OPCs的产生均有促进作用,且本研究证明两种促进因素共同存在时,OPCs的产量多于只有一种促进因素时的情况,因此,在制备OPCs时可以考虑将这两个有效因素合并使用.
4 总结
综上所述,本研究发现ACM能显著提高小鼠原代OPCs的制备效率,与星形胶质细胞饲养层相搭配甚至可以进一步提高OPCs的产量.这一方法有望获得足够数目的OPCs用于少突胶质细胞发育或者脱髓鞘治病机理的研究.
