大白菜ACA基因家族的全基因组鉴定与表达分析
2021-12-07王洁吴晓宇杨柳段巧红黄家保
王洁,吴晓宇,杨柳,段巧红,黄家保
大白菜ACA基因家族的全基因组鉴定与表达分析
王洁,吴晓宇,杨柳,段巧红,黄家保
山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018
【目的】通过对大白菜ACA(Ca2+-ATPase)基因家族鉴定与表达分析,研究其家族基因间的共性与特性,为进一步揭示ACA家族进化关系提供数据支撑,为深入解析在低温胁迫、盐胁迫以及自交不亲和方面的功能研究奠定基础。【方法】根据已报道的拟南芥ACA基因家族,同源比对出大白菜ACA基因家族,利用在线软件Expasy预测其分子量、理论等电点等理化性质;采用MEGA 5.0软件构建系统进化树;运用在线软件GSDS 2.0绘制基因结构图谱;TBtools对其染色体定位;McscanX软件进行拟南芥与大白菜ACA家族基因共线性分析;利用在线软件PlantCARE预测大白菜ACA基因家族启动子元件;通过在线工具Pfam和MEME进行蛋白保守结构域分析;利用qRT-PCR技术检测在不同组织、非生物胁迫和自交异交授粉后的表达量。【结果】大白菜ACA基因家族有18个基因成员,分布在大白菜10条染色体上;根据进化树关系分成4组,分别包含3、4、4和7个成员;蛋白结构域分析显示,有13个成员包含N端自抑结构域。qRT-PCR结果表明,主要在花与果荚中高表达;低温胁迫下,与表达量总体上调;盐胁迫下,表达量显著上调;自交和异交授粉中,和差异性表达。对、和亚细胞定位分析,发现这些基因均定位在细胞质膜上。【结论】大白菜ACA家族基因蛋白结构均含有4个ACA基因特有的高度保守结构域。该家族在大白菜不同组织中表达模式不同,5个ACA家族基因成员编码蛋白定位于细胞膜上,其中、与低温和盐胁迫响应有关;和与自交不亲和性相关。
ACA家族;Ca2+-ATPase;低温胁迫;盐胁迫;自交不亲和;大白菜
0 引言
【研究意义】大白菜(L. ssp. pekinensis)为十字花科芸薹属作物,属于孢子体自交不亲和型植物,在育种生产中常喷施2%—3%食盐水来克服大白菜自交不亲和以进行亲本留种[1]。盐害和冷害也常影响大白菜的生长和产量。钙离子信号转导是植物响应各种环境因子的重要机制,逆境条件下细胞质钙离子浓度升高,引发一系列钙依赖的下游信号传递。Ca2+-ATPase(ACA)作为调节细胞内钙离子浓度的重要蛋白质之一,维持细胞内钙离子浓度的平衡[2-3]。ACA是Ca2+-ATPase最重要的亚家族成员之一,在维持细胞内钙离子浓度的平衡方面发挥着重要作用。【前人研究进展】钙离子作为第二信使,在动植物一生中都具有重要作用。Puteney[4]在1986年首次报道了细胞内钙离子内流的相关信息。钙离子ATP泵(又称P型ATP酶)[5]最早可以追溯到英国科学家Ringer在1885年发现钙离子对动物肌肉收缩有影响[6],10年后科学家们获得肌浆网钙泵氨基酸序列[7]。近些年拟南芥[8-9]、番茄[10-11]、水稻[12-13]、甘蓝[14]、大豆[15]和苜蓿[16]等植物陆续有钙泵的编码序列被报道。ACA蛋白属于P型ATP酶超级组基因家族的钙离子泵,典型的ACA基因家族蛋白,具有Haloacid dehalogenase- like hydrolase功能域、C端Cation transporting ATPase功能域、E1-E2 ATPase功能域和N端Cation transporter/ ATPase功能域4个高度保守的功能结构域[17]。根据其蛋白序列N端有无自抑结构域,分为内质网膜型钙离子泵和自抑制型钙离子泵[18-20]。目前在拟南芥、水稻、大豆和苜蓿的ACA基因家族已经作了比较全面地分析。拟南芥ACA基因家族有13个成员,其中、和为内质网膜型钙离子泵;、、、、、、、、和属于自抑制型钙离子泵[21-23]。有数据显示定位于质膜上的在拟南芥的所有器官中均有表达,同样在拟南芥所有器官表达的还有与其高度同源的,拟南芥幼苗期外施植物激素脱落酸使和表达量显著升高[24]。已有研究表明与野生型相比,拟南芥突变体在冷害和高温胁迫下,抗逆性增强[8]。还有研究表明,、和3在拟南芥有性生殖方面扮演着重要角色[24],对提高盐离子毒害的耐受性有至关重要的作用[25]。水稻ACA基因家族由15个成员组成,其中有3个属于内质网膜型钙离子泵,12个属于自抑制型钙离子泵。水稻在烟草中表达会积累大量的脯氨酸,从而增强烟草的抗盐和抗旱能力[26]。大豆的ACA基因家族有29个基因成员,其中有5个属于内质网膜型钙离子泵,24个属于自抑制型钙离子泵。大豆中,Sun等[15]研究证实,野生大豆Ca2+-ATPase()在调节植物对碳酸盐碱性和中性盐胁迫的耐受性方面有积极效果。苜蓿Ca2+-ATPase家族由16个成员组成,其中3个属于内质网膜型钙离子泵,13个属于自抑制型钙离子泵。研究发现苜蓿ACA基因家族的蛋白序列具有高度保守性,其中和在响应低温胁迫过程中可能发挥着重要作用[19]。大白菜中同属于Ca2+-ATP亚家族且具有钙运输功能的ECA基因家族在生长发育过程中发挥重要作用[27]。【本研究切入点】大白菜作为人们日常餐桌上的重要蔬菜,ACA蛋白可能在其育种和生产过程中的自交不亲和、盐胁迫和冷胁迫等诸多方面发挥作用,而相关的鉴定和功能解析还未见报道。【拟解决的关键问题】本研究拟通过生物信息学手段鉴定出大白菜ACA基因家族成员,并进行特征分析和表达分析,为研究大白菜ACA家族基因的功能、基因编辑育种和开发分子标记进行辅助育种奠定基础。
1 材料与方法
试验于2020年在山东农业大学国家重点实验室和南校实验站进行。
1.1 大白菜ACA基因家族成员鉴定及基本理化性质分析
在TAIR(https://www.arabidopsis.org/)网站下载拟南芥ACA基因家族蛋白序列,同时在植物信息数据库(http://www.plantgdb.org/)中下载大白菜(版本V1.5)全基因组蛋白序列文件和gff3文件构建本地BLAST数据库,将拟南芥ACA基因家族的蛋白序列通过本地BLAST比对出大白菜候选基因(参数为E<1e-10,Identity>40%);同时利用Pfam数据库、NCBI保守结构域数据库(https://www.ncbi.nlm.nih. gov/structure/cdd/wrpsb.cgi/)和SMART9.0(http://smart. embl-heidelberg.de/)建立大白菜全基因组蛋白结构域模型,筛选含有ACA典型结构域(Haloacid dehalogenase- like hydrolase功能域、C端Cation transporting ATPase功能域、E1-E2 ATPase功能域和N端Cation transporter/ATPase功能域)的蛋白序列[28-29]。上述结果合并,剔除重复基因和不含ACA典型结构域的基因,并人工矫正删除无完整读码框的序列。利用在线工具Expasy(http://web.expasy.org/)预测大白菜ACA基因家族的分子量、理论等电点等物理化学特性以及WoLF PSORT(http://wolfpsort.org/)和DETAIBIO(http://www.detaibio.com/tools/transmembrane.html/)预测大白菜ACA家族蛋白定位和跨膜结构[29-30],参数默认。
1.2 系统进化树的构建与绘制基因结构图
运用MEGA 5.0软件对大白菜ACA基因家族蛋白按照邻近法构建系统进化树,校验参数步值(bootstrap)设置为1 000,其余参数均为默认值,通过GSDS(http://gsds.gao-lab.org/)绘制内含子-外显子基因结构图[31-32]。
1.3 染色体定位和启动子元件分析
利用TBtools对家族基因进行染色体位置分析,并同拟南芥家族基因在McscanX进行共线性分析[33-34],参数默认。选择BraACA家族基因上游2 000 bp的序列,利用在线工具plantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对其元件进行分析,参数默认[35]。
1.4 蛋白保守结构域分析与序列比对
利用在线软件Pfam(https://pfam.xfam.org/)[28]和MEME(http://meme-suite.org)[36]对大白菜蛋白序列的保守基序与功能结构域分析,其中MEME的参数设置Maxi-mum number of motifs为10,Occurrences of a single motif为zero or one per sequence。运用DNAMAN 9对大白菜部分ACA家族基因与拟南芥AtACAs的蛋白序列进行同源比对。
1.5 大白菜总RNA的提取和qRT-PCR分析
材料取自植物培养室。组织特异性表达研究分别取‘848蛋黄白’植株定植2个月后的根、茎、叶、当天开放的花、果荚以及冷胁迫(4℃处理0、2、4、6和12 h)与盐胁迫(150 mmol∙L-1NaCl处理0、2、4、6和12 h)处理一定时间后的幼苗。均取3个生物学重复。
采用Universal RNA Extraction Kit试剂盒(Bioteke Corporation)提取总RNA,1%琼脂糖凝胶电泳评估RNA的完整性,分光光度计(Thermo Nano Drop One)测量RNA浓度和纯度。利用HiScript® II Q RT SuperMix for qPCR Sample试剂盒(诺唯赞)进行反转录反应获得cDNA,稀释十倍后-20℃保存备用。
qRT-PCR的反应体系:2×SYBR qPCR Master Mix 10.0 μL,上、下游引物(10 μmol∙L-1)各0.4 μL,cDNA模板1.0 μL,ddH2O 8.2 μL,总反应体系20 μL。反应程序:95℃,30 s;95℃,10 s,60℃,22 s,40个循环;95℃,25 s,60℃,60 s,95℃,7 s。内参使用。3个技术重复。采用2-∆∆CT法[37]对数据进行分析,使用Excel进行数据汇总,TBtools作图。引物序列见表1,使用qPrimerDB-qPCR Primer Database(http://biodb.swu.edu.cn/qprimerdb/)和NCBI Primer BLAST网址设计完成,由青岛擎科梓熙生物技术有限公司合成。
1.6 亚细胞定位
根据的CDS序列,用CE Design V1.04(诺维赞)软件设计携带同源臂的PCR扩增引物(表2)。以大白菜cDNA作为模板,对其基因片段进行扩增。反应条件为:95℃预变性3 min,95℃变性15 s,55℃退火15 s,72℃延伸3 min,34个循环;72℃彻底延伸5 min。片段回收后与载体通过同源重组的方法进行连接。构建好的融合载体热击转化大肠杆菌感受态DH5α,涂抗性板。第2天长出单菌落后挑单克隆小量培养,提取质粒,测序鉴定。鉴定正确后转化农杆菌GV3101感受态,PCR鉴定。最后挑单菌落摇菌,注射烟草叶片,2—3 d后在荧光显微镜(Nikon DS-Ri2,Japan)下观察GFP表达情况并拍照、分析。
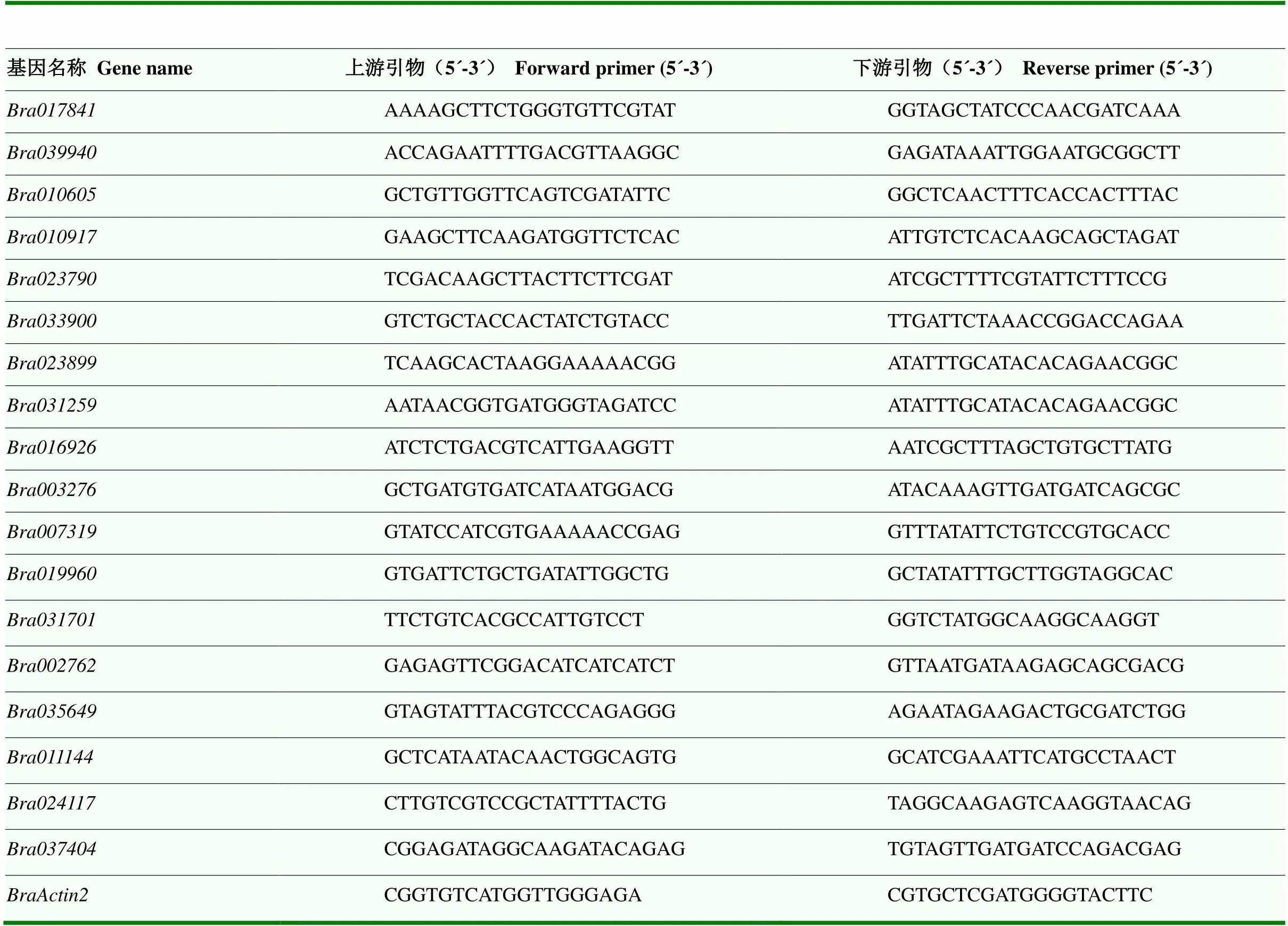
表1 qRT-PCR引物
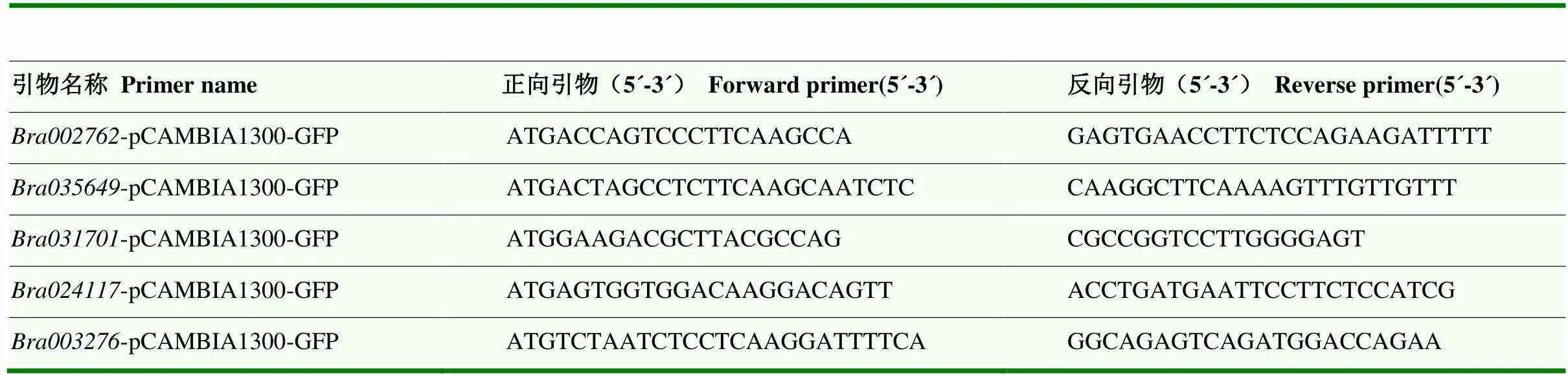
表2 部分克隆基因引物序列
2 结果
2.1 大白菜ACA基因家族成员信息
运用生物信息学手段鉴定出18个家族成员,并对其理化性质进行分析(表3)。家族成员分子量在110 370.20 Da()—119 249.50 Da(),平均分子量114 171.00 Da;CDS平均长度为3 142 bp;蛋白的平均长度约1 047 aa;理论等电点在5.06()—8.75(),平均理论等电点为6.28;BraACAs基因家族蛋白均定位在细胞质膜,除跨膜结构数量为10,其余BraACAs蛋白跨膜结构数量为7和8。同时利用模式植物拟南芥对BraACAs基因家族进行同源比对分析,得到比对结果最高相似度的基因(表3)。
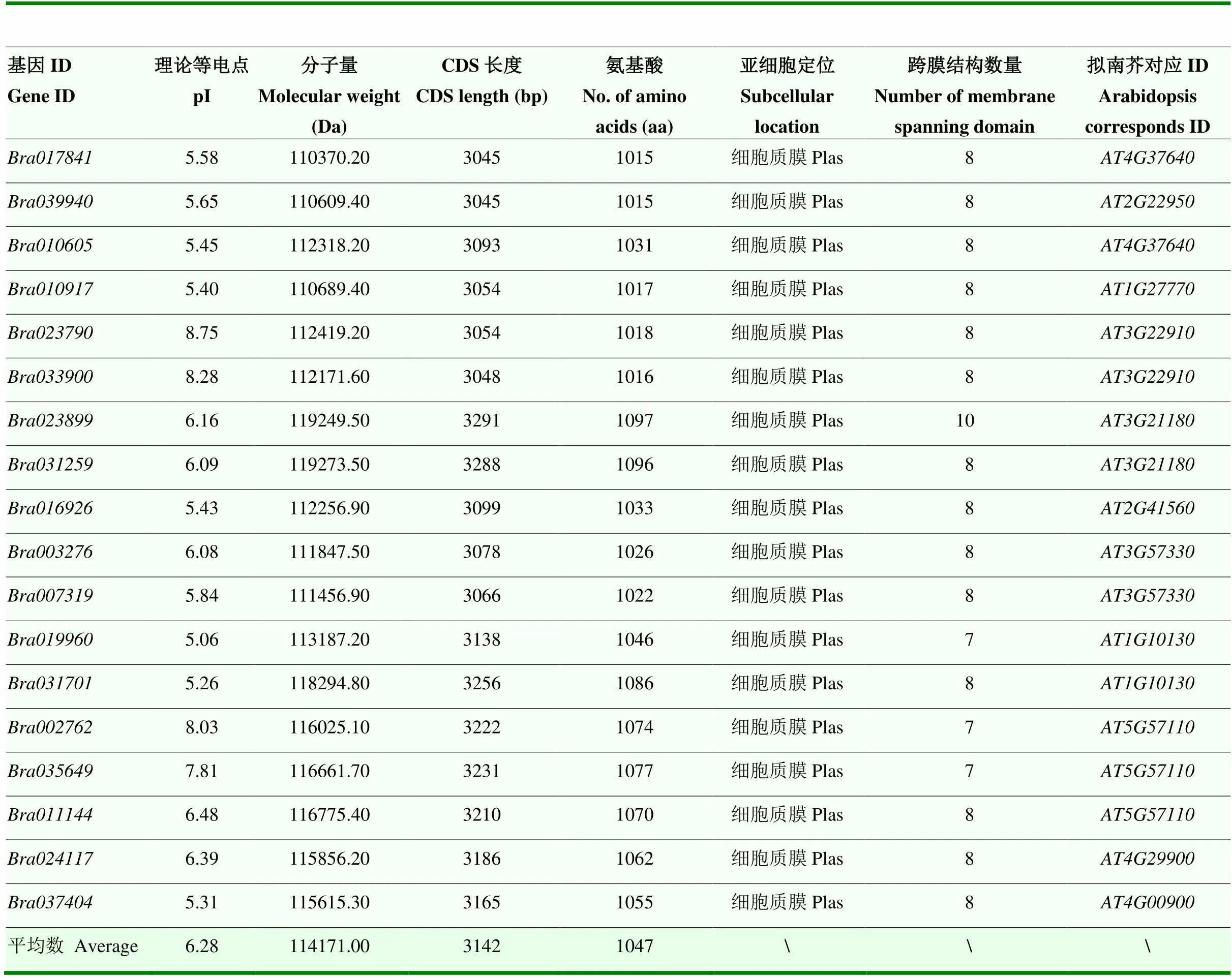
表3 大白菜ACA基因家族成员信息
2.2 大白菜ACA家族系统进化与基因结构分析
利用大白菜ACA家族蛋白序列构建系统进化树(图1-A)。大白菜18个BraACA家族成员根据亲缘关系的远近可分为4类,命名为Group Ⅰ、Group Ⅱ、Group Ⅲ和Group Ⅳ,各组中分别含有3、4、4和7个,其中在Group Ⅰ、Group Ⅱ、Group Ⅲ步长值高达99%的分别为/,/和/,GroupⅢ和GroupⅣ步长值为98%的分别为/和/,进一步说明构建的BraACAs蛋白间进化关系比较可靠(图1-A)。同时利用在线软件GSDS绘制大白菜ACA家族基因结构图(图1-B),结果表明大白菜ACA基因家族成员之间的内含子数量差异较大(0—33个),5个内含子以下的Bra有3个,5—20个内含子的有7个,20个以上内含子的有8个。其中20个以上的主要集中在Group Ⅳ,除外,其他均具有相同的内含子-外显子组成模式,即33-34(33个内含子,34个外显子)。Group Ⅱ直观上观察可以分为2种组成模式,即/和/。结果显示大白菜ACA蛋白家族成员间基因结构存在差异。

图1 大白菜ACA基因家族系统进化树与基因结构图
2.3 大白菜ACA家族基因染色体定位及与拟南芥基因的共线性分析
根据基因位置文件对18个家族基因染色体定位进行分析(图2),结果显示其不均匀分布在大白菜10条染色体上,其中9号染色体上的基因最多,含有4个成员;其次是1号染色体上有3个基因成员;3号、5号和8号分别各有2个基因成员;2号、4号、6号、7号和10号染色体分别仅有1个基因成员(图2-A),进一步分析发现、/存在基因重复现象(图2-B),同时还存在片段复制情况,发现了6对片段复制基因,分别为和和、和、和、和、和,表明BraACAs基因家族某些成员之间的基因功能具有相似性。
为了更好地了解大白菜ACA家族基因所具备的功能,参照已详细报道过的拟南芥AtACAs进行直接同源基因比对,预测大白菜ACA家族所具有的生物学功能。通过对拟南芥和大白菜ACA基因家族进行共线性分析,结果显示16对处于共线性区域,分别是/、/、/、/、/、/、/、/、/、/、/、/、/、/、/、/(图2-B)。
2.4 大白菜ACA基因家族启动子元件分析
启动子元件分析发现,大白菜ACA基因家族均含有较多的光响应元件,50%以上的含有低温和干旱响应元件,80%以上含有厌氧诱导应答元件,40%以上有茉莉酸甲酯、脱落酸、赤霉素与脱落酸响应元件,其中和包含水杨酸响应元件,还有部分基因有分生组织、根特异性、生物钟等响应元件,暗示大白菜ACA基因家族参与光合作用、生长发育等过程,同时在大白菜应对逆境胁迫方面也发挥着重要作用(图3)。

图2 大白菜与拟南芥ACA基因在染色体上的位置及基因重复事件
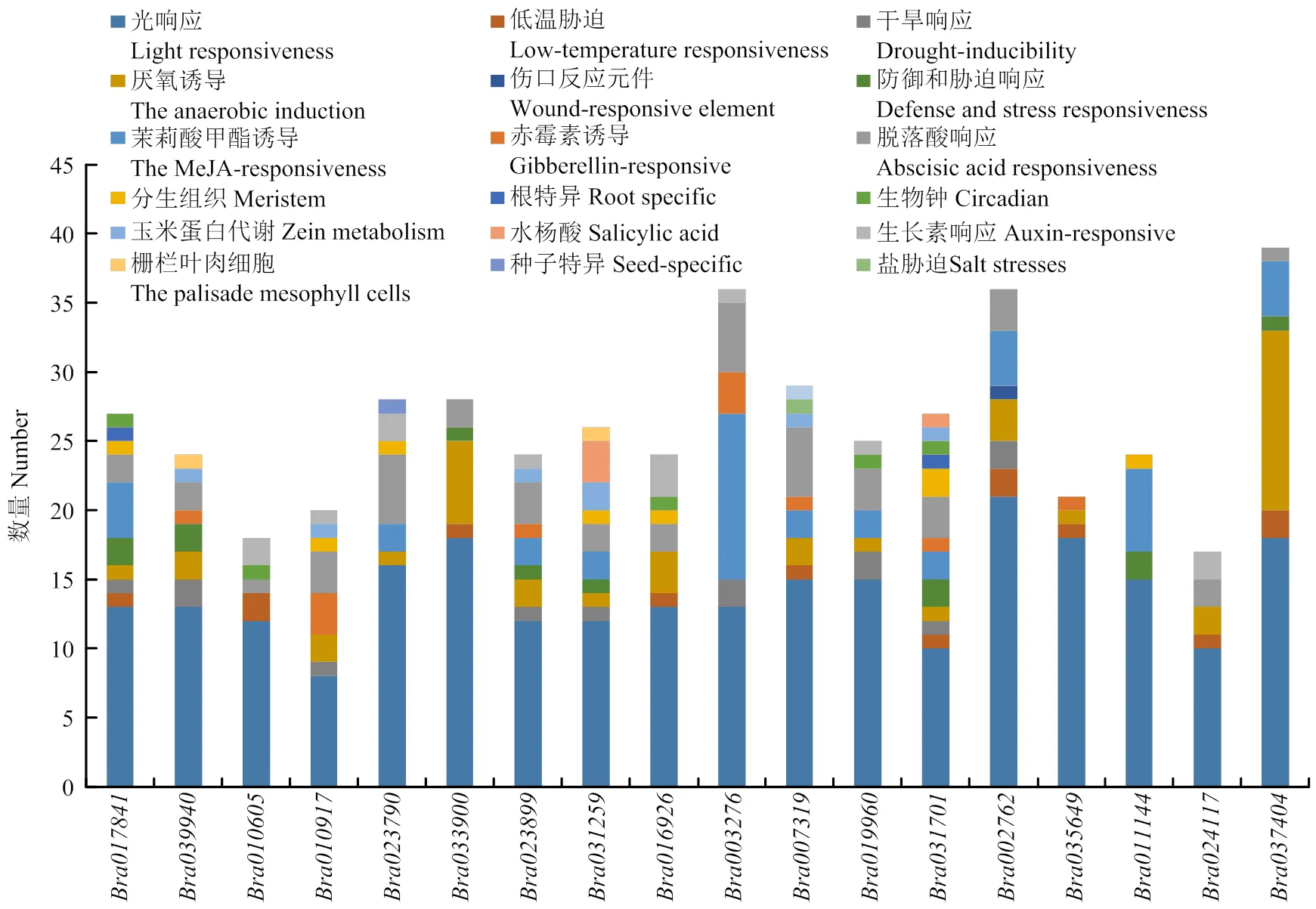
图3 大白菜ACA家族基因启动子元件分析
2.5 大白菜ACA家族成员蛋白保守结构域分析
利用在线工具Pfam和MEME分别对大白菜ACA家族蛋白保守结构域进行分析(图4),获得了10个保守基序,分别命名为Motif 1—Motif 10,大白菜ACA家族均含有Motif 1、Motif 3、Motif 6和Motif 10保守基序(图4)。通过进一步分析发现Motif 1末端含有连续高度保守的天冬氨酸(D)-赖氨酸(K)-苏氨酸(T)-甘氨酸(G)-苏氨酸(T)-亮氨酸(L)-苏氨酸(T)等7个氨基酸,Motif 3前端含有连续高度保守的亮氨酸(L)-亮氨酸(L)-色氨酸(W)-缬氨酸(V)-天冬氨酸(N)等5个氨基酸,Motif 6含有4个不连续高度保守的甘氨酸(G)(图4)。对蛋白的保守功能域进行分析,发现大白菜ACA基因家族蛋白的4个保守功能域分别对应着4个保守基序(图4和图5),即Haloacid dehalogenase-like hydrolase功能域对应Motif 1,C端Cation transporting ATPase功能域对应Motif 3,E1-E2 ATPase功能域对应Motif 6以及N端Cation transporter/ATPase功能域对应Motif 10。除此之外,发现大白菜ACA基因家族蛋白的N端自抑制功能域存在于13个家族成员中,即、、、、、、、、、、、和。

图4 大白菜ACA家族基因成员蛋白保守结构域分析

图5 大白菜ACA家族保守结构域蛋白序列比对
2.6 BraACAs家族基因表达分析
2.6.1 组织特异性表达分析 利用qRT-PCR技术鉴定BraACA基因家族各成员在大白菜不同器官中的表达,以根的表达量作为对照,显示大多数在大白菜果荚中高表达,其次是花,而在根、茎和叶片中的表达量普遍偏低(图6)。其中在果荚和花中的表达量都最高,除此之外,在果荚中表达量由高到低依次是、和,在花中表达量由高到低依次是和;在大白菜茎和叶片中表达最高,其余基因在茎和叶片中的表达都略低。
2.6.2 冷胁迫下的表达 大白菜生产过程中经常面临冷害威胁。对BraACA家族在冷胁迫不同时间后的表达情况进行分析(图7),发现除、和外,其余基因的表达量随冷胁迫时间的延长呈“降-升-降”的趋势;的表达量随冷胁迫时间的延长呈“降-升-降-升”的趋势;而和这2个基因最值得关注,在受到冷胁迫的前6 h内呈现递增上升的趋势,最具规律性。前期在对这2个基因上游2 000 bp启动子序列的元件分析发现分别含有2和1个低温响应元件(图3),同时发现、与()相似性较高(表3),对这3个基因蛋白序列进行比对发现其相似性为94.21%(图8),前期有研究表明在拟南芥抵抗冷胁迫发挥重要作用,本研究qRT-PCR表明和在低温环境下表达量上调,这与拟南芥研究结果类似[8]。

图7 BraACAs冷胁迫处理不同时间下基因表达情况
2.6.3 盐害处理下的表达和在受到盐胁迫后表达量变化最为显著,相比对照,分别上调了4倍和3倍(图9)。大多数ACA基因成员表达量在受到盐胁迫后呈现下调趋势,、、和在受到盐胁迫12 h内,基因表达量趋于稳定。其中在受到盐胁迫后表达量呈现明显上升的趋势,前期对启动子元件分析发现其含有2个茉莉酸甲酯响应元件(图3),大量试验数据显示茉莉酸甲酯可以有效地缓解盐胁迫对植物的危害[38-39]。与拟南芥同源比对,发现与()相似性较高(表3),蛋白比对结果显示其相似性为85.70%(图10),已有文章报道在缓解盐害方面有显著作用[25],这与定量结果相吻合。

图9 BraACAs盐胁迫处理不同时间下基因表达情况
2.6.4 在大白菜中不亲和/亲和反应中的表达 提取大白菜初花期的柱头总RNA,进行RNA-seq测序,获取柱头中基因的表达量信息。结果表明,18个成员中大约一半的基因属于低表达基因(FPKM≤10),中表达基因(10
2.7 部分大白菜ACA基因克隆和亚细胞定位分析
对已经初步了解生物学功能的和设计引物,从大白菜‘848蛋黄白’柱头cDNA中进行PCR扩增,克隆基因。电泳显示目标条带大小以及测序结果正确(图13)。将5个的CDS连接载体,转入农杆菌,进行烟草叶片瞬时表达。结果显示这5个均定位在细胞膜上(图14)。

图10 Bra031701和AT1G10130蛋白序列比对
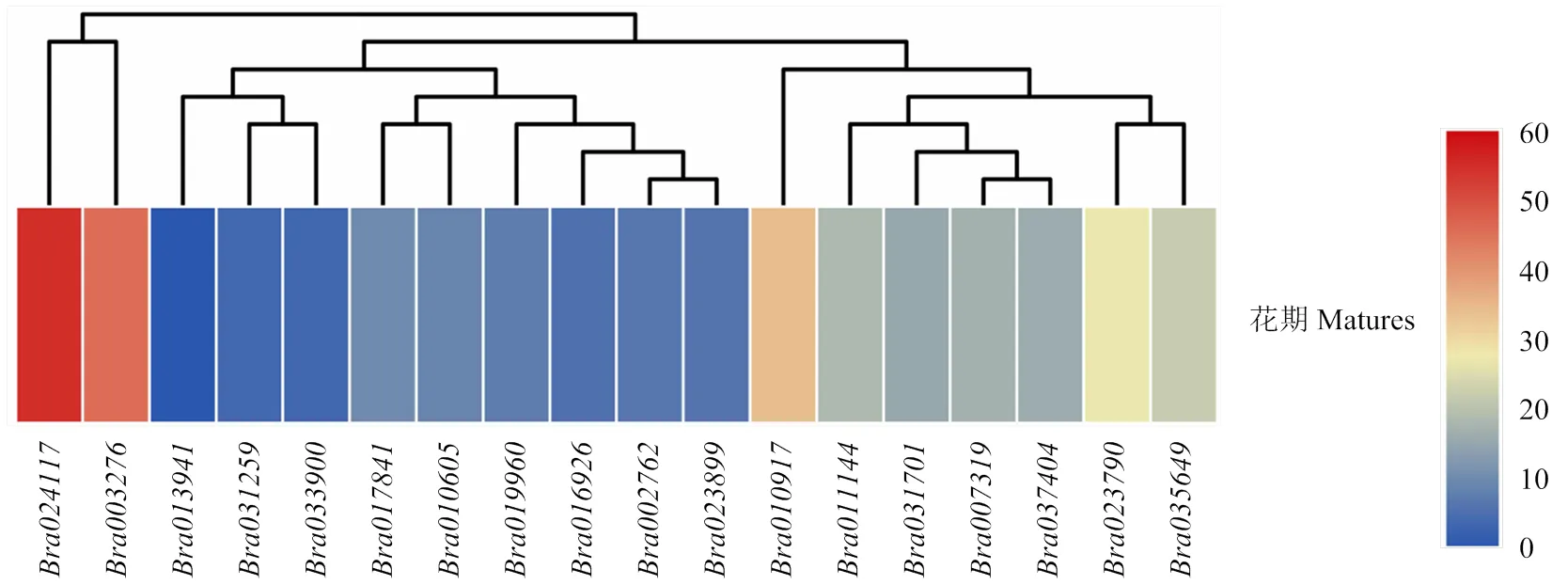
在柱头RNA-seq数据中提取BraACAs的FPKM值作图
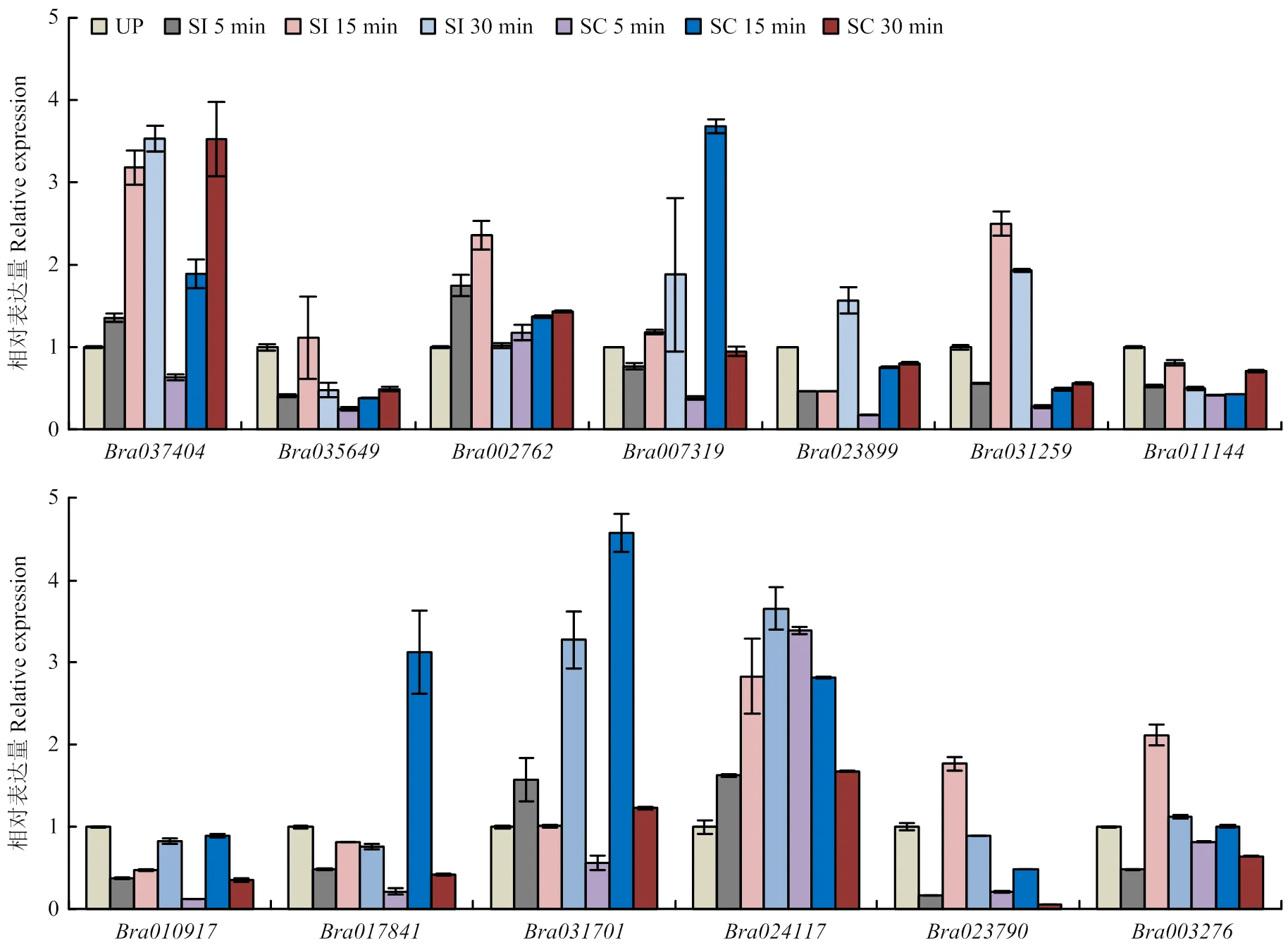
图12 BraACAs基因在柱头未授粉(UP)、自交(SI)和异交(SC)下表达情况
图13 BraACAs的琼脂糖凝胶电泳
3 讨论
钙离子在植物生长、发育中起着至关重要的作用[41-42],维持体内钙离子浓度平衡显得尤其重要,钙离子泵是调节钙离子浓度的重要蛋白之一。钙离子泵在拟南芥、水稻等模式植物中已经研究得相对较清楚,尤其是ACA家族基因研究得比较透彻[43-45]。本研究鉴定得出18个大白菜ACA基因家族成员,其中有13个带有N端的自抑结构域。有研究表明N端的自抑结构域能有效抑制ATPase结构域的活性,从而保持钙泵较低的活性[46]。大白菜经历三倍化复制事件,而后可能因为BraACA在进化过程中发生基因丢失,使大白菜与拟南芥在ACA基因数目上没有太大差异。对功能结构域深入分析发现,Haloacid dehalogenase-like hydrolase功能域含有高度保守的D-K-T-G-T-L-T基序,C端Cation transporting ATPase功能域含有高度保守的L-L-W-V-N基序,E1-E2 ATPase功能域含有4个不连续高度保守的G基序,表明大白菜ACA基因家族进化具有固定的模式,进化关系具有保守性。
研究表明,钙离子在果实发育过程中起着重要的调控作用[47]。ACA基因家族蛋白作为调节钙离子浓度的重要成员,其家族中某些基因的表达会影响果实发育。qRT-PCR分析发现,ACA基因主要集中在大白菜的果荚中表达,说明ACA基因可能在果荚发育过程中发挥主要作用。还有研究显示,钙离子在缓解非生物胁迫和生殖生长方面发挥重要作用[48-50]。在受到冷胁迫时,与的表达量比较有规律,均表现出上调趋势,且都在4—12 h内达到最高峰,在冷胁迫2—4 h出现急剧上升的趋势,而在冷胁迫6 h内上升趋势较为缓和,这说明对低温的感应要比强。在盐胁迫处理下,大部分ACA基因表达量呈现下调趋势,其中表达量呈现上升的趋势,且在4—6 h内出现急剧上升,说明对盐胁迫的响应需要时间差。和具有潜在抵御冷害的作用,具有抵御盐害的潜在生物学功能。这3个基因具体如何抵御非生物胁迫还需深入研究。转录组测序中花期表达量高的和,在自交授粉和异交授粉的差异性表达数据,可为后续进一步研究大白菜有性生殖提供基础。
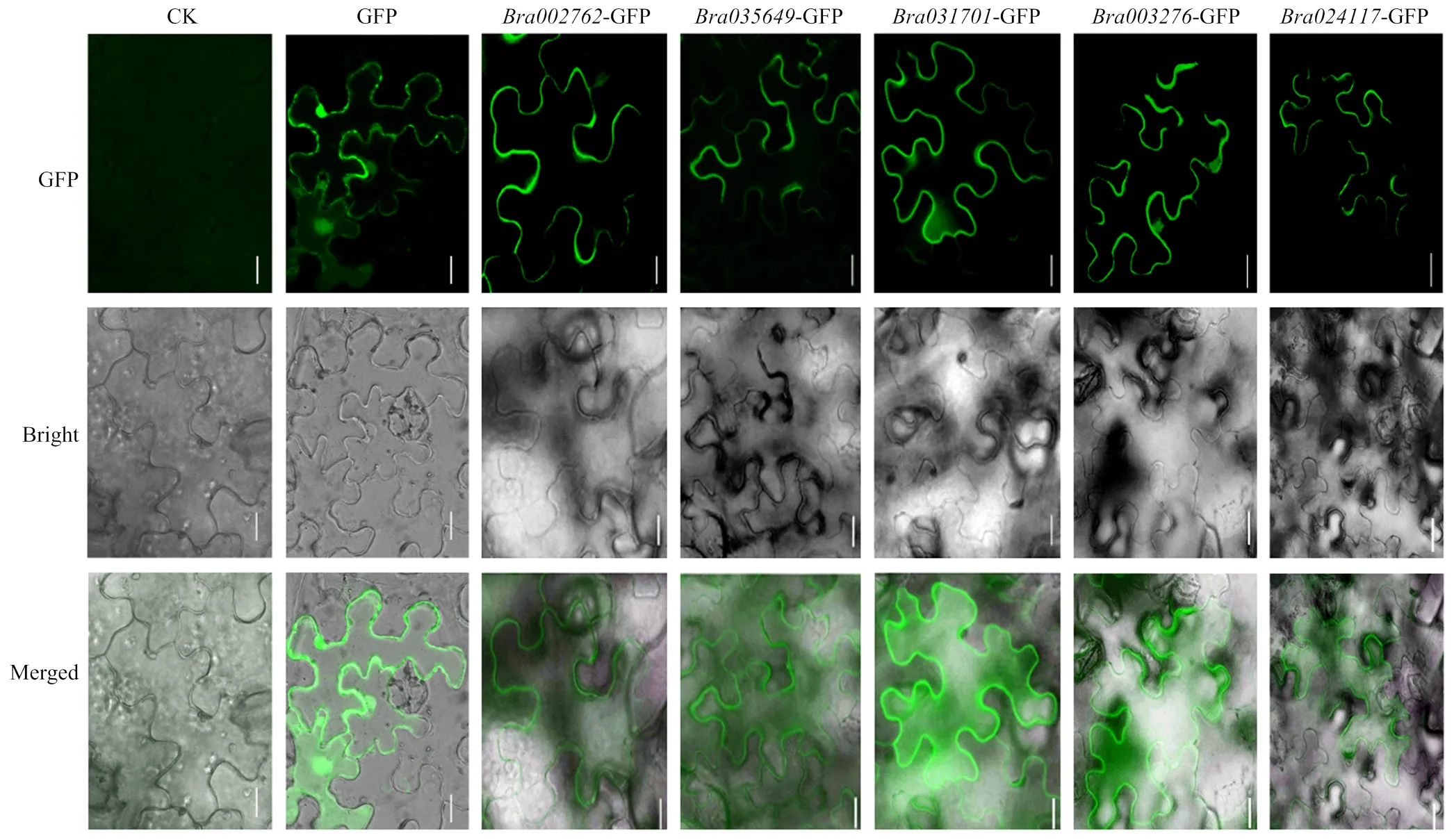
CK:无载体注射烟草叶片;GFP:35s-GFP/pCAMBIA1300空载体在烟草叶片表达情况。标尺=10 μm
4 结论
本研究筛选出18个大白菜ACA基因家族成员,可分为4组,不均匀分布在大白菜10条染色体上。低温胁迫条件下,和被诱导上调表达,可能与大白菜低温胁迫有关;盐胁迫条件下,显著上调,可能与大白菜抗盐性有关;在自交/异交授粉中,和表达表现出相反的表达模式,其可能通过调控钙离子参与大白菜有性生殖过程。
[1] 李正吉, 赵胜业, 倪树林, 周民. 喷盐水克服大白菜自交不亲和的研究. 蔬菜, 1997(1): 28.
LI Z J, ZHAO S Y, NI S L, ZHOU M. Study on overcoming self-incompatibility of Chinese cabbage by spraying salt water. Vegetable, 1997(1): 28. (in Chinese)
[2] SPALDING E P, HARPER J F. The ins and outs of cellular Ca2+transport. Current Opinion in Plant Biology, 2011, 14(6): 715-720.
[3] 王精明, 李洪清, 李美茹. 水稻幼苗根细胞质膜和液泡膜微囊Ca2+-ATP酶的特性. 植物生理学通讯, 2004, 40(1): 22-26.
WANG J M, LI H Q, LI M R. Characteristics of Ca2+-ATPase of plasma membrane and tonoplast membrane vesicles from roots of rice seedlings. Plant Physiology Communications, 2004, 40(1): 22-26. (in Chinese)
[4] PUTNEY J W. A model for receptor-regulated calcium entry. Cell Calcium, 1986, 7(1): 1-12.
[5] TOYOSHIMA C, NOMURA H, SUGITA Y. Structural basis of ion pumping by Ca2+-ATPase of sarcoplasmic. FEBS Letters, 2003, 555(1): 106-110.
[6] HEPLER P K. Calcium: a central regulator of plant growth and development. The Plant Cell, 2005, 17(8): 2142-2155.
[7] 任衍钢, 白冠军, 宋玉奇, 路彦文. 钙泵的发现历程. 生物学通报, 2018, 53(10): 57-60.
REN Y G, BAI G J, SONG Y Q, LU Y W. The discovery of calcium pump. Bulletin of Biology, 2018, 53(10): 57-60. (in Chinese)
[8] 李唯奇, 张洁, 张旭东, 王瑞萍. 拟南芥基因在植物抗逆及调控植物生长发育中的应用. CN103122357A. 2013.
LI W Q, ZHANG J, ZHANG X D, WANG R P. Application ofgene in plant stress resistance and regulation of plant growth and development. CN103122357A. 2013. (in Chinese)
[9] HARPER J F, HONG B, HWANG I, GUO H Q, STODDARD R, HUANG J F, PALMGREN M G, SZE H. A novel calmodulin- regulated Ca2+-ATPase (ACA2) fromwith an N-terminal autoinhibitory domain. The Journal of Biological Chemistry, 1998, 273(2): 1099-1106.
[10] WIMMERS L E, EWING N N, BENNETT A B. Higher plant Ca2+-ATPase: primary structure and regulation of mRNA abundance by salt. PNAS, 1992, 89(19): 9205-9209.
[11] 刘宇欣, 束艺, 张念, 陈秀玲, 王傲雪. 茄科植物Ca2+-ATPase基因家族鉴定及分析. 分子植物育种, 2021(13): 4268-4277.
LIU Y X, SHU Y, ZHANG N, CHEN X L, WANG A X. Identification and analysis of Ca2+-ATPase gene family in Solanaceae. Molecular Plant Breeding, 2021(13): 4268-4277. (in Chinese)
[12] CHEN F, MOTTINO G, SHIN V Y, FRANK J S. Subcellular distribution of ankyrin in developing rabbit heart: relationship to the Na+-Ca2+exchanger. Journal of Molecular and Cellular Cardiology, 1997, 29(10): 2621-2629.
[13] 彭陈. 稻瘟菌P型ATP酶的基因家族分析及其基因、的研究[D]. 合肥: 安徽农业大学, 2012.
PENG C. Analysis of P-type ATPase gene family ofand its genesand[D]. He Fei: Anhui Agricultural University, 2012. (in Chinese)
[14] LEE J, PARK I, LEE Z W, KIM S W, BAEK N, PARK H S, PARK S U, KWON S, KIM H. Regulation of the major vacuolar Ca2+transporter genes, by intercellular Ca2+concentration and abiotic stresses, in tip-burn resistant. Molecular Biology Reports, 2013, 40(1): 177-188.
[15] SUN M Z, JIA B W, CUI N, WEN Y D, DUANMU H Z, YU Q Y, XIAO J L, SUN X L, ZHU Y M. Functional characterization of aCa2+ATPase in salt-alkaline stress responses. Plant Molecular Biology, 2016, 90(4): 419-434.
[16] 张美萍, 杨珺凯, 孙明哲, 贾博为, 孙晓丽. 基于家族分析的苜蓿逆境应答Ca2+ATPase家族基因筛选与鉴定. 植物生理学报, 2017, 53(2): 198-208.
ZHANG M P, YANG J K, SUN M Z, JIA B W, SUN X L. Screening and identification of environmental stress responsive Medicago sativa Ca2+ATPases based on gene family analyses. Plant Physiology Communications, 2017, 53(2): 198-208. (in Chinese)
[17] PALMGREN M G, NISSEN P. P-type ATPases.Annual Review of Biophysics, 2011, 40(1): 243.
[18] HANIKENNE M, BAURAIN D. Origin and evolution of metal P-type ATPases in Plantae (Archaeplastida). Frontiers in Plant Science, 2013, 4: 544.
[19] GEISLER M, AXELSEN K B, HARPER J F, PALMGREN M G. Molecular aspects of higher plant P-type Ca2+-ATPases. Biochimica et Biophysica Acta, 2000, 1465(1/2): 52-78.
[20] AXELSEN K B, PALMGREN M G. Inventory of the superfamily of P-type ion pumps in. Plant Physiology, 2001, 126(2): 696-706.
[21] YU H Y, YAN J P, DU X G, HUA J. Overlapping and differential roles of plasma membrane calcium ATPases ingrowth and environmental responses. Journal of Experimental Botany, 2018, 69(10): 2693-2703.
[22] LIANG F, CUNNINGHAM K W, HARPER J F, SZE H. ECA1 complements yeast mutants defective in Ca2+pumps and encodes an endoplasmic-type Ca2+-ATPase in. PNAS, 1997, 94(16): 8579-8584.
[23] GEORGE L, ROMANOWSKY S M, HARPER J F, SHARROCK R A. The ACA10 Ca2+-ATPase regulates adult vegetative development and inflorescence architecture in. Plant Physiology, 2007, 146(2): 323-324.
[24] SCHIOTT M, ROMANOWSKY S M, BAEKGAARD L, JAKOBSEN M K, PALMGREN M G, HARPER J F. A plant plasma membrane Ca2+pump is required for normal pollen tube growth and fertilization. Proceedings of the National Academy of Sciences, 2004, 101(25): 9502-9507.
[25] LI X Y, CHANROJ S, WU Z Y, ROMANOWSKY S M, HARPER J F, SZE H. A distinct endosomal Ca2+/Mn2+pump affects root growth through the secretory process. Plant Physiology, 2008, 147(4): 1675-1689.
[26] HUDA K M , BANU M S , GARG B,TULA S, TUTEJA R, TUTEJA N. OsACA6, a P-type IIB Ca2+ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing stress-responsive genes.Plant Journal for Cell & Molecular Biology, 2013, 76(6): 997.
[27] 程涣, 苏同兵, 于拴仓, 张凤兰, 余阳俊, 张德双, 赵岫云, 汪维红, 卢桂香, 龚义勤, 柳李旺. 大白菜钙运输基因ECA和钙响应基因CAS在缺钙胁迫下的表达分析. 植物生理学报, 2015, 51(4): 566-572.
CHENG H, SU T B, YU S C, ZHANG F L, YU Y J, ZHANG D S, ZHAO X Y, WANG W H, LU G X, GONG Y Q, LIU L W. Expression analysis of Ca2+Transport and response genes, ECA and CAS, in cabbage under calcium deficiency condition. Plant Physiology Communications, 2015, 51(4): 566-572. (in Chinese)
[28] ROMBAUTS S, DÉHAIS P, VAN MONTAGU M, ROUZÉ P. PlantCARE, a plant-acting regulatory element database. Nucleic Acids Research, 1999, 27(1): 295-296.
[29] ARTIMO P, JONNALAGEDDA M, ARNOLD K, BARATIN D, CSARDI G, DE CASTRO E, DUVAUD S, FLEGEL V, FORTIER A, GASTEIGER E. ExPASy: SIB bioinformatics resource portal. Nucleic Acids Research, 2012, 40: W597-W603.
[30] HORTON P, PARK K J, OBAYASHI T, FUJITA N, HARADA H, ADAMS-COLLIER C J, NAKAI K T. WoLF PSORT: protein localization predictor. Nucleic Acids Research, 2007, 35(Web Server issue): W585-W587.
[31] TAMURA K, PETERSON D, PETERSON N, STECHER G, NEI M, KUMAR S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731-2739.
[32] GUO A Y, ZHU Q H, CHEN X, LUO J C. GSDS: a gene structure display server. Hereditas, 2007, 29(8): 1023-1026.
[33] CHEN C J, CHEN H, ZHANG Y, THOMAS H R, FRANK M H, HE Y H, XIA R. TBtools: an integrative toolkit developed for interactive analyses of big biological data. Molecular Plant, 2020, 13(8): 1194-1202.
[34] WANG Y P, TANG H B, DEBARRY J D, TAN X, LI J P, WANG X Y, LEE T H, JIN H Z, MARLER B, GUO H, KISSINGER J C, PATERSON A H. MCScanX: a toolkit for detection and evolutionary analysis of gene synteny and collinearity. Nucleic Acids Research, 2012, 40(7): e49.
[35] XU Q F, DUNBRACK R L. Assignment of protein sequences to existing domain and family classification systems: Pfam and the PDB. Bioinformatics, 2012, 28(21): 2763-2772.
[36] BAILEY T L, WILLIAMS N, MISLEH C, LI W W. MEME: discovering and analyzing DNA and protein sequence motifs. Nucleic Acids Research, 2006, 34(Suppl_2): W369-W373.
[37] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTMethod. Methods, 2001, 25(4): 402-408.
[38] 常琳, 刘妍, 董发才, 宋纯鹏. 拟南芥内源茉莉酸甲酯缓解盐胁迫的生理生化分析. 中国植物生理学会第十次会员代表大会暨全国学术年会.开封. 2009.
CHANG L, LIU Y, DONG F C, SONG C P. Physiological and biochemical analysis of endogenous methyl jasmonate alleviating salt stress in. The 10th Congress of the Chinese society of plant physiology and its annual meeting. Kaifeng. 2009. (in Chinese)
[39] 庞洪影. 茉莉酸甲酯调控刺槐抗盐性的生理机制研究[D]. 哈尔滨: 东北林业大学, 2012.
PANG H Y. Physiological mechanism of methyl jasmonate regulating salt resistance of[D]. Harbin: Northeast Forestry University, 2012. (in Chinese)
[40] MORTAZAVI A, WILLIAMS B A, MCCUE K, SCHAEFFER L, WOLD B. Mapping and quantifying mammalian transcriptomes by RNA-Seq. Nature Methods, 2008, 5(7): 621-628.
[41] GIFFORD J L, WALSH M P, VOGEL H J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs.Biochemical Journal, 2007, 405(2): 199-221.
[42] 汤寓涵, 夏星, 陈德伟, 赵大球, 陶俊. 芍药CIPK基因克隆及其响应钙调控的表达水平研究. 植物生理学报, 2018, 54(8): 1316-1324.
TANG Y H, XIA X, CHEN D W, ZHAO D Q, TAO J. Cloning of herbaceous peony CIPK gene and its expression level analysis in response to calcium regulation. Plant Physiology Communications, 2018, 54(8): 1316-1324.(in Chinese)
[43] BAXTER I, TCHIEU J, SUSSMAN M R, BOUTRY M, PALMGREN M G, GRIBSKOV M, HARPER J F, AXELSEN K B. Genomic comparison of P-type ATPase ion pumps inand rice. Plant Physiology, 2003, 132(2): 618-628.
[44] HUDA K M K, BANU M S A, GARG B, TULA S, TUTEJA R, TUTEJA N. OsACA6, a P-type IIB Ca²⁺ ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes. The Plant Journal, 2013, 76(6): 997-1015.
[45] IWANO M, IGARASHI M, TARUTANI Y, KAOTHIEN- NAKAYAMA P, NAKAYAMA H, MORIYAMA H, YAKABE R, ENTANI T, SHIMOSATO-ASANO H, UEKI M, TAMIYA G, TAKAYAMA S. A pollen coat-inducible autoinhibited Ca2+-ATPase expressed in stigmatic papilla cells is required for compatible pollination in the Brassicaceae. The Plant Cell, 2014, 26(2): 636-649.
[46] GIACOMETTI S, MARRANO C A, BONZA M C, LUONI L, LIMONTA M, DE MICHELIS M I. Phosphorylation of serine residues in the N-modulates the activity of ACA8, a plasma membrane Ca2+-ATPase of. Journal of Experimental Botany, 2011, 63(3): 1215-1224.
[47] 周君, 肖伟, 陈修德, 高东升, 李玲. 外源钙对‘黄金梨’叶片光合特性及果实品质的影响. 植物生理学报, 2018, 54(3): 449-455.
ZHOU J, XIAO W, CHEN X D, GAO D S, LI L. Effect of exogenous calcium on leaf photosynthetic characteristics and fruit quality of ‘Whangkeumbae’ pear. Plant Physiology Communications, 2018, 54(3): 449-455.(in Chinese)
[48] 赵娟, 王芳, 李永生, 姚海梅, 张同祯, 方永丰, 王汉宁. 钙对低温胁迫下玉米种子萌发及幼苗生长的影响. 甘肃农业大学学报, 2016, 51(6): 30-35.
ZHAO J A, WANG F, LI Y S, YAO H M, ZHANG T Z, FANG Y F, WANG H N. Effects of calcium on maize seed germination and seedling growth under low temperature stress. Journal of Gansu Agricultural University, 2016, 51(6): 30-35.(in Chinese)
[49] 史晓龙, 张智猛, 戴良香, 张冠初, 慈敦伟, 丁红, 田家明. 外源施钙对盐胁迫下花生营养元素吸收与分配的影响. 应用生态学报, 2018(10): 3302-3310.
SHI X L, ZHANG Z M, DAI L X, ZHANG G C, CI D W, DING H, TIAN J M. Effects of calcium fertilizer application on absorption and distribution of nutrients in peanut under salt stress. Chinese Journal of Applied Ecology, 2018(10): 3302-3310.(in Chinese)
[50] YANG X E, WANG S S, WANG M, QIAO Z, BAO C C, ZHANG W.calmodulin-like protein CML24 regulates pollen tube growth by modulating the actin cytoskeleton and controlling the cytosolic Ca2+concentration. Plant Molecular Biology, 2014, 86(3): 225-236.
Genome-Wide Identification and Expression Analysis of ACA Gene Family in
WANG Jie, WU XiaoYu, YANG Liu, DUAN QiaoHong, HUANG JiaBao
College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 270108, Shandong
【Objective】The aim of this study was to identify ACA genes family from, and to analyze the commonness and characteristics of those genes, which provided data support for further revealing the evolutionary relationship of ACA family. At the same time, the expression ofafter self-pollination under abiotic stress was investigated, which laid the foundation for further exploring howas regulate calcium to perform some biological functions. 【Method】Based on Arabidopsis genome database, the ACA gene family ofwas identified by homologous alignment. The molecular weight, theoretical isoelectric point and other physicochemical properties were predicted by online software Expasy. The MEGA 5.0 software was used to construct phylogenetic tree, and the online software GSDS 2.0 was employed to draw gene structure map. According to the family gene location information, chromosome mapping was carried out in TBtools. Then, McscanX software was used to carry out the collinearity analysis of ACA family genes inand, and the online software PlantCARE was used to predict and analyze the promoter elements of. The protein conserved domains were analyzed by online tools Pfam and MEME. The expression ofgene in different tissues, abiotic stress and self-pollination were detected by qRT-PCR. 【aResult】A total of 18 ACA genes were systematically identified from, which were distributed on 10 chromosomes. According to the phylogenetic tree, four groups were classified, including 3, 4, 4 and 7 members. According to promoter element analysis, there were many light, abiotic stress and hormone response elements in the promoter of ACA family genes in, which indicated that ACA family genes had potential biological function of resisting stress. According to the analysis of protein domains, most of the ACA gene family proteins inhad four functional domains unique to the ACA family, 13 of which had N-terminal autoinhibitory domains. The results of qRT-PCR showed thatwere mainly expressed in flowers and pods, and the expression ofandgenes were up-regulated under chill stress, suggesting thatandhad potential biological functions in response to chill stress; the expression ofgene was up-regulated under salt stress, suggesting thathad potential biological functions in response to salt stress. There were significant differences in the expression ofandgenes between self-pollination and cross-pollination, suggesting thatandresponded to the self-incompatibility of. The subcellular localizations of these five genes were all located in the plasma membrane to verify their function of balancing ion concentration on the membrane. 【Conclusion】BraACAs protein structures contained four highly conserved domains. The expression ofwas specific in tissues, and five ACA family gene members encoded proteins located on the cell membrane, of which,,were associated with chilling and salt stress response, whileandwere associated with self-incompatibility reaction.
ACA gene family;Ca2+-ATPase; chilling stress; salt stress; self-incompatibility;
2021-01-25;
2021-06-01
山东省“双顶”计划(SYL2017YSTD06)、山东省农业良种工程项目(2019LZGC006)
王洁,E-mail:17835423101@163.com。通信作者段巧红,E-mail:duanqh@sdau.edu.cn。通信作者黄家保,E-mail:jbhuang2018@outlook.com
(责任编辑 赵伶俐)
