circ_0000212靶向miR-139-5p对肝癌细胞增殖、迁移、侵袭、凋亡以及紫杉醇敏感性的影响
2021-12-07张惠忠张晓东黄建新
张惠忠,张晓东,黄建新
张惠忠,张晓东,黄建新,金华广福肿瘤医院肝胆胰胃外科 浙江省金华市 321111
张惠忠,主治医师,研究方向为肝胆胰胃外科
0 引言
肝癌是世界上最常见的恶性肿瘤之一,具有恶性程度高、预后差等特点,严重危害人们的生命健康.手术切除、经导管动脉化疗栓塞、靶向药物治疗的应用虽然延长了肝癌患者的生存时间,但由于肝血供丰富,术后复发和转移仍是肝癌患者死亡的主要原因[1].紫杉醇是治疗肝癌的常用化疗药物,然而在连续治疗后肝癌细胞通常对紫杉醇脱敏,这严重限制其临床疗效[2].阐明肝癌进展、紫杉醇耐药的分子机制,对开发新的肝癌治疗策略至关重要.环状RNA(circRNA)是起源于外显子、内含子或基因间区域的闭环结构RNA分子,其可能通过与特定微小RNA(miRNA)结合而扮演竞争性内源RNA(ceRNAs)角色,从而调控下游基因表达,参与癌细胞增殖、转移、耐药等一系列生物学过程[3,4].研究报道circ_0000212在结直肠癌组织中表达增加,circ_0000212通过靶向miR-491和调节叉头框蛋白4(FOXP4)表达来促进结直肠癌细胞增殖[5].生物信息学分析发现miR-139-5p是circ_0000212的潜在靶点.miR-139-5p低表达被报道与肝癌患者预后差相关,上调miR-139-5p可抑制肝癌细胞的糖酵解代谢、增殖和转移[6].然而,circ_0000212是否靶向miR-139-5p参与癌症进展仍有待研究.本研究从细胞增殖、迁移、侵袭、凋亡和紫杉醇耐药角度探讨circ_0000212和miR-139-5p在肝癌进展中的作用,旨在为抑制肝癌进展、克服紫杉醇耐药提供可用靶点.
1 材料和方法
1.1 材料
1.1.1 一般资料:肝癌组织和对应癌旁组织(正常组织)取自2018-05/2019-05在我院接受手术治疗的41例肝癌患者.男性37例,女性4例,年龄在48-73岁之间,中位年龄57岁.切除后将组织快速冷冻,然后在-80 ℃下保存.
1.1.2 细胞和试剂:人肝癌细胞HCC9204购自美国ATCC;Trizol试剂盒、逆转录试剂盒购自美国Thermo fisher公司;SYBR Green mix试剂盒购自大连Takara公司;DMEM培养基、青链霉素混合液、胎牛血清购自武汉普诺赛生物公司;紫杉醇(纯度99.9%)购自上海研生生化试剂有限公司;细胞计数试剂盒(CCK-8)、si-circ_0000212、miR-139-5p inhibitor购自上海生工生物工程公司;膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒购自南京诺维赞生物公司;Transwell小室购自美国Corning公司;山羊抗兔IgG二抗(ab205718)、兔cleaved-caspase3多克隆抗体(ab2302)兔磷酸甘油醛脱氢酶(GAPDH)多克隆抗体(ab245355)购自美国Abcam公司.
1.2 方法
1.2.1 RT-qPCR检测肝癌组织中circ_0000212和miR-139-5p表达:用Trizol试剂盒从组织中提取总RNA,根据逆转录试剂盒说明书合成cDNA,采用SYBR Green mix试剂盒进行RT-qPCR.反应条件为94 ℃ 2 min;然后94 ℃ 15 s和60 ℃1 min,循环40次.2-ΔΔCt法计算circ_0000212和miR-139-5p表达水平.circ_0000212上游引物5′-GTT TGG GAG GCT TCT TGG TAA T-3′,circ_0000212下游引物5′-AAA GCC AGT TTC CTC CAA GC-3′;GAPDH上游引物5′-CAC CCA CTC CTC CAC CTT TG-3′,GAPDH下游引物5′-CCA CCA CCC TGT TGC TGT AG-3′;miR-139-5p上游引物5′-TCT ACA GTG CAC GTG TCT CCA G-3′,miR-139-5p下游引物5′-GTG CAG GGT CCG AGG T-3′;U6上游引物5′-TGC GGG TGC TCG CTT CGG CAG C-3′,U6下游引物5′-GTG CAG GGT CCG AGG T-3′.
1.2.2 细胞培养:HCC-9204细胞接种到1%青链霉素双抗+10%胎牛血清+89%DMEM培养基的培养皿,置于37 ℃、CO2体积分数为5%的培养箱孵育.当细胞融合度达到80%时,胰蛋白酶消化细胞,1:2-1:3传代.
1.2.3 紫杉醇浓度筛选:将对数期HCC-9204细胞按照5×103个/孔接种于96孔板,分别用含1-40 nmol/L紫杉醇的培养液孵育细胞48 h,向各孔内添加10 μL CCK-8试剂,在37 ℃下继续孵育2 h.酶标仪检测450 nm处各孔的光密度(OD)值.存活率(%)=实验A/对照A×100%.选择12 nmol/L紫杉醇进行实验.
1.2.4 实验分组:将对数期HCC-9204细胞按照2×104个/孔接种于96孔板,用Lipofectamine 2000分别将sicirc_0000212、si-circ_0000212+miR-139-5p inhibitor分别转染融合度为50%HCC-9204细胞,培养48 h后收集细胞.实验分组:未做任何处理的HCC-9204细胞记为对照组;转染si-circ_0000212、转染si-circ_0000212+miR-139-5p inhibitor的细胞分别记为干扰circ_0000212组、干扰circ_0000212+miR-139-5p inhibitor组;用含12 nmol/L紫杉醇培养液孵育HCC-9204细胞,记为紫杉醇组;用含12 nmol/L紫杉醇培养液孵育转染si-circ_0000212、转染si-circ_0000212+miR-139-5p inhibitor的细胞,分别记为紫杉醇+干扰circ_0000212组、紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组.
1.2.5 双荧光素酶报告基因实验:含有野生型(WT)circ_0000212序列的荧光素酶报告载体WT-circ_0000212,或者含有突变型(MUT)circ_0000212序列的荧光素酶报告载体MUT-circ_0000212由上海生工公司提供.将WTcirc_0000212分别与miR-NC或miR-139-5p mimic共转染到HCC9204细胞中;同时,将MUT-circ_0000212分别与miR-NC或miR-139-5p mimic共转染到HCC9204细胞中.培养48 h后,收集细胞并使用双荧光素酶检测试剂盒测定相对荧光素酶活性.
1.2.6 CCK-8和集落形成实验检测细胞增殖:CCK-8法:将未转染细胞、转染si-circ_0000212细胞或转染sicirc_0000212+miR-139-5p inhibitor细胞按照5×103个/孔接种于96孔板,根据1.2.4实验分组分别给予紫杉醇(12 nmol/L)或不加药物的含血清培养基孵育细胞48 h.向各孔内添加10 μL CCK-8试剂,在37 ℃下继续孵育2 h.酶标仪检测450 nm处各孔的OD值.抑制率(%)=(1-实验OD/对照OD)×100%
集落形成实验:将各组HCC9204细胞按照5×102个/孔接种于6孔板,每2-3 d更换一次培养液,培养约2 w直到HCC9204细胞形成集落,用甲醇固定细胞集落,用0.1%结晶紫染色.在显微镜下计数大于50个细胞的集落数.
1.2.7 Transwell实验检测细胞迁移和侵袭:每组取1×104个HCC9204细胞重悬在200 μL无血清培养基中,并接种在包被matrigel涂层的Transwell上室.同时,向24孔板下室加入600 μL含10%胎牛血清的培养基.培养48 h后,棉签擦去未侵袭细胞,用4%聚甲醇固定膜下表面附着细胞,然后用0.1%结晶紫染色.显微镜下随机选择5个视野拍照并计数,以平均值表示HCC9204细胞侵袭数量.迁移测定时选择未包被matrigel涂层的Transwell上室,其余步骤同侵袭实验一致.
1.2.8 流式细胞仪检测细胞凋亡:收集各组HCC9204细胞,2000 rpm离心5 min,PBS洗涤3次.用500 μL的1×结合缓冲液重悬细胞,分别加入5 μL annexin V/FITC和碘化丙啶(PI).暗室孵育15 min后,使用流式细胞仪分析HCC9204细胞的凋亡情况.annexin V或PI染色的细胞计数为凋亡细胞.
1.2.9 Western blot检测Cleaved-caspase3蛋白表达:使用RIPA缓冲液裂解各组细胞,取约40 μg的提取蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,并湿法转移到聚偏氟乙烯(PVDF)膜.用5%牛血清白蛋白阻断PVDF膜,并与抗Cleaved-caspase3的一抗溶液4 ℃孵育12 h.随后将PVDF至于辣根过氧化物酶偶联的二抗中室温孵育1 h.将PVDF膜置于塑料薄膜上,滴加化学发光试剂进行显色反应.以Image J软件测得的Cleaved-caspase 3和GAPDH条带灰度值的比值表示蛋白表达水平.
统计学处理每组设置3个复孔,实验独立重复3次,所有数据以均数±标准差(mean±SD)表示,采用SPSS 22.0进行统计学分析.两组间差异采用独立样本t检验,多组间差异采用单因素方差分析和SNK-q检验.Pearson相关分析确定circ_0000212和miR-139-5p表达在肝癌组织中的关系.P<0.05为差异有统计学意义.
2 结果
2.1 circ_0000212和miR-139-5p在肝癌组织中表达的分析 与癌旁组织比较,肝癌组织中circ_0000212表达水平显著升高(P<0.05),miR-139-5p表达水平显著降低(P<0.05),见图1A和图1B.肝癌组织中circ_0000212和miR-139-5p表达水平呈负相关关系(r=-0.9928),见图1C.
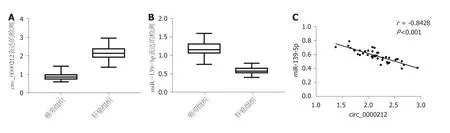
图1 circ_0000212和miR-139-5p表达的检测及相关性分析.A:肝癌组织中circ_0000212高表达;B:肝癌组织中miR-139-5p低表达;C:circ_0000212和miR-139-5p负相关.
2.2 紫杉醇对HCC9204中circ_0000212和miR-139-5p表达的影响 用不同浓度的紫杉醇处理HCC9204细胞48 h,随着紫杉醇浓度的增加HCC9204细胞存活率逐渐降低,紫杉醇对HCC9204细胞的IC50值为11.89 nmol/L.见图2.用12 nmol/L的紫杉醇孵育HCC9204细胞,与对照组比较,紫杉醇组HCC9204细胞circ_0000212表达水平显著降低(P<0.05),miR-139-5p表达水平显著升高(P<0.05),见图3.
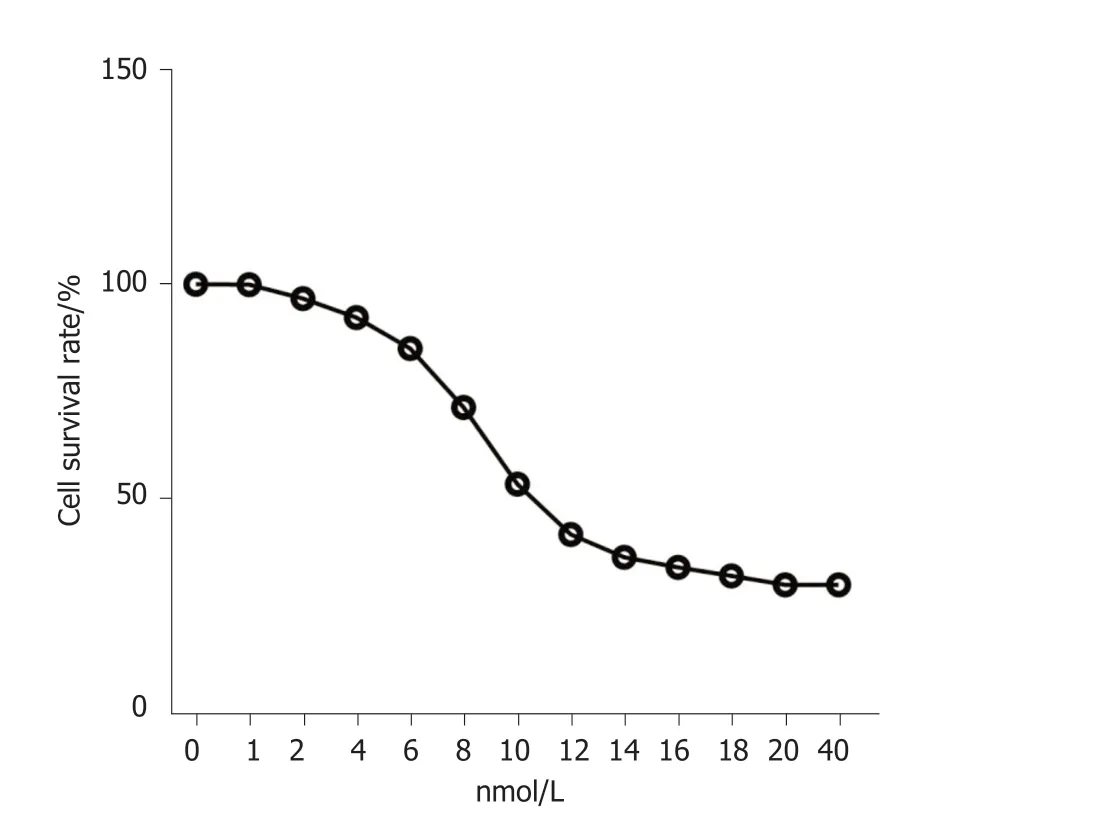
图2 不同浓度紫杉醇对HCC9204细胞存活率的检测.IC50=11.89 nmol/L.

图3 紫杉醇对circ_0000212和miR-139-5p表达的检测.与对照组相比,aP<0.05.
2.3 circ_0000212和miR-139-5p靶向关系 Circular RNA interactome预测结果见图4A,circ_0000212和miR-139-5p存在互补的核苷酸序列.miR-139-5p mimics和WTcirc_0000212共转染组HCC9204细胞的相对荧光素酶活性与miR-NC和WT-circ_0000212共转染组比较显著降低(P<0.05);miR-139-5p mimics和MUT-circ_0000212共转染组HCC9204细胞的相对荧光素酶活性与miR-NC和MUTcirc_0000212共转染组比较差异无统计学意义,见图4B.干扰circ_0000212组HCC9204细胞miR-139-5p表达水平与对照组比较显著升高(P<0.05),见图4C.

图4 circ_0000212靶向调控miR-139-5p.A:circ_0000212和miR-139-5p的互补序列;B:双荧光素酶报告实验;C:circ_0000212调控miR-139-5p的表达.
2.4 观察转染后紫杉醇对各组H C C9204增殖的影响 与对照组比较,干扰circ_0000212组、紫杉醇组HCC9204细胞抑制率显著升高(P<0.05),克隆形成数显著减少(P<0.05);与干扰circ_0000212组比较,干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞抑制率显著降低(P<0.05),克隆形成数显著增加(P<0.05);与紫杉醇组比较,紫杉醇+干扰circ_0000212组HCC9204细胞抑制率显著升高(P<0.05),克隆形成数显著减少(P<0.05);与紫杉醇+干扰circ_0000212组比较,紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞抑制率显著降低(P<0.05),克隆形成数显著增加(P<0.05),见图5和表1.

图5 HCC9204克隆形成数的检测.A:对照组;B:干扰circ_0000212组;C:干扰circ_0000212+miR-139-5p inhibitor组;D:紫杉醇;E:紫杉醇+干扰circ_0000212组;F:紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组.
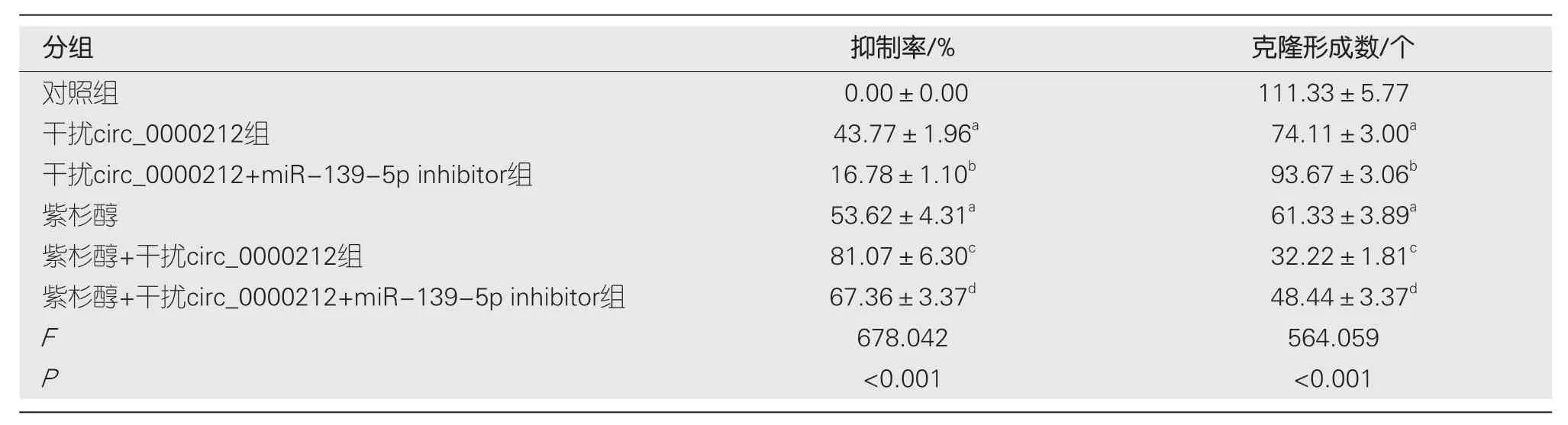
表1 转染后各组加入紫杉醇对HCC9204增殖的检测(mean±SD,n=9)
2.5 观察转染后紫杉醇对各组HCC9204迁移侵袭的影响 与对照组比较,干扰circ_0000212组、紫杉醇组HCC9204细胞迁移数、侵袭数显著减少(P<0.05);与干扰circ_0000212组比较,干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞迁移数、侵袭数显著增加(P<0.05);与紫杉醇组比较,紫杉醇+干扰circ_0000212组HCC9204细胞迁移数、侵袭数显著减少(P<0.05);与紫杉醇+干扰circ_0000212组比较,紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞迁移数和侵袭数显著增加(P<0.05),见图6、图7和表2.

图6 HCC9204迁移细胞数的检测.A:对照组;B:干扰circ_0000212组;C:干扰circ_0000212+miR-139-5p inhibitor组;D:紫杉醇;E:紫杉醇+干扰circ_0000212组;F:紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组.
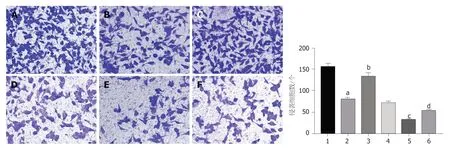
图7 HCC9204侵袭细胞数的检测.A:对照组;B:干扰circ_0000212组;C:干扰circ_0000212+miR-139-5p inhibitor组;D:紫杉醇;E:紫杉醇+干扰circ_0000212组;F:紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组.
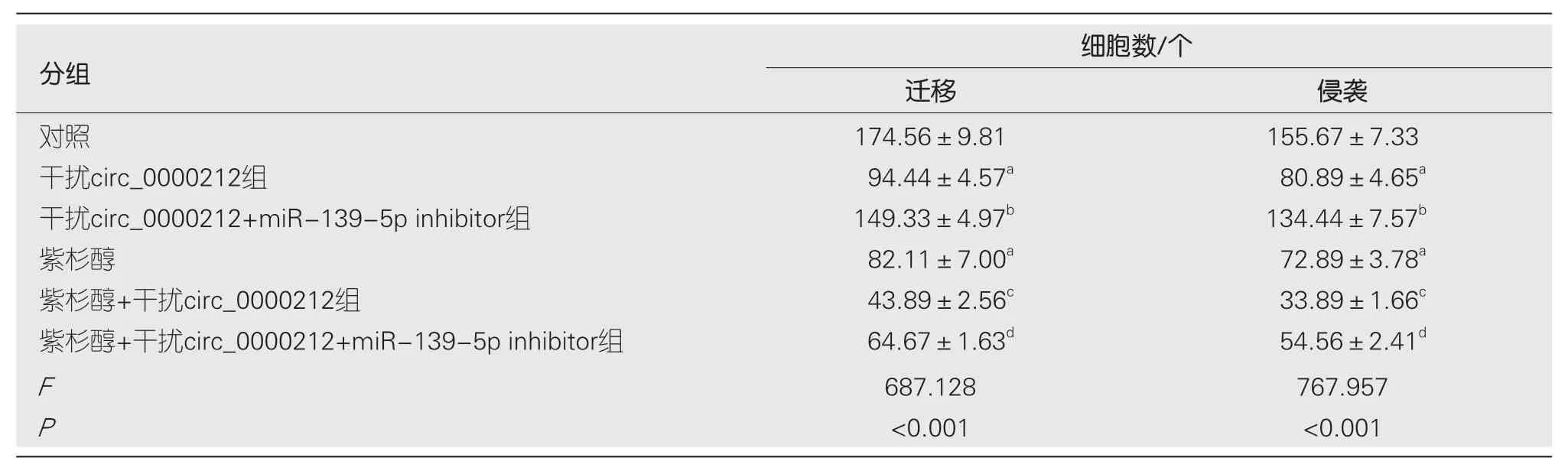
表2 转染后各组加入紫杉醇对HCC9204迁移侵袭的检测(mean±SD,n=9)
2.6 观察转染后紫杉醇对各组HCC9204凋亡的影响 与对照组比较,干扰circ_0000212组、紫杉醇组HCC9204细胞凋亡率、Cleaved-caspase3蛋白表达显著升高(P<0.05);与干扰circ_0000212组比较,干扰circ_0000212+miR-139-5p inhibitor组HCC9204细胞凋亡率、Cleaved-caspase3蛋白表达显著降低(P<0.05);与紫杉醇组比较,紫杉醇+干扰circ_0000212组HCC9204细胞抑凋亡率、Cleavedcaspase3蛋白表达显著升高(P<0.05);与紫杉醇+干扰circ_0000212组比较,紫杉醇+干扰circ_0000212 +miR-139-5p inhibitor组HCC9204细胞凋亡率、Cleaved-caspase3蛋白表达显著降低(P<0.05),见图8、图9和表3.
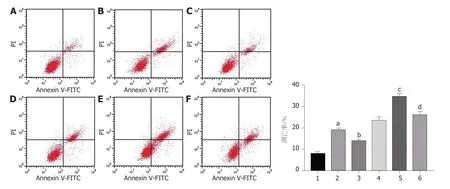
图8 HCC9204凋亡率的检测.A:对照组;B:干扰circ_0000212组;C:干扰circ_0000212+miR-139-5p inhibitor组;D:紫杉醇;E:紫杉醇+干扰circ_0000212组;F:紫杉醇+干扰circ_0000212+miR-139-5p inhibitor组.
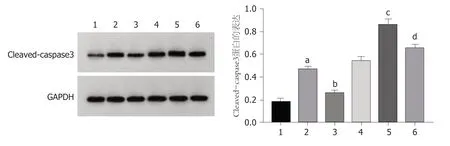
图9 Cleaved-caspase3蛋白表达的检测.
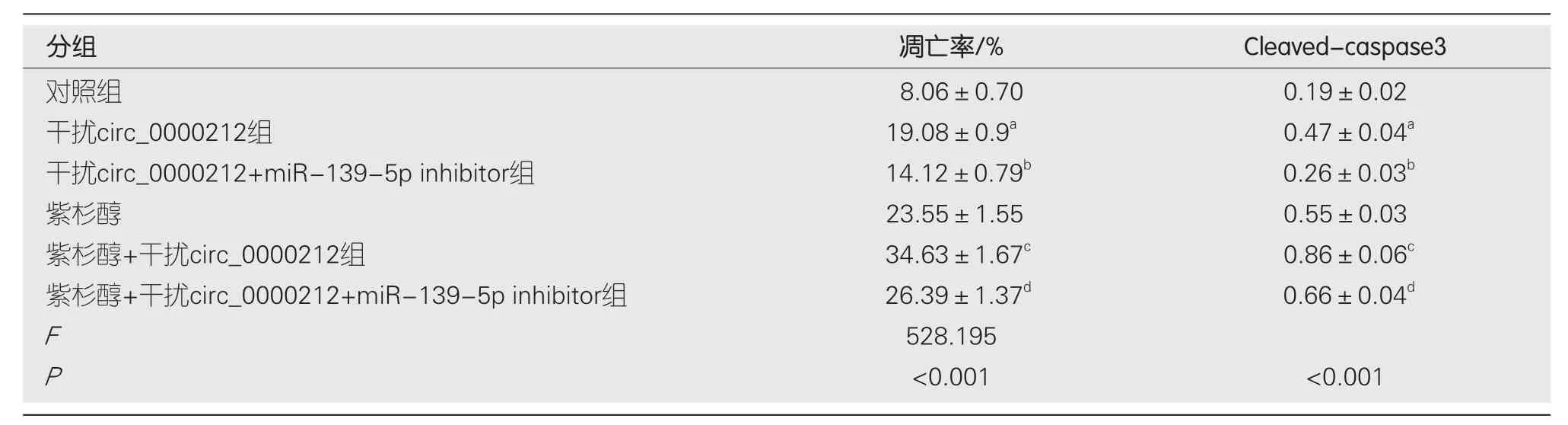
表3 转染后各组加入紫杉醇对HCC9204凋亡的检测(mean±SD, n=9)
3 讨论
circRNA已被报道参与肝癌进展的各个方面,例如circ_100395表达水平与肝癌肿瘤分化、微血管浸润和门静脉肿瘤血栓形成有关,上调circ_100395表达可诱导肝癌细胞凋亡,抑制上皮间质转化(epithelial-mesenchymal transition,EMT),降低迁移和侵袭能力[7].circ_0091570低表达能够促进肝癌细胞周期转换,促进细胞增殖能力,促进体内肿瘤生长[8].circ_0003418通过Wnt/β连环蛋白(β-catenin)通路抑制肝癌肿瘤发生和顺铂化疗耐药[9].circRNA杆状病毒IAP重复序列蛋白6基因(circ-BIRC6)低表达介导紫杉醇对肝癌肿瘤发生的抑制作用[10].本研究发现circ_0000212在肝癌组织中的表达显著升高,提示circ_0000212可能参与肝癌进展.体外功能分析表明,干扰circ_0000212可抑制肝癌HCC9204细胞增殖、迁移和侵袭能力,上调Cleaved-caspase3蛋白表达,诱导细胞凋亡,表明circ_0000212在肝癌中发挥致癌作用.Wang等[11]报道circ_0000212可促进宫颈癌细胞的增殖和侵袭能力,抑制细胞凋亡,在宫颈癌中起促肿瘤作用,这与本研究发现类似.紫杉醇处理可抑制HCC9204细胞增殖、迁移和侵袭能力,上调Cleaved-caspase3蛋白表达,诱导细胞凋亡,下调circ_0000212表达水平,且干扰circ_0000212表达显著增强紫杉醇对HCC9204细胞的抗增殖、抗迁移、抗侵袭和促凋亡作用,这提示干扰circ_0000212表达可提高HCC9204细胞对紫杉醇的敏感性.以上研究表明,干扰circ_0000212表达可能是抑制肝癌进展、紫杉醇化疗增敏的重要靶点.
目前研究显示circ_0000212在癌症进展中的作用均与调控miRNA表达有关[5,11].miR-139-5p为子宫内膜癌[12]、乳腺癌[13]等多种肿瘤的抑制因子,研究报道miR-139-5p低表达与非小细胞肺癌临床分期、病理分型、肿瘤大小、淋巴结转移相关[14].过表达miR-139-5p可抑制结直肠癌细胞体外增殖、迁移和侵袭能力,使肿瘤对化疗敏感,抑制肿瘤体内生长和转移[15].在肝癌中miR-139-5p对癌细胞活力、侵袭均有抑制作用,并抑制肝癌EMT和转移[16,17].本研究发现miR-139-5p在肝癌组织表达下调,且肝癌组织中miR-139-5p和circ_0000212表达呈负相关关系.此外,紫杉醇处理显著上调miR-139-5p表达水平.双荧光素酶报告基因检测证实miR-139-5p是circ_0000212的特异性靶点,这提示circ_0000212可能靶向miR-139-5p调控肝癌进展和紫杉醇敏感性.深入研究发现,抑制miR-139-5p表达显著减弱干扰circ_0000212表达对HCC9204细胞恶性生物行为的抑制作用,且减弱干扰circ_0000212表达联合紫杉醇处理对HCC9204细胞恶性生物行为的抑制作用,这进一步证实circ_0000212靶向miR-139-5p调控肝癌进展和紫杉醇敏感性.
4 结论
综上所述,circ_0000212在肝癌组织中表达增加,干扰circ_0000212通过靶向上调miR-139-5p表达诱导肝癌细胞凋亡,抑制其增殖、迁移和侵袭能力,并提高其对紫杉醇的敏感性.这些发现表明,circ_0000212和miR-139-5p可能是紫杉醇化疗增敏、抑制肝癌进展的潜在靶点.
文章亮点
实验背景
手术切除、经导管动脉化疗栓塞、靶向药物治疗的应用虽然延长了肝癌患者的生存时间,但由于肝血供丰富,术后复发和转移仍是肝癌患者死亡的主要原因.紫杉醇是治疗肝癌的常用化疗药物,然而在连续治疗后肝癌细胞通常对紫杉醇脱敏,这严重限制其临床疗效.circRNA作为非编码RNA,其可吸附miRNA参与癌细胞增殖、转移、耐药等一系列生物学过程.因此,亟需寻找新型circRNA作为肝癌的治疗靶点.
实验动机
circ_0000212在结直肠癌中表达升高,并可作为癌基因参与结直肠癌进展,但circ_0000212在肝癌中的表达方式和作用尚不清楚.靶基因预测显示miR-139-5p与circ_0000212存在结合位点,miR-139-5p在肝癌中表达降低,上调miR-139-5p可抑制肝癌细胞的糖酵解代谢、增殖和转移,因此本研究主要探索circ_0000212靶向miR-513b-5p在肝癌进展中的作用.
实验目标
验证circ_0000212在肝癌进展中发挥致癌作用,circ_0000212通过靶向调控miR-139-5p从而调控肝癌细胞恶性行为和紫杉醇敏感性.
实验方法
采用RT-qPCR检测circ_0000212和miR-139-5p在肝癌组织、癌旁组织中的表达.双荧光素酶报告实验验证circ_0000212和miR-139-5p靶向关系.CCK-8法检测细胞增殖抑制率;集落形成实验检测细胞集落形成能力;流式细胞术检测细胞凋亡率;Transwell实验检测细胞迁移和侵袭数.
实验结果
肝癌组织中circ_0000212表达上调,miR-139-5p表达下调.circ_0000212可靶向负调控miR-139-5p表达.干扰circ_0000212可抑制肝癌细胞增殖、迁移、侵袭能力,诱导细胞凋亡,并提高其对紫杉醇的敏感性.circ_0000212靶向负调控miR-139-5p表达.抑制miR-139-5p表达显著减弱干扰circ_0000212表达对肝癌细胞增殖、迁移、侵袭、凋亡以及紫杉醇敏感性的影响.
实验结论
干扰circ_0000212通过靶向上调miR-139-5p可抑制肝癌细胞增殖、迁移、侵袭能力,诱导细胞凋亡,并提高其对紫杉醇的敏感性.
展望前景
circ_0000212和miR-139-5p可能是紫杉醇化疗增敏、抑制肝癌进展的潜在靶点.
