乳源乳杆菌的益生特性及抗氧化活性研究
2021-12-06叶望娟雷文平周杏荣周佳豪汪镇南刘成国
叶望娟,雷文平,周杏荣,周佳豪,汪镇南,刘成国,周 辉*
(1.湖南农业大学 食品科学技术学院,湖南 长沙 410128;2.湖南科赛安生物科技有限公司,湖南 长沙 410014)
乳酸菌(lactic acid bacteria,LAB)是指一类能在可利用的碳水化合物发酵过程中产生乳酸的细菌。目前发现LAB主要有包括乳杆菌属、链球菌属、明串珠菌属、歧杆菌属及片球菌属等[1]。益生菌在拉丁文中指“对生命有益”,而LAB是益生菌的一个重要来源[2]。益生菌具有如下特点:抗逆性强[3-4],数量多,黏附能力强[5],能发挥理化作用和生物学作用来抑制致病菌生长[6],具有安全性[7],具有促进健康的作用,如免疫调节、抗氧化、抗肿瘤、降胆固醇等[8-10]。当给予足够量的益生菌时,其会以足够的数量到达肠道,从而为宿主带来健康益处[11]。
益生菌发挥抗氧化作用主要通过以下几种方式:清除细胞周围活性氧自由基、鳌合金属离子以缓解脂质过氧化、自身抗氧化防御系统发挥抗氧化作用、下调产生活性氧的酶活性、上调宿主的抗氧化酶活性、益生菌产生抗氧化代谢物、调节相关信号通路、增加了宿主的抗氧化代谢物水平、调节肠道微生物群[12]。WANG B G等[13]的研究表明,口服双歧杆菌ATCC 29521对小鼠有显著影响,能显著提高小鼠谷胱甘肽过氧化物酶、超氧化物歧化酶、过氧化氢酶活性和丙二醛水平。CUEVAS-GONZÁLE P F等[14]研究表明,特定乳杆菌菌株具有抗氧化特性的代谢物,这可能有助于减轻丙烯酰胺诱导的人红细胞的氧化应激。
本研究选用实验室从鲜乳中分离保存的5株乳杆菌,通过对菌株的抗逆性、抗生素敏感性、抑菌能力、黏附性进行测定评估其益生菌潜力;并通过体外抗氧化测定,筛选出具高抗氧化活性的菌株,以期为后续实验提供数据支持和理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
植物乳杆菌(Lactobacillus plantarum)12E、植物乳杆菌(L.plantarum)15E、短乳杆菌(L.brevis)24E、鼠李糖乳杆菌(L.rhamnosus)260、干酪乳杆菌(L.casei)83:由湖南农业大学食品科技学院乳品加工实验室分离保存;大肠杆菌(Escherichiacoli)CGMCC9181、鼠李糖乳杆菌(L.rhamnosus)LGG(ATCC 53103)、单增李斯特菌(Listeria monocytogenes)ATCC 19115:本实验室保存;Caco-2细胞(ATCC HTB-37):长沙隆和化玻实验用品有限公司。
1.1.2 试剂
胰蛋白酶(酶活50 000 U/g):国药集团化学试剂有限公司;胃蛋白酶(3 000~3 500 U/g)、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒、羟自由基清除能力检测试剂盒:北京索莱宝科技有限公司;抗生素试剂盒(20种):杭州微生物试剂有限公司;胎牛血清、磷酸盐缓冲盐溶液(phosphate buffered saline,PBS):以色列贝特哈梅克生物工业公司。
1.1.3 培养基
MRS(Man Rogosa Sharpe)肉汤培养基:广东环凯微生物科技有限公司;杜氏改良Eagle培养基(Dulbecco's modified Eagle's medium,DMEM):以色列贝特哈梅克生物工业公司。
1.2 仪器与设备
GZ-400-S恒温培养箱:韶关市广智科技设备有限公司;Multiskan GO全波长酶标仪:赛默飞世尔科技(中国)有限公司;HR/T16M台式高速冷冻离心机:湖南赫西仪器装备有限公司;HF90二氧化碳培养箱:力康生物医疗科技控股有限公司。
1.3 方法
1.3.1 菌株培养和样品制备
受试菌株在-80 ℃保藏于甘油管中,试验开始前,将甘油管中的菌种接种于1 mL的MRS肉汤中,37 ℃恒温培养24 h后,活化两代后待用。
菌悬液的制备:活化两代后的菌株以106CFU/mL接种量接种至5 mL新鲜培养基中培养24 h,于4 ℃、10 000 r/min条件下离心2 min,弃上清,将菌体沉淀用无菌生理盐水洗涤两次后重悬,调整菌体浓度为1×108CFU/mL。
菌株发酵上清液:发酵液于4 ℃、10 000 r/min条件下离心5 min,收集上清液,转移至新离心管中。
1.3.2 耐酸能力测定
根据AZHAR M A等[15]的方法稍作修改,将菌株以106CFU/mL接种量分别接种至pH 2和3的MRS液体培养基中,37 ℃恒温培养,分别在培养0 h和6 h时测定菌液在波长600 nm处的OD600nm值,并计算ΔOD600nm。每个实验重复3次。公式如下:
ΔOD600nm=OD600nm(6 h)-OD600nm(0 h)
1.3.3 耐胆盐能力测定
将菌株以106CFU/mL接种量,接种至牛胆盐含量分别为0、0.1%、0.3%、0.5%的MRS液体培养基中,调整培养基pH至6.8,37 ℃恒温培养,分别在0 h和6 h测定菌液在波长600 nm处OD600nm值的变化,并计算ΔOD600nm。每个实验重复3次。公式同1.3.2。
1.3.4 模拟胃肠液耐受能力测定
0.5 mL菌悬液加入4.5 mL模拟胃液或肠液[16]中,混合均匀,于37 ℃条件下孵育3 h,分别计数0 h及3 h时混合液中的活菌数量,以菌株存活率评估菌株对模拟胃肠液的耐受能力(以鼠李糖乳杆菌(L.rhamnosus)LGG为阳性对照)。菌株存活率计算公式如下:

1.3.5 抑菌活性测定
将指示菌(大肠杆菌、金黄色葡萄球菌和单增李斯特菌)活化3代后,以105CFU/mL接种量接种于营养琼脂培养基,倾注平板待其凝固后放置牛津杯,将试验菌株发酵上清液200 μL加至牛津杯中,4 ℃静置4 h后在37 ℃条件下培养10 h,量取抑菌圈直径。
1.3.6 抗生素敏感性测定
菌株以106CFU/mL接种量接种于无菌MRS琼脂培养基中,混匀后倾注平板。待凝后将20种抗生素药敏试纸贴于平板上,37 ℃恒温培养,2 d后测定其抑制圈直径。
1.3.7 表面特性研究
根据SOPHATHA B等[17]的方法稍作修改。取2 mL菌悬液,分别加入等体积的正十六烷或乙酸乙酯,涡旋振荡2 min,37 ℃静置30 min后取水相测其波长600 nm处的吸光度值,以鼠李糖乳杆菌(L.rhamnosus)LGG为阳性对照菌。通过以下公式进行计算:

式中:A1为静置30 min后水相的吸光度值;A0为初始菌悬液的吸光度值。
1.3.8 黏附性测定
根据ZIELIN′SKA D[18]稍作修改。细胞培养:将复苏后Caco-2转入细胞瓶中,使用含20%胎牛血清的DMEM培养基,于5% CO2、37 ℃条件下培养,每2 d换液,待细胞贴壁生长为单层细胞后进行传代,传代5次后进行试验。黏附试验前细胞传代,调整细胞浓度为1×106CFU/mL并接种1 mL至6孔培养板中,待细胞贴壁生长为单层细胞后用于黏附试验研究。菌悬液制备:菌株经无菌PBS洗涤两次后,重悬于10%胎牛血清DMEM培养基,并调整菌悬液的浓度为1×108CFU/mL(V0)。
乳酸菌对Caco-2细胞的黏附计数:向6孔板中添加菌悬液之前,用无菌PBS缓冲液洗涤6孔板中单层Caco-2细胞两次,向每孔加入1 mL浓度为1×108CFU/mL的菌悬液,将6孔板转移至5% CO2、37 ℃培养箱中孵育2 h后;用PBS溶液洗涤3次,去除未黏附的菌体;然后加入1 mL PBS,用细胞刮获取细胞,平板计数法计算黏附细菌数(V1)。计算公式如下:
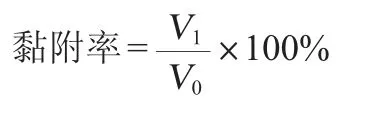
1.3.9 抗氧化活性测定
菌株总抗氧化能力(total antioxidant capacity,T-TOC)与羟自由基清除能力:根据检测试剂盒的说明书进行;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力:参照张香美等[19]的方法并稍作修改,将发酵上清液用无水乙醇稀释适应倍数后取0.5 mL,加入1 mL的浓度为0.2 mmol/L的DPPH自由基无水乙醇溶液,混匀后在室温条件下避光反应30 min,并10 000 r/min 离心1 min,取上清液在波长517 nm处测定吸光度值。空白组以等体积无水乙醇代替DPPH溶液,对照组以等体积蒸馏水代替样品溶液。

式中:A0为对照吸光度值;A1为样品组吸光度值;A2为空白组吸光度值。
1.3.10 活菌数的测定
菌株的活菌数参照GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》进行测定。
1.3.11 数据分析利用Excel 2010软件进行数据整理及统计分析,以SPSSStatistics21进行方差分析(analysisofvariance,ANOVA)和LSD多重比较,显著水平P≤0.05;使用Origin 2021软件绘图。
2 结果与分析
2.1 耐酸能力测定
由图1可知,所有菌株均能在pH=2、pH=3环境下生长。其中菌株12E在pH=3时对酸的耐受性显著高于其他菌株(P<0.05);在pH=2时对酸的耐受性与其他菌株差异不显著(P>0.05)。菌株15E在pH=3时对酸的耐受性显著高于菌株83、260、24E(P<0.05),显著低于菌株12E(P<0.05),与对照菌株LGG差异不显著(P>0.05);在pH=2时对酸的耐受性显著高于菌株24E(P<0.05),与其他菌株差异不显著(P>0.05)。在耐酸能力上菌株12E、15E优于其他试验菌株,这可能是由于植物乳杆菌与其他菌相比,生长快并且活菌数比较高,同时产酸能力更强的原因。因此,对酸胁迫抵抗能力更强[20]。

图1 不同乳酸菌对酸性环境的耐受性Fig.1 Tolerance of different lactic acid bacteria to acidic environment
2.2 耐胆盐能力测定
由表1可知,随着胆盐含量的增加,对菌株生长抑制作用增加,但所有菌株在不同胆盐含量环境中均能生长。且所有菌株ΔOD600nm均显著高于对照菌株LGG(P<0.05),表明菌株83、260、12E、15E和24E对胆盐耐受性均优于对照菌株LGG。
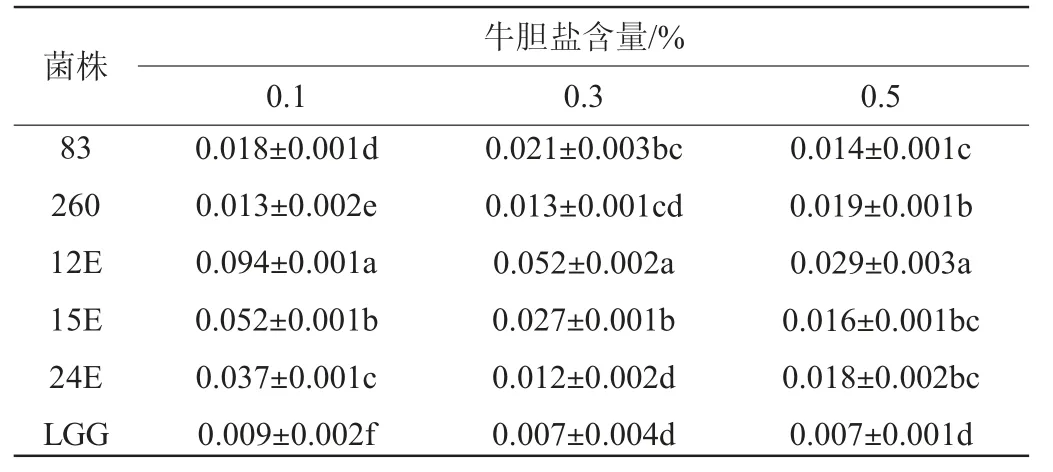
表1 不同乳酸菌对胆盐的耐受性Table 1 Tolerance of different lactic acid bacteria to bile salts
2.3 模拟胃肠液耐受能力测定
由图2可知,经模拟胃液与肠液消化3 h后,除在模拟肠液中菌株12E(70.56±0.07)%和15E(59.38±0.88)%存活率较低以外,其他菌株存活率均高于90%。说明试验菌株均具有一定在肠液和胃液中存活的能力,使其以活菌形式进入肠道并且定殖发挥益生功效成为可能。

图2 不同乳酸菌对模拟胃肠液的耐受性Fig.2 Tolerance of different lactic acid bacteria to simulated gastrointestinal fluid
2.4 抗生素敏感性测定
由表2可知,所有菌株对青霉素类、头孢类、四环素类、大环内酯类均具有敏感性,大部分对氨基糖苷类抗生素不敏感,这是由于氨基糖苷类抗生素对大多数厌氧菌以及兼性厌氧菌无效且在酸性环境中抗菌活性较弱[21-22]。菌株12E、15E和24E对于青霉素类抗生素敏感性要略高于对照菌株LGG,其他菌株对于青霉素类抗生素敏感性与对照菌株LGG差异不显著(P>0.05)。

表2 不同乳酸菌抗生素敏感性比较Table 2 Comparison of antibiotic sensitivity of different lactic acid bacteria
2.5 抑菌活性测定
由图3可知,所有菌株发酵上清液均具有一定的抑菌能力,抑菌圈直径均>10 mm。对于大肠杆菌抑菌效果较好的菌株为15E(17±0.71)mm、12E(15.5±1.41)mm;所有菌株对金黄色葡萄球菌抑菌圈直径均>20 mm,所有菌株对单增李斯特菌抑菌圈直径均>13 mm。

图3 不同乳酸菌对大肠杆菌、单增李斯特菌、金黄色葡萄球菌抑菌活性Fig.3 Antibacterial activity of different lactic acid bacteria against Escherichia coli, Listeria monocytogenes and Staphylococcus aureus
2.6 表面特性研究
由图4可知,所有菌株对不同溶剂均表现出一定的表面疏水性。十六烷试验结果主要体现菌株表面疏水性,而乙酸乙酯试验结果反应的是菌株表面的Lewis酸碱性[22]。其中在十六烷中表现出疏水性最高的为菌株83(87.88±0.25)%,其次为菌株24E(80.52±2.06)%。而所有菌株均与乙酸乙酯结合率较低,说明菌株细胞表面都具有良好的电子供体特性,这一结果与早先的报告一致[24-25]。

图4 不同乳酸菌的疏水性比较Fig.4 Comparison of hydrophobicity of different lactic acid bacteria
2.7 黏附能力
由图5可知,菌株黏附能力因菌株和种类的不同而不同,其中菌株24E黏附率最高(9.71±0.44)%,其次是菌株260(4.16±0.27)%,二者均高于对照菌株LGG(2±0.39)%;菌株12E和15E黏附能力较差,均低于1%。据报道,不同的乳杆菌对Caco-2细胞的粘附率在1%~14%之间,具有菌株特异性[18,24]。疏水性可以促进微生物与宿主细胞的首次接触。然而,这种非特异性的相互作用较弱,许多研究证明疏水性与细菌粘附之间没有相关性[12,17]。有研究表明,除了表面电荷之外,其他乳杆菌菌株可能通过不同的机制,如特定的粘附素,与相应的特异性受体相结合形成特异性黏附。这将需要进一步的研究来研究粘附素介导的特定相互作用的粘附机制。

图5 不同乳酸菌的黏附能力比较Fig.5 Comparison of adhesion ability of different lactic acid bacteria
2.8 抗氧化能力
由表3可知,菌株对DPPH自由基、羟自由基的清除能力及总抗氧化能力三者之间并没有必然联系,这说明菌株抗氧化能力是多种机制的综合作用。所有菌株发酵上清液均对DPPH自由基具有较强的清除能力,均在49%以上,与对照菌株LGG(55.32±2.55)%差异不显著(P>0.05);菌株83、24E羟自由基清除率显著低于对照菌株LGG(P<0.05),菌株260、12E、15E羟自由基清除率与对照菌株LGG(31.34±9.83)%差异不显著(P>0.05);所有菌株发酵上清液总抗氧化能力均显著高于对照菌株LGG(4.67±1.17)μmol/mL(P<0.05)。
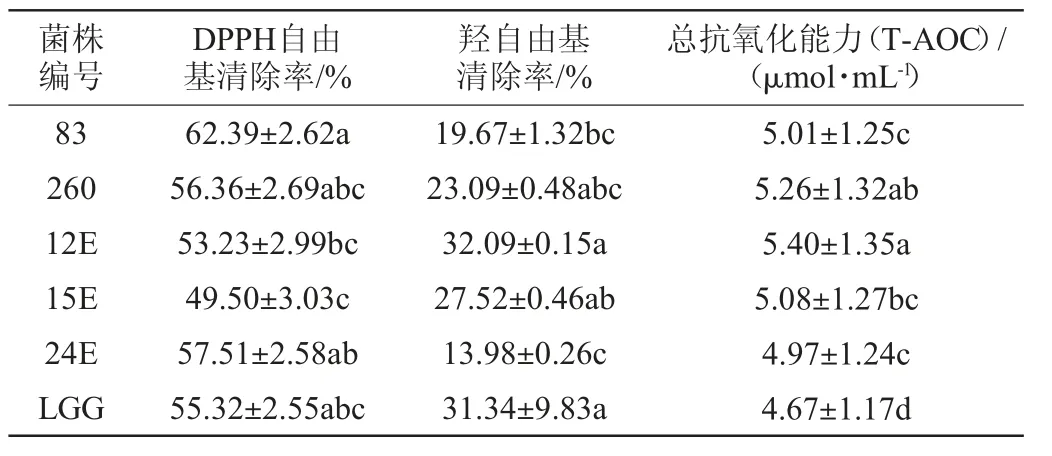
表3 不同乳酸菌发酵上清液抗氧化能力比较Table 3 Comparison of fermentation supernatant antioxidant capacity of different lactic acid bacteria
综合黏附能力与抗氧化能力来看,鼠李糖乳杆菌260益生特性较优,黏附能力较强,黏附率为4.16%;DPPH自由基清除能力56.36%、羟自由基的清除能力23.09%、总抗氧化能力(T-AOC)为5.26 μmol/mL。
3 结论
本研究通过对5株乳源性乳酸菌益生特性以及发酵上清液抗氧化活性进行评价,结果表明,5株乳杆菌均可在pH2、pH3,牛胆盐含量0.1%~0.5%环境中生长,经模拟胃液与肠液消化3 h后,除菌株12E和15E在模拟肠液中存活率较低以外,其他菌株存活率均高于90%,对青霉素类、头孢类、四环素类、大环内酯类抗生素均具有敏感性;对大肠杆菌、金黄色葡萄球菌和单增李斯特菌具有一定的抑制能力,抑菌圈直径均分别大于10 mm、20 mm、13 mm;其中鼠李糖乳杆菌260益生特性较优,黏附能力较强,黏附率为4.16%,DPPH自由基清除能力56.36%、羟自由基的清除能力23.09%、总抗氧化能力(T-AOC)为5.26 μmol/mL,具有潜在的应用价值。由于抗氧化活性体外化学评价方法存在一定的局限性,不能全面的体现菌株的抗氧化活性和菌株在机体内的抗氧化作用。因此,还需要进一步对乳酸菌体内抗氧化活性进行探究。
