影响不同果期米槁主要成分的根际优势微生物群落及其对土壤性质的响应
2021-12-05陈敬忠黄小龙刘济明孙庆文
陈敬忠,黄小龙,刘济明*,孙庆文
(1 贵州大学林学院, 贵州贵阳 550025;2 贵州中医药大学药学院, 贵州贵阳 550025)
米槁 (Cinnamomum migaoH.W.Li)系樟科(Lauraceae)樟属常绿高大乔木,是我国西南地区特有药用植物,仅分布在滇黔桂交界干热河谷地带。由于分布区极为狭窄,种群数量稀少,《中国生物多样性红色物种名录 · 高等植物卷》已将其列为近危物种(NT)[1–2]。米槁果实(即大果木姜子Fructus Cinnamomi)是贵州著名道地药材和十大苗药之一,在治疗胃肠道和心脑血管疾病方面疗效显著。但由于不同产地米槁果实化学成分存在较大的地理变异,导致其药材品质差异很大[3],造成了其药材质量良莠不齐。确定其果实化学成分地理变异的主导因素,有助于后期在人工栽培当中选择合适条件培育出质优效佳的药材,但前期对于米槁果实化学成分变异原因研究表明,遗传基础、气候和土壤条件均不是其化学成分地理变异的主导因素[4–5]。本研究小组发现其化学成分的形成与根际微生物之间存在密切的联系,可能是其化学成分变异的主导因素之一[6],但根际微生物多样性在米槁果实发育过程中的变化与果实成分积累的关系尚待解答。
大量研究表明,植物-微生物之间的互作反馈机制会影响植物的生理生化过程,二者相互作用深刻影响植物适应性和生产力[7-9]。如植物根际中广泛存在的Bacillus属已被证实能够促进包括大豆、小麦、玉米等作物的生长和产量的提升[10-11]。药用植物丹参(Salvia miltiorrhiza)、三七 (Panax notoginseng)、人参(Panax ginseng)品质的形成深受其根际微生物中的亚硝化细菌、固氮菌和芳香族分解菌的调控[12–13]。柑橘(Citrus reticulata)等经济果树的研究也证明了根际微生物对其品质形成的重要影响[14]。本研究小组对不同产地成熟时期根际真菌与米槁果实化学成分关系进行了初步研究,表明伞菌属(Agaricus)、镰孢菌属(Fusarium)、瓶霉属(Phialophora)对米槁果实指标成分桧烯及α-松油醇具有明显的促进作用,一定程度上佐证了根际微生物是影响米槁化学成分地理变异的重要因素[6]。
本研究以米槁发育成熟过程中3个关键时期根际土壤微生物动态变化为切入点,探讨根际微生物群落变化对米槁果实品质形成的影响,为后期米槁果实化学成分的微生物调控提供策略参考。
1 材料与方法
1.1 供试材料
选择米槁分布典型区域,即贵州省黔东南州红水河一带,在 3 个野生居群罗甸 (E 106°35′44″, N 25°17′20″)、坝碰 (E 106°3′52″, N 25°7′16″)、祥乐 (E 106°5′46″, N 25°10′32″)中随机选择 5 棵胸径 32~38 cm左右的无病害挂果米槁植株并逐一标记,分别在2019年6月(幼果期)、8月(近成熟期)、10月(成熟期) 3个果期收集每个居群标记的植株根际土壤混匀;采样时先去除林下表层腐殖质和土壤,然后沿着米槁基部使用无菌铲垂直挖取80 cm的剖面以获取健康的细根,用抖落法将附着在根系2 mm左右的土壤抖入灭菌塑料袋中,迅速置于冰盒中保存并带回实验室[15]。然后将采集的土壤样品分成两份,一份置于室温环境条件下(25℃)风干后用于化学性质的测定,一份置于–80℃超低温冰箱中保存,用于根际土壤微生物基因组提取;果实样本收集与土壤样本逐一对应,冷冻干燥后粉碎过0.25 mm筛备用。
1.2 测定方法
1.2.1 土壤养分测定 土壤养分与pH测定参照《土壤农化分析》第三版[15]进行,其中pH使用水浸提-电位法测定,碱解氮使用半微量凯氏法,有效磷使用钼锑抗比色法,速效钾使用火焰光度法,有机质使用重铬酸钾容量法测定。酸性磷酸酶、脲酶、过氧化氢酶使用试剂盒方法测定,方法与结果计算参照试剂公司方案(北京索莱宝生物科学技术有限公司)。所有样本重复测定3次。
1.2.2 根际微生物组成测定 用FastDNA®SPINKit for Soil试剂盒(美国Mpbio公司)提取真菌和细菌基因组DNA,操作步骤按照说明书进行,使用1%琼脂糖凝胶 (5 V/cm, 20 min) 电泳检测质量,用 UV-1700紫外分光光度计检测DNA浓度;真菌引物序列为:正向序列ITS1F (CTTGGTCATTTAGAGG AAGTAA),反向序列 ITS2R (GCTGCGTTCTTCAT CGATGC)。细菌引物序列为:正向序列338F(ACTCCTACGGGAGGCAGCAG),反向序列806R(GGACTACHVGGGTWTCTAAT)。PCR扩增采用TaKaRa rTaq DNA Polymerase,20 μL 反应体系:10 ×Buffer (2 μL),2.5 mmol/L dNTPs (2 μL),5 μmol/L Forward Primer (0.8 μL),5 μmol/LReverse Primer(0.8 μL),r-Taq Polymerase (0.2 μL),牛血清白蛋白BSA (0.2 μL),Template DNA (10 ng),补 ddH2O 至20 μL。PCR 扩增参数:1 × (95℃ 3 min), 5 个循环 ×(95℃ 30s; 55℃ 30s; 72℃ 45s),72℃10 min,最后10℃ 直至停止 (PCR 仪:ABI GeneAmp® 9700 型)。PCR产物由上海美吉生物医药科技有限公司代为测序 (Illumina Hiseq 平台高通量)。
1.2.3 果实成分测定 粗脂肪与糖类参照刘刚等[16]的研究方法,桧烯、α-松油醇参照课题组前期建立的方法[16]。所有样本重复测定3次。
1.3 数据处理
微生物组成分析流程:1)使用 Trimmomatic软件,对raw data低质量序列首先采用滑动窗口法扫描,当质量低于20时,切掉碱基质量平均值低于阈值的滑窗,并去除长度小于50 bp的序列;2)使用Flash软件,将上一步合格的双端raw data拼接,序列拼接时最大overlap为200 bp,得到完整paired end序列;3)使用QIIME中的split_librarie去除paired end序列中含有N碱基的序列,去除单碱基重复大于8的序列,去除长度小于200 bp的序列,得到clean tags 序列;4)使用UCHIME软件去除clean tags中的嵌合体,最终得到用于后面OTU划分(≥97%划为同一个OTU)的valid tags。最后利用I-Sanger生物信息分析云(http://www.i-sanger.com/)进行数据处理和生物多样性分析;土壤与果实数据用WPS表格整理,IBM SPSS 22软件进行单因素方差分析(one-way ANOVA),多均值比较采用Turkey,P< 0.05 时为差异显著。
2 结果与分析
2.1 米槁根际土壤化学特征与果实化学成分变化
表1表明,在米槁幼果期、近成熟期、成熟期所采集3个区域的根际土壤样品,其化学性质变化如下:pH在坝碰和罗甸幼果期最低、成熟期最高,在祥乐则是以近成熟期最高。碱解氮含量在坝碰和罗甸幼果期显著高于近成熟期、成熟期,在祥乐则表现为幼果期高于近成熟期、成熟期。速效钾含量坝碰和罗甸在幼果期显著高于近成熟期、成熟期,祥乐则是近成熟期最高。有效磷含量在3个区域均呈现幼果期<近成熟期<成熟期,且同一区域不同果期均存在显著差异。有机质在坝碰和罗甸均以幼果期时含量最高而近成熟期时含量最低,祥乐则是近成熟期含量最高,但同一区域不同果期间均无显著差异;脲酶(S-UE)活性在坝碰呈现出幼果期>成熟期>近成熟期,罗甸表现为近成熟期>成熟期>幼果期,祥乐表现为成熟期>近成熟期>幼果期,但坝碰和祥乐不同果期不存在显著差异,罗甸幼果期显著低于近成熟期和成熟期。酸性磷酸酶(S-ACP)在3个区域均表现为幼果期>成熟期>近成熟期,并且幼果期显著高于近成熟期、成熟期。过氧化氢酶(S-CAT)在坝碰呈现出幼果期>成熟期>近成熟期,罗甸呈现出成熟期>幼果期>近成熟期,祥乐表现为成熟期>近成熟期>幼果期,坝碰和罗甸不同果期存在显著差异,祥乐则是成熟期显著高于近成熟期、幼果期。

表1 根际土壤化学特征Table 1 The chemical characteristics of rhizosphere soil
表2显示,α-松油醇在坝碰以近成熟期含量最高,成熟期次之,幼果期最低,并且不同果期间均存在显著差异。而罗甸和祥乐均随着果实发育成熟含量逐步降低;桧烯在坝碰以幼果期含量最高,成熟期次之。而罗甸和祥乐则是随着米槁果实发育成熟含量逐步上升,并且成熟期显著高于幼果期;在糖类成分中总糖在3个区域均以近成熟期含量最高,并且均显著高于幼果期。还原糖在坝碰和罗甸同样以近成熟期含量最高,祥乐则以成熟期含量最高。可溶性多糖含量在3个区域均以成熟期含量最高,幼果期次之。粗多糖在坝碰和罗甸则以成熟期含量最高、幼果期次之,而祥乐则以幼果期含量最高、成熟期次之。粗脂肪在3区域均随着米槁果实发育成熟不断积累升高,呈现出幼果期<近成熟期<成熟期,并且同一区域不同果期间均存在显著差异。
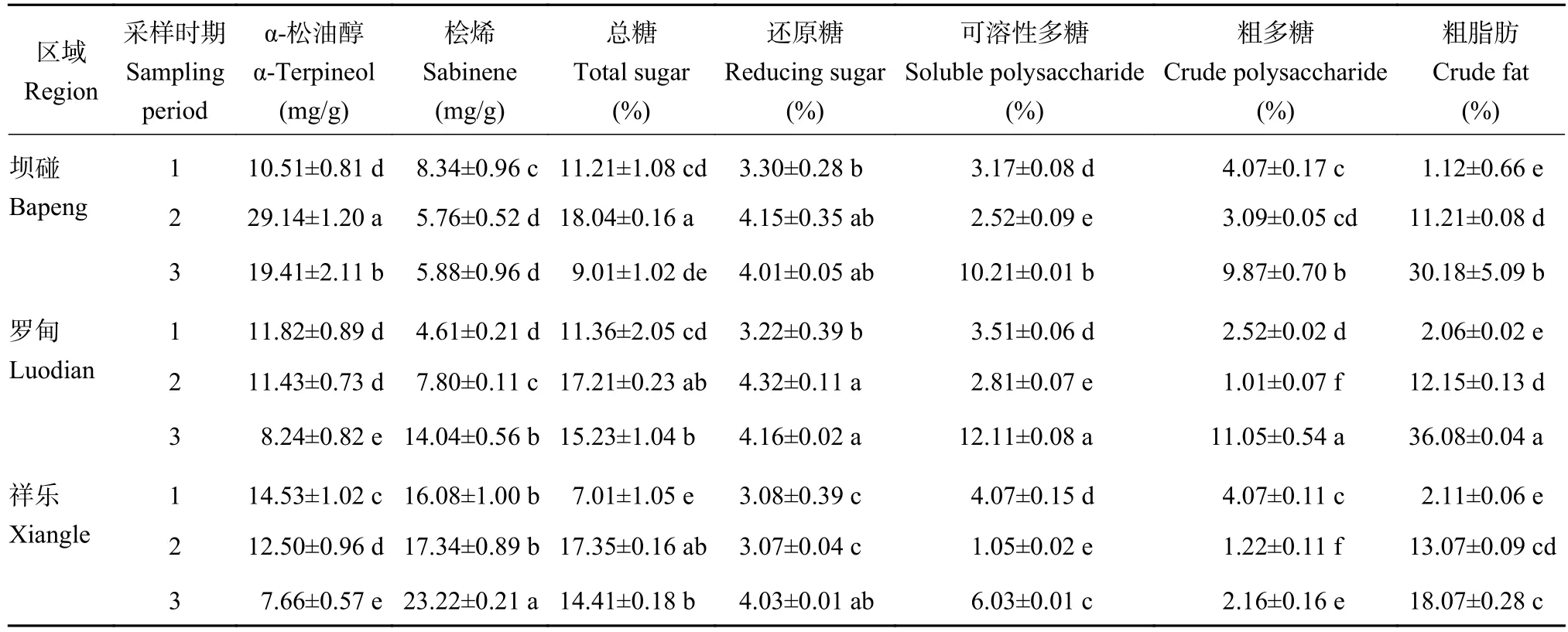
表2 米槁果实化学成分的动态变化Table 2 Chemical component content of C. migao fruit at different fruit stages
2.2 样品测序结果及测序深度
利用高通量测序对3个产地不同果期的9个样本rDNA ITS和 16S rDNA区全长进行测序,获得真菌原始序列1740016条,有效优质序列870008条,按照相似性≥97%分类标准将其分为3026个OTU。获得细菌原始序列1137478条,有效优质序列568739条,按照相似性≥97%分类标准将其分为4971个OTU(表3)。3个产地的9个样本按照6月(幼果期)、8月(近成熟期)、10月(成熟期)进行次序分析;真菌样本中:坝碰3个时期样本OTU介于340~374,罗甸3个时期样本OTU介于592~797,祥乐3个时期样本OTU介于495~790。9个真菌样本的稀释曲线随着抽提数据量的增多(图1A),逐步趋于平稳状态,表明数据较为合理,且各样本覆盖度均达0.98以上,说明测序结果已包含大部分真菌物种能够进行后续分析;细菌样本中:坝碰3个时期样本OTU介于1623~2436,罗甸3个时期样本OTU介于1734~2356,祥乐3个时期样本的OTU介于1528~2388。同样9个细菌样本的稀释曲线随着抽提数据量的增多逐步趋于平稳状态(图1B),表明数据较为合理,且各样本覆盖度均达0.98以上,说明细菌测序结果也包含大部分细菌物种能够进行后续分析。

表3 根际土壤样本序列统计数据Table 3 Sequencing data statistics of 9 samples

图1 米槁根际土壤OTU(≥97%)稀释曲线(A、B)与韦恩图(C、D、E、F)Fig. 1 OTU rarefaction curves (A, B) and Venn diagram (C, D, E, F) from rhizosphere soil of C. migao
3个居群中9个真菌样本测序所得3815 OTU中,在3个居群(图1C)中均存在的OTU数为178个,超过72.6 %的OTU (2197)仅在单个居群中有发现,其中LD居群OTU最为丰富;以不同果期作为观测组来看 (图1D),在 3个时期中均存在的OTU数有437个,超过59.2% OTU (1700)仅在单个时期有分布;3个居群中9个细菌样本测序所得9897 OTU中,仅有23.47 %在单个居群中有发现(图1E),3个居群中共有的OTU数仅1618个;以不同果期作为观测组来看(图1F),在3个时期中均存在的OTU为2454个,达49.3 %,而仅有1007个OTU在单个时期分布。
2.3 微生物 Alpha 多样性
真菌多样性中香农多样性指数在坝碰表现为先降后升的趋势,且在10月中旬最高,罗甸则表现表为逐步上升趋势,在10月成熟期达到最高,祥乐则表现为先升后降的趋势,在8月近成熟期达到最高。辛普森指数在坝碰表现为先升后降的趋势,在罗甸则表现为逐步降低,在祥乐则表现为先降后升且在10月成熟期达到最高;细菌中香农指数在坝碰表现为先降后升的趋势,且在10月成熟期最高,在罗甸则表现为逐步上升趋势,在10月成熟期达到最高,在祥乐则表现为逐步降低的趋势。辛普森指数在坝碰表现为逐步降低的趋势,在罗甸以及祥乐则表现为先升后降趋势且在8月近成熟期最高(表3)。
2.4 根际微生物组成及分布特征
所有真菌样本(图2A)的3026个OTU隶属于14门,42纲,105目,250科,485属,从属水平上来看3个产地真菌群落组成(除去未鉴定和相对丰度小于0.01类群),在坝碰、罗甸以子囊菌门(Ascomycota)一未鉴定属丰度最高;其次为被孢霉属(Mortierella),祥乐以双歧杆菌科(Didymellaceae)一未鉴定属丰度最高;其次为Saitozyma属(图2A)。以不同时期为观测角度来看,3个果期采样在属水平真菌组成情况如下:根际真菌中幼果期Saitozyma被孢霉属(Mortierella)较高,近成熟期以灵芝属(Ganoderma)、小杯伞属(Clitolybula)较高,成熟期以被孢霉属(Mortierella)、Saitozyma较高(图2B)。9个细菌样本的4971个OTU隶属于32门,91纲,244目,399科,711属,从属水平上来看(图2C)3个产地细菌群落组成(除去未鉴定和相对丰度小于0.01类群),坝碰以芽单胞菌科(Gemmatimonadaceae)一未鉴定属最为丰富,其次为芽孢杆菌属(Bacillus)。罗甸以节杆菌属(Arthrobacter)丰度最高,其次为鞘脂单胞菌属(Sphingomonas)。祥乐以芽孢杆菌属(Bacillus)最为丰富,其次为嗜酸栖热菌属(Acidothermus)。不同时期观测角度来看3个果期采样在属水平细菌组成情况如下:根际细菌中幼果期以鞘脂单胞菌属(Sphingomonas)、节杆菌属(Arthrobacter)较高,近成熟期以节杆菌属(Arthrobacter)、芽孢杆菌属(Bacillus)较高,成熟期以节杆菌属(Arthrobacter)、不动杆菌属 (Acidibacter)较高 (图2D)。
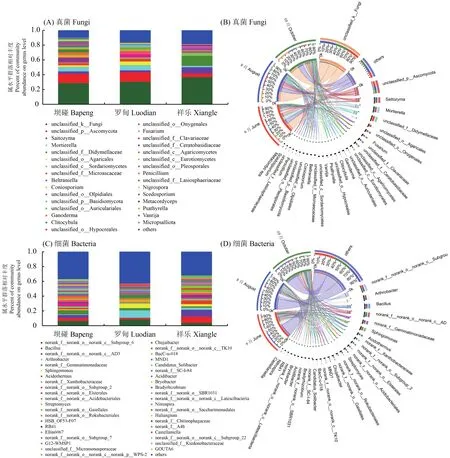
图2 米槁根际微生物分布Fig. 2 Distribution of rhizosphere microbe of C. migao
为了更好地反映不同果期样本间的区别与联系,对样本进行了主坐标分析(PcoA)和非度量多维尺度分析(NMDS),结果如图3所示。PcoA分析显示,真菌无论是以不同果期还是以居群为观测组其相似性均较差,没有表现出明显样本内相似性。细菌则在居群水平上具有较好相似性,可以看到坝碰(BP-2、BP-3)、祥乐 (XL-2、XL-3)、罗甸 (LD-2、LD-3)的其中两个样本均较为相近。NMDS分析显示,大多数样本中真菌和细菌在不同果期和居群水平均未展示出较近的距离(仅细菌中罗甸的两个样本LD-1、LD-3距离较近),说明在NMDS分析中样本间的相似性较差。

图3 样本PCA (A、B)与NMDS (C、D)分析Fig. 3 PCA (A, B) and NMDS (C, D) analysis of samples
基于系统发育层次聚类分析法对9个样品根际微生物相似性进行聚类分析,构建根际真菌和细菌的聚类热图。根际土壤真菌属水平的聚类热图中(图4A),红黄蓝色代表菌群的相对丰度,颜色越红则代表其相对丰度越高。从样本的聚类结果来看,BP-1、LD-2先聚为一支,然后再与LD-3聚为一支。LD-1、XL-3先聚为一支,最后再与BP-2、XL-2聚为一支。BP-3、XL-1则单独聚为一支。根际土壤细菌属水平的聚类热图中(图4B),红黄蓝色代表菌群的相对丰度,颜色越红则代表其相对丰度越高。从样本的聚类结果来看,根际细菌明显聚为两大类,其中BP-2、BP-3先聚为一支,再与XL-2、XL-3聚为一支。另一支则是LD-3、XL-1先聚为一支,再与LD-2聚为一支,最后再与BP-1、LD-1聚为一支。从不同居群和不同果期角度观察聚类结果,虽然细菌样本聚类结果较真菌聚类结果规律性好,但实际无论在同一居群还是同一时期样本均没有表现出聚类上的明显靠近,说明在不同居群、不同时期样本均具有明显差异性。对于上述现象产生的原因,应当结合根际微环境化学性质进一步分析,而上述微生物组成的差异性在药材品质形成过程中扮演何种角色更是值得进一步研究。
图4 聚类热图Fig. 4 Microbe from rhizosphere soil of C. migao heat map clustering
2.5 微生物与土壤、果实化学成分的关系
微生物与土壤化学性质的RAD分析结果表明:脲酶(S-UE)对真菌组成影响最大,与Saitozyma属、子囊菌门(Ascomycota)一未鉴定属、真菌界一未鉴定属呈正相关,与孢霉属(Mortierella)负相关。其次为过氧化氢酶(S-CAT),与真菌界(未鉴定属)、蕉孢壳科(Diatrypaceae,未鉴定属)、Saitozyma属、子囊菌门(Ascomycota, 未鉴定属)呈负相关(图5A)土壤化学性质与丰度前5的细菌相关性排序中(图5B):同样受脲酶(S-UE)影响最大,与Athrobacter属呈负相关,与Gommatimonadaceae科(未鉴定属)、杆菌属(Bacillus)呈正相关。其次为速效磷(AP),与Gommatimonadaceae科(未鉴定属)呈正相关,与杆菌属(Bacillus)、Athrobacter属呈负相关。

图5 米槁根际土壤微生物群落与土壤化学性质(A、B)和果实化学成分(C、D)的RDA关系Fig. 5 Redundancy (RDA) for microorganism community diversity and physicochemical properties of rhizosphere soil samples and fruit components of C. migao
微生物与米槁果实成分的RAD分析结果表明:真菌中(图5C)一未鉴定物种对米槁果实成分积累影响最大,对桧烯、总糖积累有促进作用,但对α-松油醇、粗脂肪、还原糖积累可能起抑制作用。其次为Didymellaceae科一未鉴定属,能促进α-松油醇、桧烯、可溶性多糖、粗多糖积累,但对粗脂肪、还原糖、总糖积累可能存在抑制作用。细菌中(图5D)杆菌属(Bacillus)对米槁果实成分积累影响最大,但可能对粗脂肪、总糖、α-松油醇、粗多糖、可溶性多糖、还原糖积累有抑制作用。其次为芽单胞菌科(Gemmatimonadaceae)一未鉴定属,对粗脂肪、粗多糖、可溶性多糖、还原糖、桧烯有促进作用,但对α-松油醇和总糖积累可能存在抑制作用。
3 讨论
3.1 不同果期米槁果实化学成分积累特征
糖类、粗脂肪及挥发油是米槁果实中主要的化学组分,在米槁果实发育和药材品质形成过程中十分重要,其中糖类和粗脂肪含量是大多数果实中重要营养和能量储存物质。米槁果实中糖类在成熟时期除总糖含量低于近成熟期外,还原糖、可溶性多糖、粗多糖都在成熟时期含量最高,这与猕猴桃(Actinidia chinensis)、越橘 (Vaccinium vitis-idaea)糖类含量的变化趋势相似[17–18];粗脂肪含量随着果实成熟逐步升高,这与油茶(Camellia oleifera)、平欧杂种榛 (Corylus heterophylla×Corylus.avellana)等大多数油料植物果实中粗脂肪积累过程相似[19–20]。糖类和粗脂肪含量的变化说明在米槁果实发育成熟的过程中发生物质储存形式的转换,在米槁果实成熟时以粗脂肪为其主要储能物质。而米槁果实挥发油中的主要成分α-松油醇随着果实生长到成熟阶段总体含量呈现出先升后降的趋势,这与果实类中药枳实中α-松油醇的积累过程[21]一致;而桧烯呈现出逐步上升的趋势,与米槁同科植物山苍子(Litsea cubeba)果实中月桂烯积累过程[22]相似。可见挥发油中相关成分积累在芳香植物中具有相似的趋势,作为米槁果实中的重要活性组分,米槁果实发育过程中挥发油的含量变化值得进一步研究。
3.2 不同果期米槁根际微生物群落变化的影响因素
米槁3个居群不同果实发育阶段根际微生物OTU总数和优势菌属具有较大的差异,在黄芪(Astragalus membranaceusvar.mongholicus)、地黄(Rehmannia glutinosa)不同物候阶段的根际微生物变化中也观察到类似的变化,这一现象产生的原因可能在于植物活动过程中产生根系分泌物导致土壤理化环境变化,而RDA分析结果也证实了土壤酶活性和氮、磷、钾等养分含量影响了米槁根际微生物的组成[23–24]。此外,有些微生物类群在不同季节其丰度会存在稳定的动态变化,其背后影响因素除了物种本身的生活史特性和土壤理化性质外,最大驱动力便是季节变化导致土壤温度和湿度的变化[25]。虽然不同果期(季节)米槁根际微生物群落组成变化较大,但丰度较高的Mortierella、Saitozyma、Fusarium并未呈现出明显变化规律,反而与S-UE、有效磷之间关系密切。有研究指出是因为土壤病原菌与宿主之间的负反馈调节不受非生物环境条件(温度和土壤湿度)的影响[26],而不同果期米槁根际土壤病原菌类群中Mortierella、Saitozyma、Fusarium均具有植物致病特点[27–28],一定程度上解释了不同果期根际微生物的季节动态变化不规律的原因。
3.3 根际微生物对米槁果实化学成分积累的影响
在植物生长发育过程中根际微生物的重要性已在大量生产实践中被证实[29],例如根际中厚壁菌等类群在蒙古黄芪 (Astragalus membranaceusvar.mongholicus)生长发育过程中显著影响其有效成分毛蕊异黄酮的积累,同样在玉米(Zea mays)生长成熟过程中杆菌属(Bacillus)能够有效促进其植株生长[30–31]。本研究结果表明,在不同果期米槁根际微生物中Saitozyma、被孢霉属(Mortierella)、节杆菌属(Arthrobacter)、杆菌属(Bacillus)等类群与果实化学成分积累有着密切联系。然而不同产地米槁果实成熟时期则是伞菌属(Agaricus)、镰孢菌属(Fusarium)与米槁果实化学成分积累呈显著相关,说明在米槁果实发育过程中化学成分积累和不同产地果实化学成分差异是由不同微生物主导所致[32]。与米槁果实成分积累关系密切的类群中,Saitozyma属于酵母菌,虽然在土壤中广泛存在,但目前关于其对植物生长的影响的认识仍十分缺乏[33]。被孢霉属(Mortierella)已被证实对植物脂肪酸类和挥发油的积累具有明显促进效应,而米槁果实中挥发油和脂肪便是其化学成分的重要组成部分(α-松油醇、桧烯、粗脂肪),被孢霉属(Mortierella)与米槁果实中α-松油醇、桧烯、粗脂肪的关系[34]也验证了这一点。节杆菌属(Arthrobacter)已被认知是植物生长促进根际菌,能够促进植物体内糖类的积累,RDA分析也证实了其对米槁果实中糖类具有明显促进作用[32]。而杆菌属(Bacillus)具有较强的解磷、解钾能力,并且是重要的生防菌,可产生抗菌化合物,这对于米槁这种大乔木在生活过程中维持个体健康和生产力及果实发育成熟过程营养供给十分重要[35]。另外RDA分析也表明,碱解氮、酸性磷酸酶、速效磷对米槁果实糖类与粗脂肪积累同样有着不可忽视的影响,目前在某些经济作物大田试验[36]中已观察到这种现象。试验结果充分说明,米槁果实发育过程中营养成分积累与部分根际微生物类群和土壤化学性质密切相关,但其具体机理尚需进一步通过田间试验验证。
4 结论
米槁根际微生物群落在幼果期、近成熟期和成熟期多样性有明显差异,不同果期米槁根际微生物均以子囊菌门(Ascomycota,未鉴定属),Saitozyma、被孢霉属(Mortierella)、节杆菌属(Arthrobacter)等类群对果实化学成分积累具有明显促进作用。其中品质最佳的罗甸居群受子囊菌门(Ascomycota,未鉴定属)影响最大,坝碰、祥乐居群则受被孢霉属(Mortierella)影响最大,这有别于不同产地根际真菌中伞菌属(Agaricus)、镰孢菌属(Fusarium)、瓶霉属(Phialophora)对米槁果实松油醇、桧烯积累影响最大的结论。说明在米槁果实发育成熟过程中不同产地土壤微生物对米槁果实品质影响的主导类群不一致,而在不同果期微生物群落结构变化又主要受到土壤脲酶(SUE)活性的影响。
