苹果园生草对土壤微生物多样性、酶活性及碳组分的影响
2021-12-05刘业萍毛云飞胡艳丽张璐璐尹伊君庞会灵宿夏菲
刘业萍,毛云飞,胡艳丽,张璐璐,尹伊君,庞会灵,宿夏菲,杨 露,沈 向
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/山东果蔬优质高效生产协同创新中心, 山东泰安 271018)
研究和实践证明,果园种植生草可以有效地提高土壤肥力和土壤质量,并减少土壤养分流失,从而改善生态环境[1–3]。如山核桃林种植白三叶、紫云英和油菜后,石灰性土壤的微生物特性显著提高[4]。长期种植黑麦草果园土壤中的有机碳含量显著提高[5]。焦润安等[6]、张林森等[7]的试验研究也表明长期间作黑麦草能够有效提高土壤有机碳储量,间作白三叶可明显提高表层土壤总有机碳(TOC)、可溶性有机碳(DOC)、微生物生物量碳(MBC)等含量,而且间作后大量草根死亡还能在土壤中留下许多空隙,增加土壤通透性,提高土壤微生物活性。潘介春等[8]研究发现龙眼果园生草能增加土壤中微生物数量,提高碳、氮含量和磷循环相关酶活性,改良土壤环境。研究还发现,在酿酒葡萄园行间生草可提高土壤有机质、碱解氮、全氮、全钾含量,有效提高土壤中微生物数量及脲酶、蔗糖酶、磷酸酶等活性,促进碳氮循环和转化,提高土壤肥力,改善果实品质等[9]。
研究从美国引进的几种果园生草对土壤生物和微生物学性状的影响,为推动我国果园绿色管理技术的发展提供理论依据。
1 材料与方法
1.1 试验地概况
试验在山东省泰安市马庄镇李家大坡村试验基地进行。该区域属温带大陆性季风气候,年降水量687.7 mm,年均温 12.9℃,极端最低气温 –27.5℃,极端最高气温41℃,全年无霜期近200天。
1.2 试验设计
供试5个果园专用生草的草种均从美国引进,包括白三叶草(Trifolium pratense)、垂穗草(Boutelouagracilis)、沙画眉草(Eragrostis trichodes)、弯叶画眉草(Eragrostis curvula)和加拿大披碱草(Elymus canadensis),依次表示为 BT1、CT2、DT3、ET4、FT5,以清耕自然生草为对照,表示为Ack。2017年3月分别称取5个草种各500 g,清水浸种24 h 后分别以条播的方式播种于行距为3 m的一年生苹果幼树行间,每行树的两边1 m处播一个草种,每个生草试验小区长100 m、宽1 m。草种发芽后要及时去除杂草,每个草种设置3个生物学重复,随机区组设计,生草3年。清耕区进行人工除草,其他管理条件相同。
1.3 样品采集
2018、2019和2020年的7—9月中旬进行样品的采集。土壤样品的采集采用“S”形取样法:分别在种植不同草种的每个小区按照“S”形取10个点0—30 cm 土层土壤 1000 g,及时去除土壤中的杂质,同一个生草的小区土壤混合以后作为一个样本。将采集的土壤分成3份,装于自封袋中然后放置于冰盒里,及时带回实验室,一份于4℃冰箱中用于测定土壤中的微生物数量,一份于–80℃冰箱中用于分析土壤中的微生物种类,一份土样风干后过0.15 mm筛进行土壤的理化指标测定。。
1.4 试验方法
1.4.1 不同草种的生物学指标测定 于7月中旬在草生长旺期,每种草选取20株生长健壮、长势一致、各方面良好的草置于冰盒中,带回实验室进行测定。将植株平展伸直,用钢卷尺测定植株的高度和根长,求其平均株高和平均根长。植株地上和地下部重于105℃烘箱烘干至恒重,测干物重。
1.4.2 土壤理化指标测定 用凯氏定氮法测土壤全氮;碳酸氢钠—钼蓝比色法测定土壤有效磷含量;醋酸铵浸提—火焰光度法测定土壤有效钾含量;原子吸收分光光度计测定土壤中的铜、锌、铁、镁、钙含量[10]。
土壤总有机碳(TOC)测定:称取过2 mm筛的风干土样 (0.15±0.03)~(0.20±0.05) g,置于 50 mL三角瓶中,加水润湿,加3 mL浓硫酸,数滴双氧水,电炉加热至340℃,消煮20 min至土样变白,冷却,过滤,滤液移入50 mL容量瓶中,加水定容,用multi T/N分析仪测定。土壤可溶性有机碳(DOC)的测定:称取10 g 新鲜土样,按照土∶水为1∶5的比例混匀,在25℃条件下,以250 r/min 的速度振荡 1 h,接着在转速为 15000 r/min 离心 10 min,上部悬浮液过 0. 45 μm 薄滤膜,用 multi T/N 分析仪测定[11]。土壤有机碳(SOC)的测定:采用重铬酸钾容量法—外加热法[10]测定。蔗糖酶的活性采用3,5-二硝基水杨酸比色法测定,以24 h 后1 g土壤中所含葡萄糖的mg数表示;用磷酸苯二钠法测定碱性磷酸酶的活性,以24 h 后1 g土壤中释放出酚的mg数表示;土壤中过氧化氢酶采用高锰酸钾滴定法测定;土壤脲酶采用苯酚钠-次氯酸钠比色法测定,以24 h后1 g土壤中NH3-N的质量(mg)表示土壤脲酶活性[12]。1.4.3 土壤微生物的测定 土壤微生物测定分两部分进行,一是在7、8、9月取3个年份生草处理后的土壤对细菌、真菌和放线菌数量进行测定。用牛肉膏蛋白胨琼脂培养基、马铃薯葡萄糖琼脂培养基培养细菌和真菌[13],用高氏1号培养基培养放线菌[14],采用平板梯度稀释培养法计数测定3种微生物[15]。二是在7月中旬取3年生草处理后的土壤用高通量测序技术对细菌和真菌进行鉴定分析,进一步分析土壤中微生物群落多样性和丰富度。
1.5 数据处理
采用 Microsoft Excel 2010 处理数据,用 SPSS 18.0统计软件进行数据分析。样品在Illumina NovaSeq平台上按照制造商的建议进行测序,由LC-Bio提供。根据样品独特的条形码,将配对端序列分配给样品,去除建库引入的barcode和引物序列。使用FLASH合并匹配端读取[16]。根据fqtrim (v0.94),在特定条件下对原始读取数据进行质量过滤[17],以获得高质量的Clean Tags标签。使用Vsearch软件对嵌合序列进行过滤(V2.3.4)。用DADA2进行解调得到特征序列和特征表。多样性通过归一化得到相同的随机序列来计算。然后根据SILVA (release 132)分类器,利用每个样本的相对丰度对特征丰度进行归一化。Alpha多样性用于分析样本物种多样性的复杂性,用 QIIME2 计算 Chao1、Observed species、Goods coverage、Shannon、Simpson,标准曲线的绘制用R软件(Version 2.15.3)。Beta多样性由QIIME2计算,R包绘制。采用Blast进行序列比对,每个代表性序列用SILVA数据库对特征序列进行注释。其他的图是使用R包实现的(v3.5.2)。
2 结果与分析
2.1 供试草种生物量比较
试验中供试的草种植株地上和地下生物量见表1。5个草类的地上和地下生物量差异显著。ET4处理草株高显著高于其余处理,FT5处理地上部鲜重、地上部干重显著优于其余草种,CT2处理根干重显著高于其余草类。
2.2 不同草种根际土壤微生物多样性OTU相关性分析
不同草种土壤环境不同,微生物之间的群落结构存在较大的差异,以97%核酸相似度水平,得到细菌和真菌的操作分类单元(OTU)。图1所示细菌和真菌的不同组间各自持有的OTU个数,结合OTU代表的物种,可得到细菌和真菌在不同生草土壤环境中的核心微生物。6组土壤样品共得到31459个细菌操作分类单元(OTUs),共有的OTU个数为1019个。其中生草处理的土壤细菌OTU个数明显高于清耕处理(Ack),以生草ET4处理效果最好,为5688个OTU,比清耕提高了22.22% (图1);6组土壤样品共得到5021个真菌操作分类单元(OTUs),共有的OTU个数为108个,除CT2、DT3处理外,经生草处理的土壤真菌操作分类单元OTU均高于Ack处理,BT1、ET4、FT5处理分别增加了1.07%、1.19%和4.28%,其中以生草FT5处理真菌OTU个数最多(图1)。
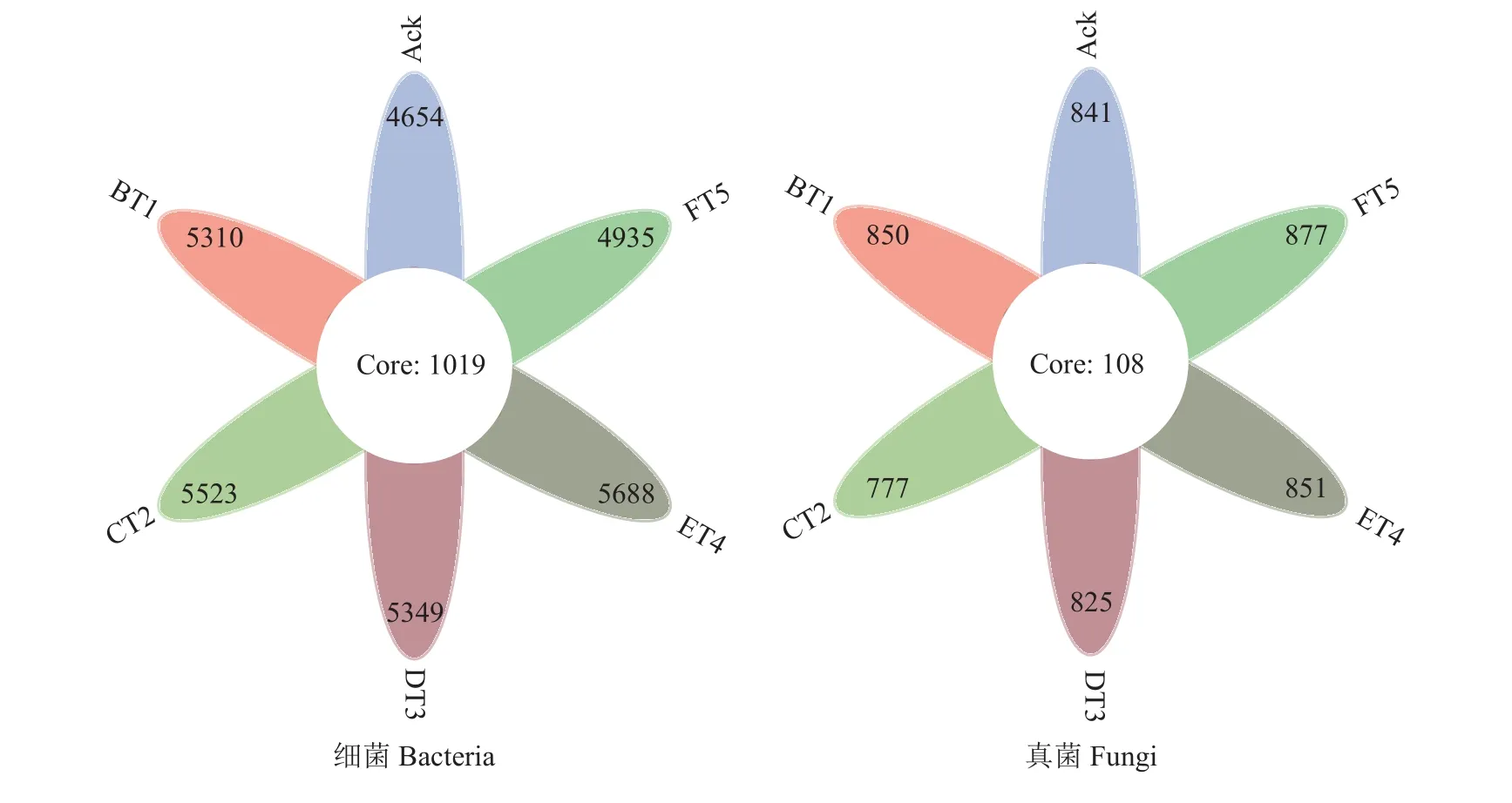
图1 土壤细菌、真菌多样性的相关性分析Fig. 1 Correlation analysis of bacteria and fungi diversity among soil samples
2.3 不同草种根际土壤微生物Alpha 多样性分析
Shannon和Simpson指数反映微生物多样性[18–19],主要反映物种的均匀度和丰富度。由表2可知,生草处理后的土壤细菌Shannon、Simpson和Chao1指数均高于清耕处理(Ack),弯叶画眉草效果较好,Shannon、Simpson、Chao指数与Ack相比分别增加了4.61%、7.01%和27.44%。生草加拿大披碱草土壤真菌Shannon、Simpson、Chao1指数均高于对照处理,Shannon、Chao1指数显著高于对照,Chao1是对照的1.31倍。
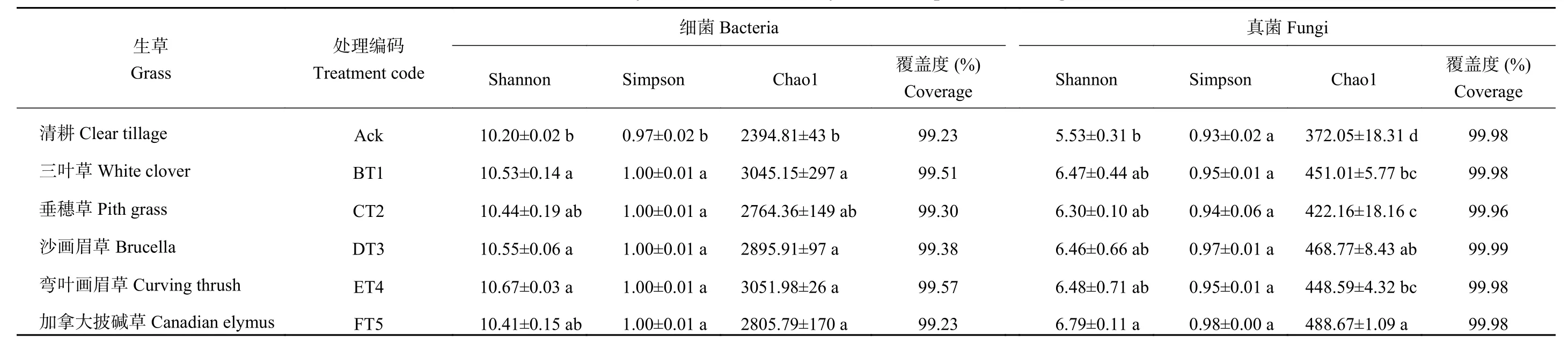
表2 生草处理后土壤样本群落丰富度和多样性指数Table 2 Indices of communityrichness anddiversity of soil samples after rawgrass treatment
2.4 不同草种根际微生物群落的Beta多样性
Heatmap 是基于距离算法 (binary、bray、weighted、unweighted)得到样品间的距离矩阵,颜色梯度由蓝色到红色表示样品间距离由近到远,可根据颜色梯度的变化直观看出两两样品间的差异性[20]。由图2可知,将各分类水平相对丰度最高30个的群落组成数据,再根据分类单元的丰度分布加以聚类,此热图经过Z值转化后将同一个菌的表达丰度进行归一化,因此该热图仅能进行横向比较[21]。图2 (左),选取在细菌门水平下分类(单元>10),如细菌变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)和芽孢杆菌门(Gemmatimonadetes)。生草处理土壤样品中细菌经过横向聚类后,样品从Ack处理组到生草土壤处理组颜色差异显著。以ET4处理的Proteobacteria和FT5处理的Acidobacteria相对丰度高于Ack处理,Ack中细菌Actinobacteria和细菌Gemmatimonadetes相对丰度高于其余生草处理土壤。图2 (右),选取在真菌门水平下分类(单元>10),如子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)。生草处理土壤样品中真菌经过横向聚类后,样品从Ack处理组到生草土壤处理组颜色差异显著。FT5处理中的Glomeromycota和CT2处理中的Basidiomycota群落丰度高于其他生草处理,分别比对照提高了1.08、2.16倍。Ack处理中的Ascomycota高于其余生草处理,表明生草处理可使土壤中的微生物群落发生显著变化。
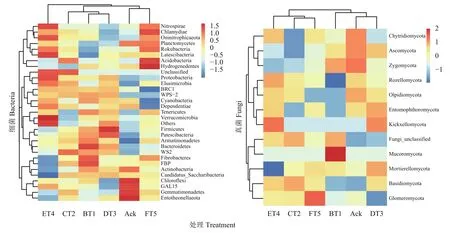
图2 土壤样品细菌、真菌热图分析Fig. 2 Heatmap analysis of soil sample bacteria and fungi
2.5 不同草种根际土壤中菌群相对丰度组成分析
根据测序结果对物种进行注释,默认选择每个样品或者分组在各类水平(Phylum、Class、Order、Family、Genus)上丰度靠前30的优势物种,将剩余的物种归为一类,生成物种相对丰度柱状堆叠图,便于直观查看各样品在不同分类水平上相对丰度较高的物种及其比例,选取门分类单元结果进行统计分析 (图3)。
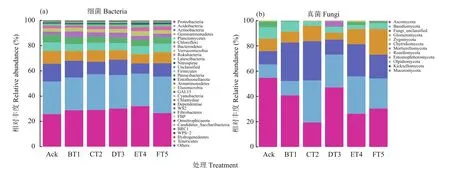
图3 土壤样品中细菌 (a)、真菌 (b) 门分类水平上相对丰度变化Fig. 3 Changes in relative abundance of soil bacteria (a) and fungi (b) in soil samples at phylum level
关于细菌,如图3 (a)所示,丰富度较高的前8个门分别为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、疵微菌门(Verrucomicrobia)。此8个细菌门在各自处理中占比超过95%。6个试验处理的土壤中,优势菌群为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi),这6种优势类群在各自处理中所占比例为80%。5个生草处理的土壤细菌丰富度与清耕土壤Ack相比,土壤中变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)丰度增加较多,ET4处理变形菌门增加最多,比对照提高了0.24倍。有些菌门丰度降低,如芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi),其在DT3生草处理土壤中明显降低,分别比清耕对照降低了0.35、0.20和0.41倍。
如图3 (b)所示,真菌丰度较高的前5个门为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)。
如图3所示,6组处理中,优势菌群为子囊菌门、担子菌门、球囊菌门和接合菌门,此4个优势真菌门在各自处理中占比超过80%,与清耕对照比较,BT1、CT2、DT3、ET4、FT5生草处理将土壤中的担子菌门相对丰度分别提高了0.07、2.16、1.46、1.81和1.27倍,而子囊菌门相对丰度呈降低趋势,CT2生草处理土壤降低明显,降低了1.83倍;CT2、ET4和FT5处理土壤中的球囊菌门相对丰度分别提高了0.24、0.23、1.08倍,而BT1和DT3处理土壤中的球囊菌门相对丰度小。
2.6 不同生草处理对果园土壤中微生物数量的影响
由图4可知,不同生草处理后的土壤细菌、真菌、放线菌的数量显著高于清耕处理。且随着生草生长时间的延长,各生草处理土壤中的细菌、真菌、放线菌的数量呈上升趋势。9月份生草处理土壤中ET4处理放线菌数量最多,比清耕提高了45.83%,FT5处理中的真菌和细菌数量显著优多于清耕处理,真菌和细菌数量分别比清耕提高了0.98和0.77倍。

图4 不同生草果园土壤微生物数量Fig. 4 Microbial population of orchard soils planted with different grass species
2.7 不同生草处理对果园土壤养分含量的影响
由表3可知,2018年5个生草处理的土壤全氮含量均低于清耕处理,分别比清耕处理降低了10.69%、8.80%、5.90%、3.89%、3.30%,2019和2020年5个生草处理中弯叶画眉草处理全氮含量显著高于其余处理,分别比清耕对照增加了33.13%、52.60%,2020年生草处理的土壤全氮含量比2019年生草处理的土壤全氮含量有不同幅度增加。2018年5个生草处理的土壤有效磷存在显著性差异,2018年生草处理中三叶草、垂穗草、弯叶画眉草、加拿大披碱草处理显著优于对照处理,2019年生草处理中以弯叶画眉草处理最好,其土壤有效磷含量比清耕对照提高了36.88%。2020年5个生草处理的土壤有效磷含量均显著高于清耕对照。3个年份中5个生草处理的土壤有效钾含量显著优于清耕对照。以弯叶画眉草处理最佳,其土壤有效钾含量2018、2019、2020年分别比清耕对照提高了34.26%、36.56%、36.21%。且随着生草年限的增加,土壤中的有效钾含量呈上升趋势。
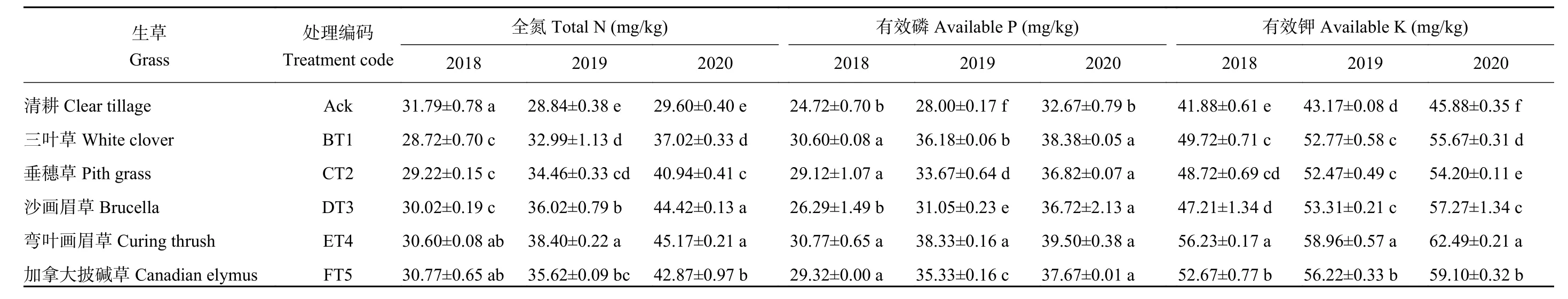
表3 2018—2020年不同生草处理的土壤大量元素含量Table 3Macro element contents in soils under five grasses treatments from 2018 to 2020
由表4可知,5个生草处理的土壤有效镁、有效铜、有效锌的含量均显著高于清耕对照处理。3个年份生草处理中,以加拿大披碱草处理土壤有效镁含量显著高于清耕对照,2018、2019、2020年分别比清耕对照提高了10.20%、10.42%、10.51%。3个年份生草处理均以弯叶画眉草处理有效铜含量最高,显著高于清耕对照处理,2018、2019、2020年分别是清耕对照的1.95、1.95、2.10倍。沙画眉草、弯叶画眉草、加拿大披碱草处理土壤有效锌含量显著高于其余处理,2020年生草处理中土壤有效锌含量以加拿大披碱草处理显著高于其余生草处理。
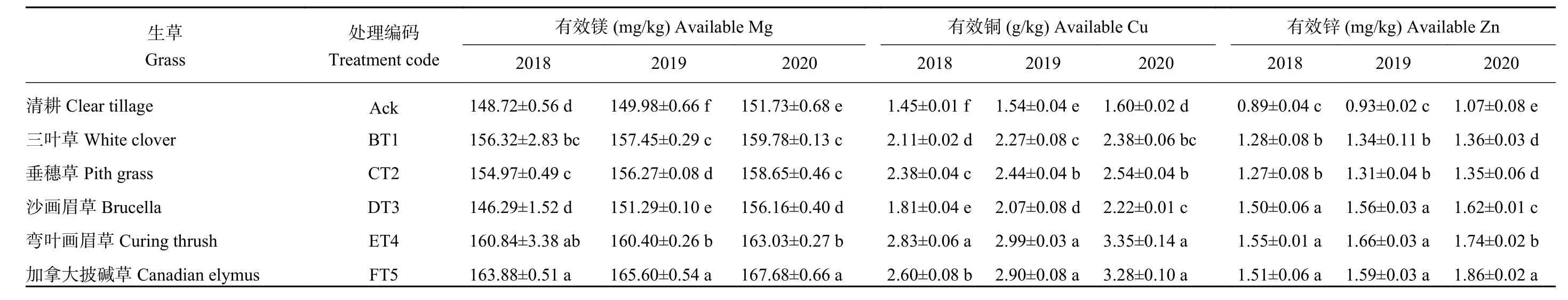
表4 2018—2020年不同生草处理的土壤微量元素含量Table 4 Trace element contents in soils under five grasses treatments from 2018 to 2020
2.8 不同生草处理对果园土壤酶活性的影响
经果园生草处理后,土壤脲酶含量随着生草时间的延长而增加,3个年份生草处理土壤脲酶活性显著高于清耕处理(图5)。其中,DT3生草处理2018年土壤中的脲酶活性是清耕的2.13倍,2019年是清耕的2.07倍,2020年是清耕的2.47倍。3个年份生草处理与清耕处理相比土壤磷酸酶活性显著提高(图5)。其中,ET4生草处理的土壤磷酸酶活性高于其他生草处理,2018年高于清耕处理51.19%,2020年高于清耕处理61.92%,2020年高于清耕处理67.99%。与清耕相比,生草处理3个年份土壤过氧化氢酶活性提高,FT5生草处理2018、2019、2020年分别比清耕提高了3.46%、4.37%和5.14%。
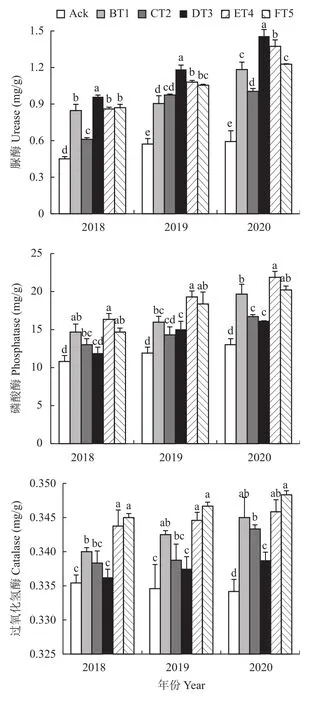
图5 不同生草果园的土壤酶活性Fig. 5 Enzyme activities in orchard soils planted with different grass species
2.9 不同生草处理对果园土壤碳组分的影响
2.9.1 对土壤有机碳含量的影响 由图6可知,2018年ET4、FT5和BT1生草处理土壤中的有机碳含量分别较清耕对照显著提高了38.50%、27.68%和27.51%。2019年各生草处理土壤有机碳含量比2018年高,2020年生草处理土壤有机碳含量显著高于2019、2018年生草处理。ET4处理的土壤有机碳含量最高,2020年生草比2019年生草有机碳含量提高了9.59%,2019年生草土壤有机碳较2018年生草提高了10.7%。
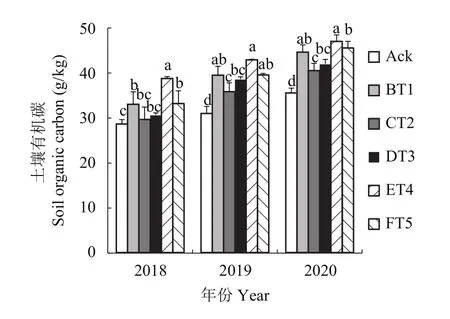
图6 连续3年果园生草土壤有机碳含量Fig. 6 Soil organic carbon content in orchard soils planted with different grass species over three consecutive growing seasons
2.9.2 对土壤总有机碳含量的影响 由图7可知,3个年份生草处理与清耕对照相比,土壤全碳含量存在显著性差异且显著高于清耕对照。随着生草年份的增加土壤总有机碳含量呈增加趋势,尤以FT5处理的土壤总有机碳含量最高,2018年FT5处理土壤总有机碳含量为1.65g/kg,比清耕对照提高了50.55%;2019年FT5处理的土壤总有机碳含量为1.68 g/kg,比清耕对照提高了53.22%;2020年FT5处理为1.96 g/kg,比清耕对照提高了79.17%。
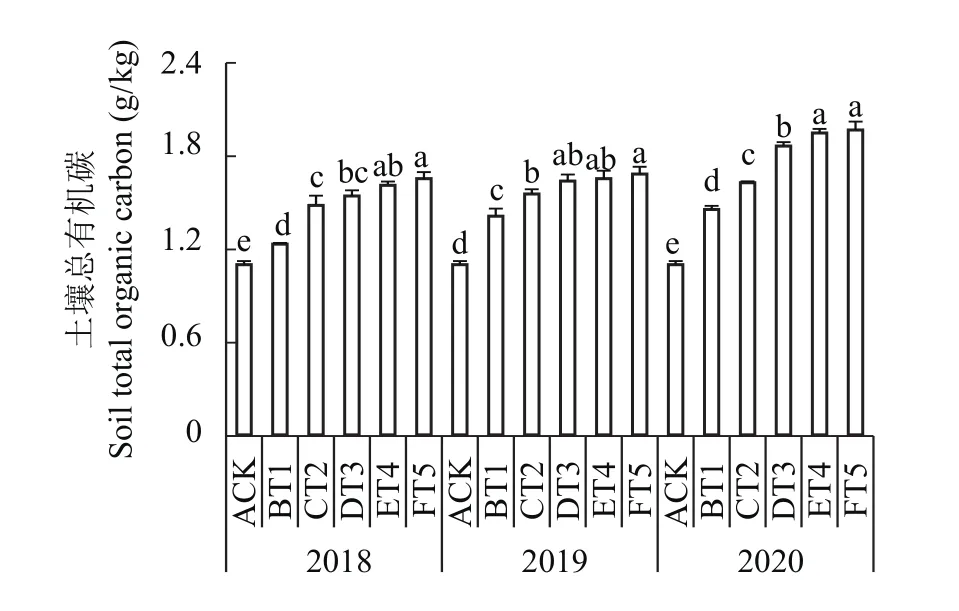
图7 连续3年果园生草土壤总有机碳含量Fig. 7 Soil total organic carbon content in soils planted with different grass species over three consecutive growing seasons
2.9.3 对土壤可溶性有机碳含量的影响 如图8所示,不同生草处理的果园土壤可溶性有机碳含量随生草年限的增加而呈现上升趋势。2018年生草处理中DT3处理土壤中可溶性有机碳含量显著高于其余生草处理,比对照提高了40.74%,2019和2020年CT2和DT3生草处理土壤中可溶性有机碳含量显著增加,与对照相比,CT2处理分别增加了51.91%和52.35%,DT3处理分别增加了60.47%和63.41%。
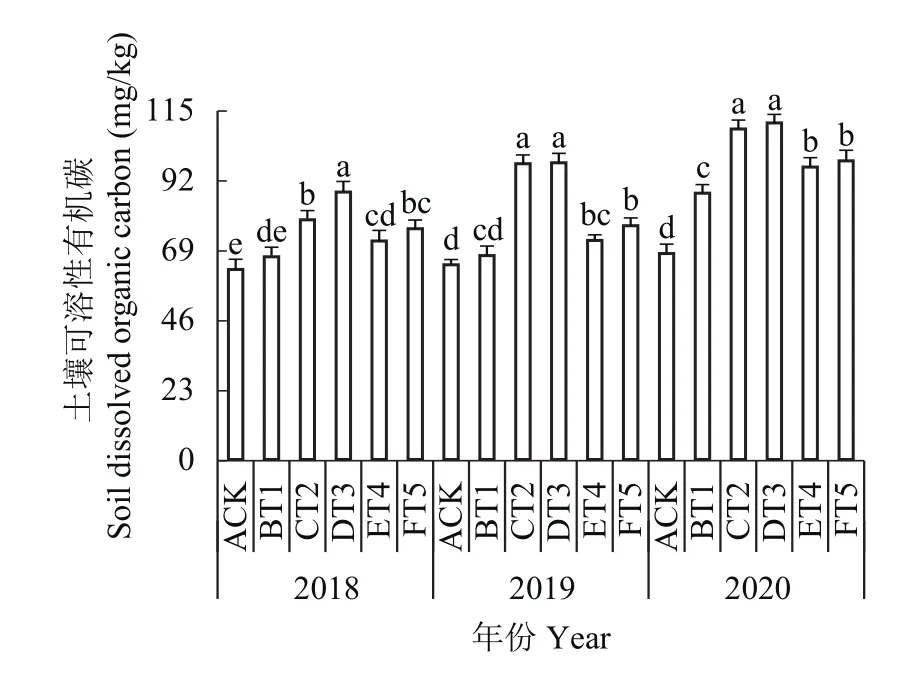
图8 连续3年果园生草土壤可溶性有机碳含量Fig. 8 The content of dissolved organic carbon in soils planted with different grass species over three consecutive growing seasons
2.9.4 土壤中酶活性和碳组分相关性分析 由表5可知,SOC与脲酶、磷酸酶、过氧化氢酶、细菌、真菌和放线菌;磷酸酶与过氧化氢酶、细菌、真菌和放线菌;过氧化氢酶与细菌、真菌和放线菌;真菌与放线菌极显著正相关(P<0.01),DOC与TOC和脲酶极显著正相关,TOC与SOC 、脲酶、磷酸酶、过氧化氢酶、细菌、真菌和放线菌极显著或显著正相关,细菌与真菌和放线菌极显著或显著正相关。脲酶与磷酸酶、过氧化氢酶、细菌和放线菌极显著或显著正相关。上述结果表明,果园生草处理中土壤的碳组分(除DOC外)、酶活性与微生物数量之间存在极显著或显著正相关。
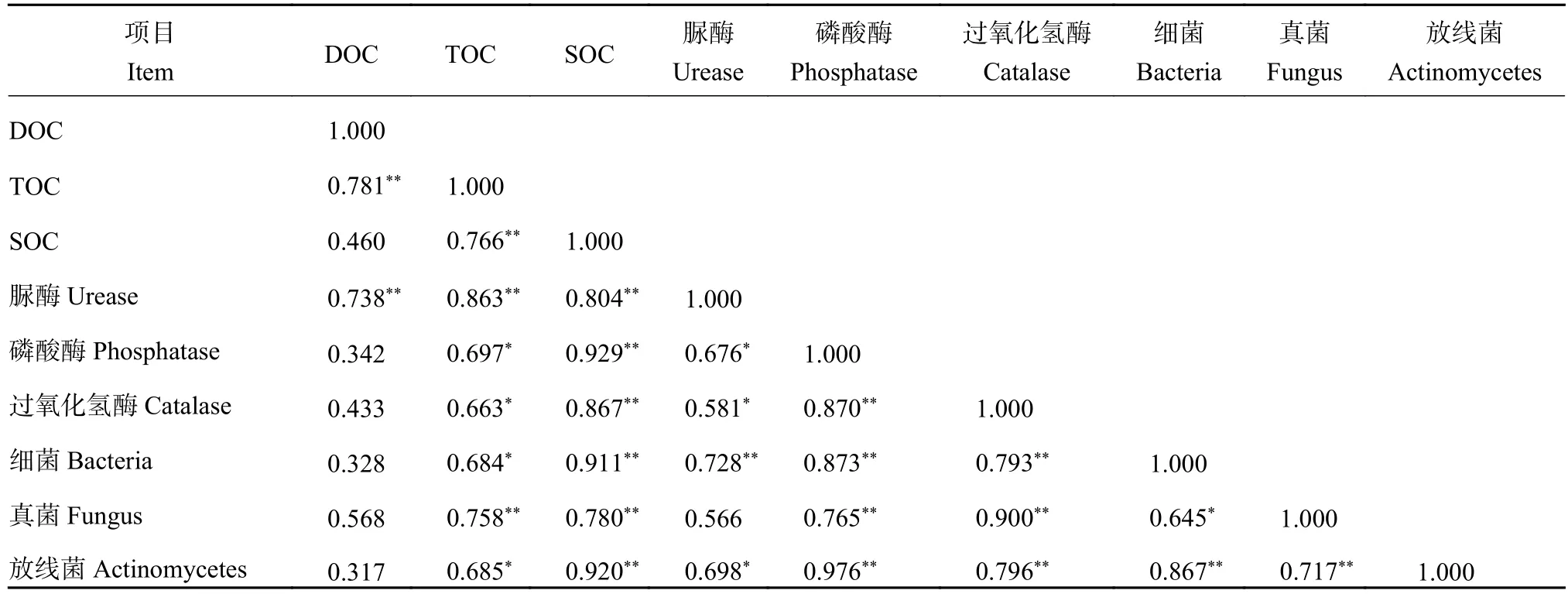
表5 土壤碳组分、酶活性和微生物数量的相关性Table 5 Correlation of soil carbon components, enzyme activities and micro-organisms number
3 讨论
土壤微生物作为土壤中最活跃的部分,直接或间接的参与大量的生化反应,对促进土壤物质循环、稳定与保持土壤的生产力和健康方面发挥着重要作用[22–23]。微生物的多样性是维持生态系统稳定性和微生物功能的重要因素之一[24]。微生物活动中碳源和氮源来源之一是植物,微生物又分解碳源和氮源,为植物提供养分从而达到互惠互利。本试验利用高通量测序技术,ET4处理效果好,土壤细菌中OTU个数明显高于清耕对照,为5688个,比清耕对照提高了22.22%;同时细菌总体的OTU、丰富度和多样性高于真菌。经Alpha多样性分析得知,ET4和FT5处理土壤细菌Shannon、Simpson和Chao1指数高于清耕对照,这与Beta 多样性分析结果相符,其组间微生物多样性差异大。有研究结果表明,土壤中由细菌主导转向真菌主导时,植株受病菌侵染性加大[25]。ET4处理,细菌数量增多,真菌数量减少,在一定情况下,降低了植株遭受病害的几率。尽管其余几个生草处理,对细菌和真菌的多样性和丰富度不如ET4生草和FT5处理影响效果显著,但一定程度上降低了真菌的OTU,对植株仍有一定的保护作用。生草处理的根际土壤Beta多样性存在差异的原因有待进一步验证。
据物种注释结果,6个土壤样品中细菌的优势类群为变形菌门、酸杆菌门、放线菌门、芽单胞菌门、浮霉菌门、绿弯菌门,这6种优势类群在各自处理中所占比例均超过95%,其中,变形菌门和酸杆菌门的比例超过50%。本试验中,生草处理提高了变形菌门、酸杆菌门和放线菌门丰度,其他菌门低于清耕对照。有研究结果表明,变形菌门和放线菌门等为土壤中的有益菌,各种有机物的碳氮代谢类型多样化,变形菌门参与其中,它还可作为生物因子治理代谢环境中的化学污染[26]。同时也有研究表明变形菌门和放线菌门参与有机质分解[27]。土壤中酸杆菌门大多是嗜酸菌,分布在不同土壤环境中,对土壤酸性有一定的影响[28]。不同生草处理其微生物相对丰度的变化可能与土壤微环境的酸碱性有关,具体原因仍需后续进一步研究。
真菌优势种群为子囊菌门、担子菌门、球囊菌门和接合菌门,在各自处理中占比超过80%,其中子囊菌门在个6个处理中均超过20%。虽然有研究结果显示,子囊菌门中的2 个变种,即V.mali var.pyri和 Valsa mali var. mali,是苹果腐烂病的主要病原菌之一[29],但是也有结果显示,子囊菌门中的Incertae sedis 27 还具有促进生根的作用[30]。担子菌门数量多、分布广,可食用、也可药用,也可引起植物和园林病害[31]。本试验中,5个生草处理与清耕对照比较,提高了土壤中的担子菌门相对丰度,而子囊菌门相对丰度呈降低趋势,CT2处理土壤降低明显,降低了1.83倍;CT2、ET4和FT5处理提高了土壤中的球囊菌门相对丰度,而BT1和DT3处理土壤中的球囊菌门相对丰度小,引起生草处理中真菌群落相对丰度变化的原因还有待研究。
土壤酶来源于动物尸体、植物残体和土壤微生物,是表层土壤健康的关键指标。有研究结果表明,猕猴桃园套种吉祥草可增强土壤中的酶活性,过氧化氢酶参与各种化合物的氧化,磷酸酶促进有机磷化合物的水解,脲酶促进有机质分子中肽键的水解,蔗糖酶完成土壤有机体循环过程[32–33]。徐凌飞等[34]研究表明,梨园生草可不同程度的提高土壤酶活性。本试验研究结果表明生草处理与清耕相比,可显著提高土壤中过氧化氢酶活性、脲酶活性和磷酸酶活性,并在不同生草处理中酶活性存在显著性差异,这与徐凌飞等[34]的试验研究结果一致。生草后显著提高了土壤中各类土壤酶活性,可能是生草后枯草凋落物还田腐解引起土壤微生物群落多样性和丰富度升高而间接影响土壤酶活性[35]。土壤中的有机碳是土壤肥力的核心和重要来源,为植物生长提供多种营养,是促进果树生长发育、实现果树丰产的重要条件。研究表明,果园生草可提高土壤有机碳含量[36]。另外,果园生草对土壤有机碳的影响还与生长年限有关[37]。吴玉森等[38]对梨园生草的研究结果表明,持续多年的自然生草有利于土壤表层脲酶和碱性磷酸酶等主要酶活性的提高,对土壤有机质含量提高均具有明显作用;随着生草年限的增加,自然生草对改善梨园土壤矿质营养状况同样具有良好效果。本试验中,ET4处理2018年的土壤有机碳含量显著增加,5个草种处理2019年的土壤有机碳含量较清耕均有显著增加,且2020年生草和2019年生草处理的土壤有机碳含量比2018年生草有明显的提高,说明果园生草可以提高土壤有机碳的含量,且随着生草年限的增加,有机碳含量提高的效果更明显。果园生草不但有利于诱集害虫到草中觅食、越冬,降低地上害虫防治的难度,还有利于害虫天敌的生存和繁育,增加害虫天敌(如瓢虫、草蛉等)数量,减少病虫害发生、农药投入、农药残留、环境污染,但若干年后,园内是否会产生草与果树共患的病虫害风险甚至是生态危害尚不明确,有待进一步探讨[39]。
4 结论
果园生草可改变土壤中细菌和真菌的丰富度和多样性,改变土壤中门水平的细菌和真菌的相对丰度。弯叶画眉草可提高土壤中细菌丰富度和多样性,沙画眉草处理土壤细菌中的芽单胞菌门、浮霉菌门、绿弯菌门相对丰度降低;5个生草处理提高了土壤真菌中担子菌门的相对丰度,垂穗草处理子囊菌门相对丰度降低明显,垂穗草、弯叶画眉草和加拿大披碱草提高了土壤中的球囊菌门相对丰度。随着生草时间的延长,不同生草处理均不同程度地提高了土壤有机碳、酶活性和微生物的含量。综合来看,弯叶画眉草和加拿大披碱草处理对于改善土壤环境、土壤养分和微生物活性的效果较好。
