铜胁迫对植物生长发育影响与植物耐铜机制的研究进展
2021-12-05王子诚陈梦霞杨毓贤刘众杰王令宇葛孟清房经贵上官凌飞
王子诚,陈梦霞†,杨毓贤,方 项,刘众杰,王令宇,葛孟清,张 川,房经贵,上官凌飞*
(1 南京农业大学园艺学院, 江苏南京 210095;2 江苏省果树品种改良与种苗繁育工程中心, 江苏南京 210095)
重金属指密度大于5 g/cm3的金属元素,大约有53种,包括铜(Cu)、镉(Cd)、铅(Pb)、锌(Zn)、钴(Co)、汞(Hg)、铬(Cr)以及砷(As)等[1]。重金属污染对环境与生物正常生命活动具有较强的破坏作用,具有长期性、潜伏性和不可逆性等特点[2]。植物根系因直接接触土壤而更易受到重金属的毒害作用,一旦重金属大量积累在植物中进入食物链,将最终危害人类健康。因此,深入研究重金属对植物生长发育的影响及植物对重金属的耐受性显得尤为重要。
铜(Cu)是自然界中广泛存在的一种重金属元素,是植物所必需的微量营养元素之一,但土壤中Cu浓度超过某一阈值时将会抑制植物的生长发育,严重时可造成植物死亡[3]。2014年,《全国土壤污染状况调查公报》显示我国16.1%的土壤受到不同程度污染,其中铜污染物点位超标率达2.1% (http://www.mee.gov.cn/gkml/sthjbgw/qt/201404/W02014041755899 5804588)。正常情况下,大多数农作物叶片中铜的含量范围为20~30 mg/kg[4],近年来环境中Cu污染日益严重,主要来源于工业“三废”的排放,且含Cu饲料添加剂和杀菌剂(如波尔多液等)的广泛应用,土壤中铜含量普遍提高,可高达1280 mg/kg[5]。生长在铜污染土壤中植株体内铜含量大大提升,对植株生长发育产生重大影响[6]。可见Cu过量胁迫已成为导致作物产量和质量下降的主要因素之一[7],因此,全面了解铜含量与植物之间的关系对解决全球作物产量问题有重大意义。本文系统总结了Cu对植物的影响,以及植物应对Cu胁迫的响应途径与相关机制的经典与最新研究成果,以期为该领域更深入的研究提供参考。
1 植物对铜离子的吸收、转运及积累
铜离子在植物体的不同组织、器官中的分布存在差异,这与植物对铜离子的耐性程度差异有关[8]。植物根系从土壤中吸收铜离子后,主要将其固定于细胞壁或液泡中,多余的铜离子则通过铜转运蛋白运输到地上部的组织或器官。
1.1 植物根系对铜离子的吸收
土壤中的铜主要以Cu+和Cu2+两种形式存在,土壤溶液中Cu2+在铁还原氧化酶4/5 (ferric reductase oxidase 4/5, FRO4/5) 催化下还原为 Cu+,随后铜转运蛋白 COPT1/2 (copper transporter1/2)和 ZIP2/4 (zincregulated transporter 2/4)可分别协助 Cu+和 Cu2+跨越质膜进入根细胞内(图1)[9–10]。植物对铜离子的吸收很大程度上受铜离子浓度、pH、N源、根际微生物等因素影响[11]。一般情形下,随着pH的升高,重金属的有效性降低。铜离子在酸性土壤中移动性较强,多以水溶态或配合态存在,容易被植物吸收;在中性或碱性条件下,铜离子的移动性很差,多以碳酸盐和铁锰氧化结合态等形态存在,难以被植物吸收利用[12]。氧化还原电势(Eh)降低也会导致土壤中铜对植物的可用性降低[13]。研究证明,外源添加柠檬酸能显著提高土壤中弱酸溶解态Cu的含量,增加铜的生物有效性[14]。吴洁婷[15]研究发现,丛枝菌根真菌 (arbuscular mycorrhiza fungi, AMF)可显著增强芦苇对Cu元素的吸收。另外,离子间的相互作用也会影响Cu离子的吸收,如K+和Zn2+离子可抑制植物对土壤中Cu2+的吸收[16];Si元素的加入可减少水稻中Cu含量,缓解重金属毒害作用[17]。细胞壁在植物从土壤中吸收铜离子过程中发挥了重要作用。组成植物细胞壁的纤维素、半纤维素、果胶和糖蛋白等成分具有带负电的活性基团(如羟基、羧基和醛基等),对阳离子重金属有较高亲和力,铜以阳离子的形式附着于根系细胞壁[18]。
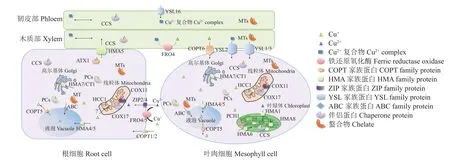
图1 植物体内铜转运过程[11,19]Fig. 1 Copper transport process in plants[11,19]
1.2 铜在植物体内的转运
根系表面的Cu离子进入根细胞后,在细胞质中与金属硫蛋白(metallothionein, MTs)或特定的可溶性Cu伴侣结合,而后被传递至不同细胞器(如液泡、叶绿体和线粒体等),以清除细胞质中过量的Cu离子(图1)[11, 19]。这一过程是由参与细胞内Cu稳态调控的Cu转运蛋白家族和Cu伴侣家族介导的。其中Cu转运蛋白包括COPT、ZIP、YSL (yellow stripe like)、HMA (heavy metal ATPase)等家族蛋白[20];Cu伴侣蛋白包括3类,即ATX-like (antioxidant protein-like)、CCS (Cu+chaperone for Cu/Zn SOD)和COX (cytochrome c oxidase)[21]。首先 COPT1/2 和ZIP2/4分别将Cu+和Cu2+转运进根细胞后,定位于液泡膜上的HMA4/5和COPT5分别控制Cu离子进出液泡,并且 ABC (ATP-binding cassette transporters)转运家族蛋白也参与将Cu-PC (phytochelatin)复合物转运进液泡这一过程[22]。HMA7和CT1 (MFS-type transporter)则介导Cu+向高尔基体转运。线粒体中,膜间隙的COX17将Cu+传递至线粒体内膜上的另外两个伴侣蛋白(HCC1和COX11)。细胞质中的硫醇化合物(PCs和MTs等)和Cu伴侣蛋白可与游离Cu+螯合,参与铜离子转运过程。这些与根细胞中Cu稳态相关的转运蛋白在大量研究[23–24]中均有报道。随后,ATX1将Cu+传递至HMA5,HMA5将其装载到木质部[25],木质部中的相关转运蛋白(如YSL1/2/3和COPT6)继而将Cu+向地上部分运输[26]。Cu2+络合物在韧皮部中的转运主要依赖于YSL16,在水稻中发现OsYSL16 (表1)能将Cu2+络合物从衰老器官转移到幼嫩组织和种子中[44]。叶绿体伴侣蛋白PCH1(plastid chaperone 1)、CCS 以及 Cu 转运蛋白 HMA6/PAA1、HMA8/PAA2和HMA1参与叶绿体中铜离子转运过程[11]。20 μmol/L铜离子浓度处理下,拟南芥中一部分铜离子通过AtHMA6与铜伴侣蛋白CCS介导传递给基质Cu/Zn超氧化物歧化酶,一部分铜离子通过铜伴侣蛋白AtPCH1传递到叶绿体内膜上的AtHMA6 (PAA1),AtHMA6通过叶绿体的包膜运输铜离子进入叶绿体基质[27–32],然后 AtHMA8 (PAA2)转运铜离子到类囊体腔的质体蓝素,维持植物体进行正常的光合作用[28]。当细胞处于缺铜状态时,大麦HvHMA1蛋白可介导叶绿体中的铜外排到细胞质中[51]。近年来,虽然在探究铜的胞内转运模式方面有了较大进展,但铜如何进入线粒体及到达目标位点的过程仍不明确,并且关于铜离子向地上部的转运机制也有待进一步详细解释[19, 53]。

表1 不同物种中铜胁迫相关基因及调控因子Table 1 Copper stress-related genes and regulatory factors in different species
1.3 铜在植物体内的积累
Cu被植物根系吸收后向地上部分转移,以达到维持植物正常生命活动所需的铜含量。不同物种地下部分和地上部的铜含量及铜的根茎转移能力存在较大差异,如向日葵幼苗的铜浓度是根系的2~4倍[54];对植物体各器官进行Cu含量测定,发现湿地松富集能力随铜处理浓度增大而增大,其中对铜富集能力最强的器官是根,其次是茎和叶[55];生菜的铜吸收和转运潜力比菠菜高,生菜60%~80%的铜存于根中,而菠菜根茎的铜没有显著差异[56]。但植物处于高铜状态时,Cu主要固定于根部,而茎在胁迫早期铜含量并无显著变化[57],这是植物对高铜胁迫的一种适应性表现,在桂花[58]、苹果[59]等植株上也得到验证。有研究发现Cu处理浓度超过60 mg/kg时,‘寒富’苹果根系的生物富集系数显著提高而地上部分则变化不明显,并且在铜浓度达到300 mg/kg时,幼苗根系受到损伤,导致铜向地上部分转运能力降低[60]。类似的,高铜 (937.5 mmol/L) 胁迫下柑橘根部的铜积累量远远大于叶片,铜元素从根部向叶片的转移率显著降低[61]。可见高铜浓度下植物主要将铜离子积累在根部,在一定程度上缓解铜离子毒害作用,但铜离子浓度超出根系所能承受的范围时,将会严重危害植株的生长发育[55]。
2 铜胁迫对植物生长发育的影响
植物遭受铜胁迫后,其生长发育往往受到不同程度的影响,主要体现在种子萌发、根系发育、光合作用、养分吸收及氧化胁迫等方面。
2.1 对种子萌发的影响
铜是植物生长发育必需的微量元素,因此铜对植物种子萌发通常表现为低浓度促进,高浓度抑制的效果[62]。研究发现,高浓度铜离子主要通过影响酶活性和渗透作用来抑制种子的萌发。例如,在水稻[63]和黄瓜[64]中均发现过量铜可抑制种子萌发,其主要原因可能是种子内的一些酶(如淀粉酶,蛋白酶等)活性受到抑制,无法满足种子生长发育所需的物质和能量,从而抑制种子生长。高浓度Cu (2 mmol/L)处理下海枣淀粉酶活性被抑制,种子萌芽指数显著下降91.63%,发芽速度也大幅下降[62]。另外,种子萌芽情况的变化可以通过种子吸水效率的变化来解释。Ahsan等[65]研究发现,Cu胁迫抑制植物种子的萌发主要是通过改变种子外部渗透压而影响其吸水能力造成的。水分吸收不足可能会加快种子内部营养物质的分解,从而减少分生组织细胞的形成[66],而这一重要现象又与种子的淀粉酶活性密切相关[62]。
2.2 对植株根系发育和生长的影响
重金属胁迫发生时,植物根系生长受到抑制[67]。有学者证明植物根细胞中Cu离子的积累可能通过改变根分生组织细胞增殖速度或调节生长素(IAA)、细胞分裂素 (CTK) 等植物激素来影响根系发育[19, 47, 61]。Michaud等[68]研究发现,小麦根系中Cu离子浓度达到100、150和250~300 mg/kg时,其根系长度分别减少10%、25%和50%,说明在一定的范围内,Cu离子浓度越高,对根系生长抑制效果越明显。根系受损可直接影响植株地上部分的生长发育,其中生物量及株高通常作为检测植株受金属毒害程度的生理指标[69]。Huang等[70]研究发现,白柚在0.5~300 μmol/L铜浓度下生物量无明显变化,当铜浓度达到400 μmol/L时,生物量显著下降。此外,反复喷施波尔多液会使柑橘[71]和凤梨[72]等果树树体生长减缓,出现部分落叶。植株生物量的降低将直接影响其产量,在水稻[73]、柑橘[70,74]、葡萄[75]等作物研究中均发现铜胁迫可显著降低作物品质和产量。
2.3 对植株光合作用的影响
Cu是植物叶绿体中质体蓝素的组成成分,参与光合电子传递过程,也是叶绿素形成过程中某些酶的活化剂[76]。适量的Cu离子可促进植物的光合作用,但浓度过高则会使叶绿素蛋白失活,改变叶绿体超微结构,破坏类囊体的结构和功能[61],并且还可降低核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCo)效率,抑制光合电子传递效率和PSII活性,最终抑制光合作用,严重影响养分积累[77]。Aly等[78]认为叶片中叶绿素水平降低是由于Cu2+取代叶绿素分子中的Mg2+以及过量Cu2+引起的叶绿体膜的过氧化作用导致的。有报道称低浓度Cu2+(<300 mg/kg)能够增加‘寒富’苹果幼苗叶绿素含量,使叶片保持健康状态,而Cu2+浓度超过 300 mg/kg时,植株受到胁迫,幼苗叶绿素含量和光合效率均降低[60]。在施加600 mg/kg Cu2+后,毛竹叶片光合作用有效性指数Chl.a/Chl.b (叶绿素a/叶绿素b)显著降低,说明高浓度铜严重抑制了叶绿素的合成过程,从而降低植物的光合效率[79]。
2.4 对植株养分吸收的影响
土壤中大量Cu2+会抑制植物吸收其他养分,这是由离子间拮抗作用或高浓度Cu2+影响根系生长造成的[80]。根系一般是遭受铜害的首要部位,过量Cu2+优先在植物根系中积累,根长会随着Cu2+浓度的增加而减少,影响根系对水分及矿质元素的吸收,进而抑制地上部分的生长[61]。Hippler等[81]研究发现,Cu毒害会降低柑橘根系中的N、Ca、B、Mn、Zn以及叶片中Ca、Fe、Mn的含量。浓度大于5.0 mg/L的铜处理下,紫花苜蓿芽中Cu、P、S含量显著增加,生菜中P、Fe含量相应减少[82]。提高铜的供应量可显著降低高粱根系对Fe、Zn、Ca和Mn的吸收[83]。从以上结论可看出,植株种类、吸收部位及养分类型等因素均会影响植株对养分的吸收。
2.5 对氧化胁迫的影响
正常情况下,植物体内活性氧(reactive oxygen species, ROS)的产生与清除处于动态平衡,当重金属胁迫下积累的ROS浓度超过植物防御机制的阈值,就会造成氧化胁迫[84]。铜胁迫可诱导细胞产生大量ROS,导致膜脂质过氧化,质膜选择透性降低,细胞内含物质外渗,丙二醛(MDA)含量升高,同时损伤光合细胞器,进而影响植物物质交换、光合作用等各种生理代谢过程的正常运行[48,61,85]。目前已在柑橘和葡萄等[43,40]多种果树上报道Cu可诱导细胞积累大量ROS,影响植株正常生长发育。MDA作为膜脂过氧化指标,通常与氧化胁迫程度成正比。在高浓度Cu胁迫下,植株叶片细胞受到严重损伤,相对电导率、MDA含量显著上升[61,86]。湿地松幼苗的MDA含量随着Cu处理浓度增加而增加,在Cu离子浓度为5 mmol/L下,MDA含量达到最大值,为对照组的2.94倍[55]。在‘寒富’苹果中也发现,不同铜浓度处理下幼苗各组织中MDA的含量与对照相比均有提高[60]。
3 植物应对铜胁迫的防御机制
植物在对生长环境不断适应的过程中形成了一套规避或耐受铜离子毒性的防御系统,包括2种不同的防御机制(图2)。一种是避性机制,包括根系分泌物影响重金属的移动性[87],细胞壁、细胞膜和液泡的隔离和区室化作用以及金属外排系统[88]。另一种是耐受机制,植物通过螯合作用、抗氧化系统、热激蛋白、植物激素、自噬和表观遗传等途径缓解体内铜离子毒害[4, 89–90]。

图2 铜胁迫下植物响应机制Fig. 2 Plant response mechanism under copper stress
3.1 避性机制
3.1.1 根际分泌物 植物根系分泌物(有机酸和氨基酸等)通过改变土壤pH和Eh、螯合重金属、提高微生物活性等方式来影响土壤重金属的有效性和活性,进而影响植物对重金属的吸收和转移[52]。
高铜时,植物根系可分泌柠檬酸、草酸、苹果酸、酒石酸、琥珀酸等有机酸[91]。这些有机酸不仅能与重金属结合形成无毒复合物,也能通过促进植株生长和提高抗氧化酶活性等途径减轻重金属对植物的毒害作用[92–93]。在铜胁迫下,不同物种体内起主要作用的有机酸的种类存在差异。刘杰等[94]研究表明,与草酸和酒石酸相比,柠檬酸的添加更能促进烟草对重金属铜的富集。Chen 等[95]发现,毛竹在25 μmol/L Cu处理下会促进其根系分泌草酸、苹果酸和乳酸等低分子量有机酸,其中草酸含量占所有有机酸含量的50%以上。蓖麻在铜处理浓度达到750 μmol/L时分泌大量酒石酸,其浓度可高达329.13 μmol/g[42]。氨基酸(如组氨酸、脯氨酸)中的氨基、羧基、羟基等功能团能与重金属结合形成稳定化合物,达到钝化解毒的目的[96]。有报道称芥菜幼苗暴露于铜胁迫7天后,其体内脯氨酸、甲硫氨酸、半胱氨酸等游离氨基酸含量随着Cu浓度的增加而增加[97]。朱奎正[98]研究发现外源β-氨基丁酸(GABA)通过调节活性氧含量及相关抗氧化酶活性和控制有关金属离子运输基因的表达来提高烟草对铜胁迫的抵御能力。
3.1.2 隔离和区室化作用 植物将吸收的金属区隔在一些代谢不活跃的组织、器官或亚细胞结构(表皮细胞、维管束、细胞壁和液泡等)是一种有效的响应重金属胁迫的机制。有报道指出,细胞壁和液泡是根系固定铜的主要场所。例如,苹果植株将所吸收的大部分Cu离子固定在根系细胞壁和液泡中,并能转化为难溶性磷酸盐或草酸盐态Cu等低毒或无毒化合物,从而缓解Cu离子毒害[99]。研究发现,60 mg/L CuSO4处理下,50.2%的Cu分布在蓖麻愈伤组织细胞壁中[100]。也有报道称,番茄[101]和玉米[102]的铜毒害缓解作用主要与液泡的区室化作用有关。液泡膜上存在金属耐受蛋白 (metal tolerance protein,MTPs)家族中的成员,可转运重金属并维持细胞内金属离子稳态,有相关报道称萝卜 (Brassica rapavar. rapa)BrrMTPs基因可能参与了铜离子稳态平衡[48]。另外,细胞内重金属过量时,部分会被转运至细胞质中。研究发现,蓖麻叶片中细胞质可溶性组分Cu的比例分数远高于其它组分,此时胞质内大量硫醇类化合物结合金属阳离子形成复合物[14]。液泡和细胞质含有大量的有机酸、酶、蛋白质和脂质,它们可以螯合金属以降低毒性,这可能是铜离子主要集中在液泡和细胞质中的原因[79]。
3.1.3 金属外排系统 植物体内存在一种金属外排机制,通过减弱金属离子在植物组织中的积累能力而达到解毒的效果。大量研究证明,转运蛋白HMA、MTP、ZIP等在植物的金属外排系统中发挥重要作用。HMA5在金属跨膜转运,尤其在根系Cu+解毒中起关键作用。在敲除水稻 (Oryza sativa)OsHMA5基因的突变体中,根系中高浓度Cu+说明OsHMA5参与了重金属由根向芽的运输[43]。因此,HMA5可能参与了根细胞中Cu+的外排,并且其过表达可能是高铜时提高植物解毒能力的一个策略[25]。高铜胁迫下,水稻敲除OsZIP1基因后明显抑制水稻生长,过表达则促进,另外内质网和质膜的双重定位也提示OsZIP1作为铜过量时的金属外排蛋白,可能在环境条件变化时发挥作用[46]。MTP也属于一类排出蛋白,在重金属的外排或区室化隔离过程发挥作用。研究发现,12个甜橙 (Citrus sinensis)CitMTP家族基因在铜过量时表达上调,但CitMTPs家族蛋白的具体作用还有待研究[52]。可见植物的铜外排系统受到Cu转运相关基因的调控,今后可以利用多组学技术鉴定与铜外排过程相关的关键基因,并结合转基因工程技术来进一步提高植物耐铜性。
3.2 耐受机制
3.2.1 螯合作用 重金属胁迫下,植物可以合成或分泌植物螯合肽(phytochelatin, PCs)和金属硫蛋白(metallothioneins, MTs)等硫醇化合物[4],它们对金属离子具有较高亲和力,可与进入细胞的Cu+/Cu2+结合,从而降低游离Cu离子的活度系数和毒性,这是植物重要的重金属解毒机制之一[2]。
1)植物螯合肽 植物螯合肽(PCs)由半胱氨酸、谷氨酸和甘氨酸组成,是以谷胱甘肽(glutathione,GSH)为底物在植物螯合肽合成酶 (phytochelatin synthase, PCS) 的催化作用下合成的含巯基多肽[103]。PCs对重金属亲和力较高,可以螯合多种重金属离子,形成对植物低毒或无毒的重金属-PC复合物,防止重金属作用于细胞代谢过程中的重要酶,从而减轻对植物的毒害[104]。Cu是PCs在植物体内生成的诱导剂之一,Cu胁迫下,耐性植物中γ–谷氨酰半胱氨酸合成酶、谷胱甘肽还原酶、植物络合素酶等与植物螯合肽合成相关酶含量均显著提高[105]。另有研究发现,外源施用GSH可促进石竹幼苗和杨树中植物螯合肽的形成,因此有学者指出GSH的生物合成调节是PCs合成调控的一种潜在机制,这对植物耐铜性的研究提供了参考[106–107]。
2)金属硫蛋白 金属硫蛋白(MTs)是植物体内另一类与重金属解毒有关的富含半胱氨酸的低分子量蛋白[2]。它与PCs不同的是,MTs由基因直接编码而成,而PCs是以GSH为底物在螯合肽合成酶催化下合成[96]。MTs可以被重金属(尤其是Cu)诱导产生,过表达油菜 (Brassica campestris)BcMT1、BcMT2和木豆(Cajanus cajanL)CcMT1均能增强转基因拟南芥的耐铜性,并抑制ROS产生,从而保护植物免受氧化损伤[49–50, 99]。通过同步辐射扩展 X 射线吸收精细结构 (EXAFS) 分析植物体内的Cu形态,发现海州香薷和鸭跖草体内的Cu多半与含硫物质结合,这表明含硫化合物对Cu的解毒起着重要的作用[108]。此外,MTs在Cu的长距离运输和分配中也起着重要作用。拟南芥AtMT1a和AtMT2b的表达主要定位于叶片和根部的韧皮部,并受Cu诱导,而AtMT2a和AtMT3主要在叶肉细胞中表达,而且在幼嫩组织中(如发育中的叶片或根尖)的表达随Cu含量增加而被高度诱导[109]。
3.2.2 抗氧化系统 重金属胁迫下,植物启动抗氧化系统来清除体内多余的活性氧。抗氧化系统分为酶促系统和非酶类抗氧化系统,包括超氧化物歧化酶 (superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶 (catalase, CAT)、抗坏血酸过氧化物酶 (ascorbate peroxidase, APX) 和谷胱甘肽还原酶 (glutathione reductase, GR)等抗氧化酶以及 GSH、抗坏血酸 (ascorbic acid, ASA)、MTs和脯氨酸等非酶类抗氧化物质[110]。
1)酶促系统 植株抗氧化系统被激活以减轻重金属Cu造成的间接氧化胁迫,但如果胁迫程度过高,抗氧化酶活性则会受到抑制,造成氧化损伤[2]。研究证明铜能够提高编码不同抗氧化剂 (SOD、GPX、APX 和 CAT) 的基因转录水平[34, 35]。葡萄根系在不同浓度铜(0.5、1、1.5、2 mmol/L)处理下,POD、SOD和CAT活性均表现为先上升后下降[86]。此外,不同浓度Cu处理豇豆均增强了叶片和根中APX和GR活性以及根中CAT活性,但叶和根的SOD活性降低,表明豇豆中抗氧化酶对Cu的响应具有器官特异性[111]。
2)非酶抗氧化系统 AsA-GSH循环是植物响应胁迫的重要途径(图3),主要通过还原型的抗氧化物ASA和GSH、APX、GR、单脱水抗坏血酸还原酶 (monodehydroascorbate reductase, MDHAR)和抗坏血酸还原酶 (dehydroascorbate reductase, DHAR) 等参与的多个酶促反应共同作用,从而实现H2O2清除及ASA和GSH再生的过程,维持细胞氧化还原稳态,进而提高植物在胁迫条件下的抗逆性[112]。作为一类重要的辅酶和强还原剂,ASA在植物生长发育和防御机制中发挥重要作用[113]。生理条件下,谷胱甘肽主要以还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)两种形式存在于植物体内[114]。GSH可直接将活性氧还原,自身发生氧化反应形成GSSG,GSSG又可被GR还原成GSH[106]。研究表明,在1 mmol/L的高浓度Cu2+处理下,小麦根系ASA和GSH含量显著高于对照处理[115]。蓖麻叶片GSH含量也随着Cu处理浓度增加而增加[14]。与对照相比,10、50和100 μmol/L铜浓度处理下,水稻根部和地上部的GSH含量均高于对照,根部GSH含量增长率尤其显著,可能用于清除根系大量积累的H2O2以减弱高铜毒害作用[116]。Wu等[117]认为南方红豆杉可能通过合成大量ASA来抵抗铜胁迫造成的毒害作用。另外,1-肌醇-1-磷酸合酶基因(l-myo-inositol-1-phosphate synthase,MIPS)的上调可以增加植物肌醇含量,从而增强植物对各种胁迫的抵抗力。PeMIPS1的过表达导致抗氧化酶的活性增加以及ASA的积累,这部分解释了转基因杨树活性氧清除能力的增强以及H2O2和MDA含量的降低[30]。以上结果表明,植物在不同浓度Cu2+胁迫条件下,通过调控其体内不同器官的非酶抗氧化物含量变化来应对逆境胁迫的伤害,进而维持其自身的生命活动。
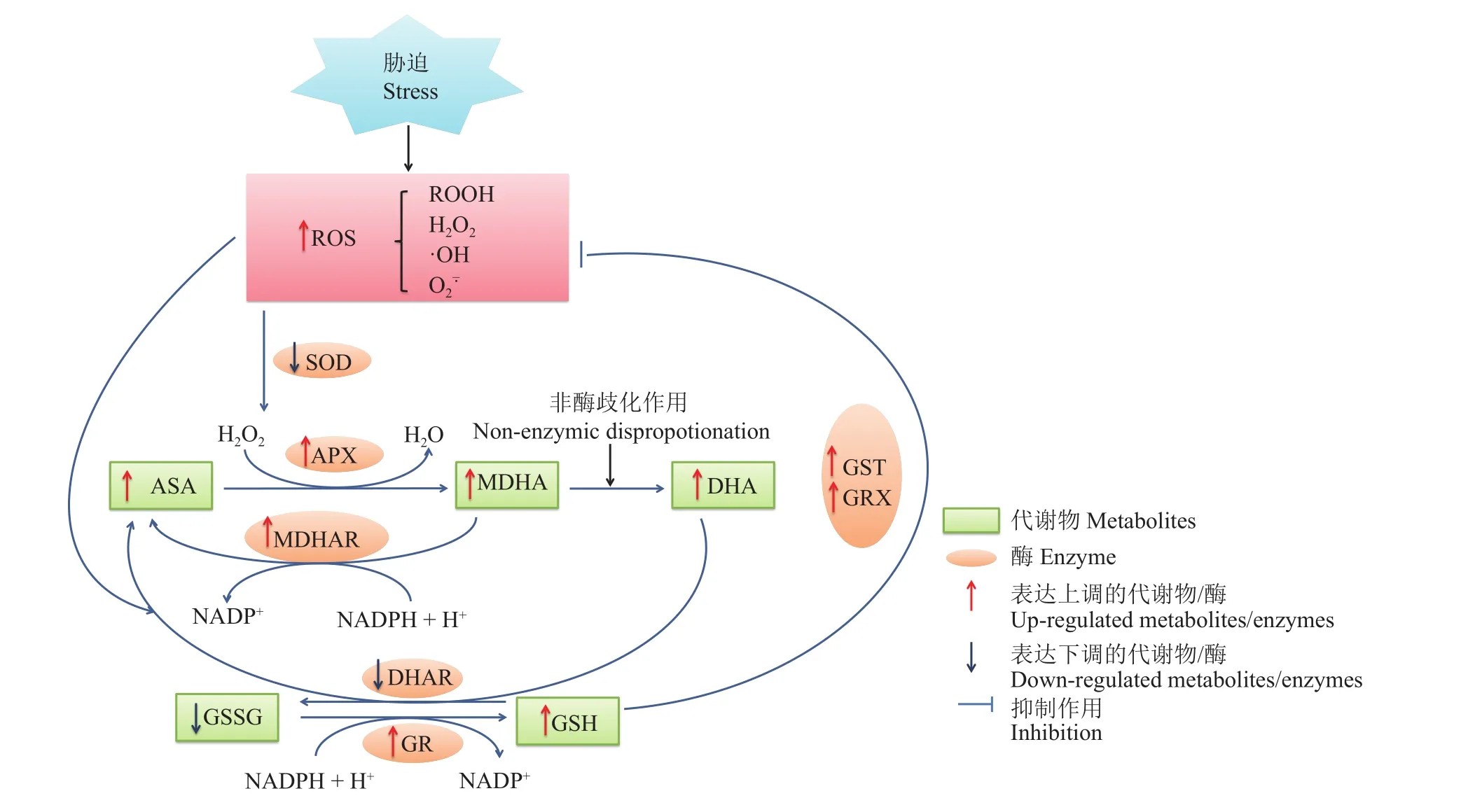
图3 胁迫下植物体内抗坏血酸-谷胱甘肽循环Fig. 3 The ascorbate-glutathione cycle in plants under stress
可见抗氧化系统对植物响应逆境具有重要作用,但其具体发挥的效果以及起关键作用的成员因物种、金属种类及浓度不同而有差异[2],需要深入研究。
3.2.3 渗透调节 植物可以自动增加脯氨酸(proline,Pro)、可溶性糖和可溶性蛋白等渗透调节剂的含量,以调节渗透平衡,从而维持重金属胁迫下细胞正常代谢以及提高植物抗逆性[118]。
通常情况下,植物体内的Pro含量极少,一旦遭受胁迫,植物将刺激Pro合成以清除细胞内积累的ROS[119]。有研究表明,与对照相比,南方红豆杉叶片Pro含量在2.5、5.0和10.0 mg/L铜浓度下分别增加了20.1%、48.5%和68.2%。张飞[120]对梨苗接种丛枝菌根(AMF)后发现,AMF可通过促进Pro的增加来提高植株抗性。可溶性糖和可溶性蛋白在一定范围内对于缓解重金属Cu胁迫也起到极其重要的作用。Cu在0~50 mg/kg的浓度范围内,与对照相比,青菜茎和叶中可溶性糖含量较对照均增加[121]。另外,黄芪根系可溶性糖和可溶性蛋白含量在8 mmol/L CuSO4处理下随处理时间延长呈现先升后降的趋势[85]。
3.2.4 热激蛋白 胁迫诱导合成的热激蛋白(heat shock proteins, HSPs)可防止蛋白质聚集或促进错误折叠及变性蛋白的选择性降解,在维持细胞蛋白质稳态方面起着重要作用[122]。研究表明,HSP70家族蛋白在各种植物中均响应环境胁迫而大量积累[123],该蛋白表达不仅可以限制金属离子引起的蛋白中毒症状,也能帮助MTs隔离和解毒这些离子[124]。在葡萄转录组中,44个差异表达的热激蛋白响应铜胁迫,5个热胁迫转录因子被铜胁迫诱导,其中VIT_08s0007g08750被铜强烈诱导,只在Cu处理组中特异表达[40]。单体大小为12~42 kDa的小型热激蛋白(sHSP)在植物中广泛存在。OsMSR3是水稻体内的一种sHSP,Cui 等[47]发现受Cu胁迫时,水稻组织内OsMSR3基因表达上调,且过表达OsMSR3诱导Cu胁迫下拟南芥SOD和POD相关基因表达的上调及活性的增强,缓解了铜离子对叶绿素和类胡萝卜素的破坏,同时植株能够积累更多的内源性ABA,从而增强转基因拟南芥的Cu胁迫耐受性。
3.2.5 植物激素 植物激素是细胞内主要的信号分子,通过激活各种抗氧化酶信号转导级联,刺激植物细胞多种转录因子及增强植物对重金属的富集能力等来缓解重金属的毒害作用。植物激素无法克服重金属对植物养分吸收产生的不良影响,但能有效抑制重金属的吸收。有报道[125]称,0.5 mmol/L CuSO4处理后8 h,‘阳光玫瑰’葡萄内源激素 (ABA、CTK、BR) 相关基因、蛋白及代谢物表达水平显著上调,随后逐渐下调,该多组学数据说明这3类植物激素参与植株响应铜胁迫过程。冷翔鹏[40]研究发现,生长素(IAA)、乙烯(ET)、脱落酸(ABA)、茉莉酸(JA)、油菜素内酯(BR)和赤霉素(GA)等激素信号均可响应Cu胁迫,其中与ABA合成相关的基因表达水平主要表现为下调,其他激素相关基因表达水平主要表现为上调。ABA可通过调节气孔闭合来影响植物对有害金属的吸收及转运[126];另外,在Cu、Hg和Cd等重金属富集条件下,ABA合成基因(PYLs, PP2Cs, SnRK2)表达上调,内源ABA水平提高,继而提高植物的抗氧化酶(CAT、SOD和POD)活性,增加受胁迫组织中Pro含量,增强植物重金属耐性[47, 126–127]。有报道称 Cu 可诱导菜豆、水稻、拟南芥[128–130]体内茉莉酸(JA)产生,JA通过在细胞水平上增强MTs、PCs和GSH的合成,在植物耐受Cu胁迫中发挥重要作用。相应地,外源添加某些植物激素可改善植物的重金属耐性。大量研究证明外源IAA、GA、BR和水杨酸(SA)可通过增强光合作用,抗氧化系统、调节信号转导等途径来介导植物对重金属的耐受机制[131–134]。可见参与铜胁迫响应的植物激素较多,它们通过什么途径产生,通过何种途径来响应铜刺激,并且不同激素联合调控植株抗铜性的网络机制是什么,这些问题还有待进一步研究。
3.2.6 细胞自噬 细胞自噬(autophagy)是一种细胞内自我降解途径,参与植物细胞中营养物质循环、生长发育、生物及非生物胁迫响应等过程[135]。Zhou等[39]采用包括Cu在内的5种不同的重金属(Cu、Ni、Zn、Cd和Mn)处理烟草幼苗,发现18个自噬基因ATGs(autophagy-related genes)至少受其中一种重金属调控,且表达量是对照组的2倍以上。其中11个ATGs在这5种重金属胁迫中呈上调表达趋势,但这些重金属如何调节自噬途径仍需进一步研究。Shangguan等[41]首次利用生物信息学技术鉴定出葡萄基因组中的35个自噬相关基因(ARGs),发现几乎所有VvARGs表达在Cu胁迫下受诱导。其中大多数VvARGs在Cu胁迫4 h时快速响应,因而可能在Cu耐受性中起关键作用。并且,CuSO4处理4 h后葡萄叶片自噬小体数量和MDA含量均升高,并在24 h达到峰值,推测自噬响应网络可能参与了葡萄对Cu胁迫的应答。有趣的是,植物细胞中多种细胞器都具有其特异的自噬过程,包括过氧化物酶体自噬、线粒体自噬、内质网自噬和核糖体自噬等。而这些细胞器均是产生ROS的主要部位,暗示ROS在细胞器自噬中起关键调控作用,其中具体的分子机制需要进一步探究[136]。
3.2.7 表观遗传机制 表观遗传修饰机制,如DNA甲基化和miRNA干扰等是植物用于适应生物和非生物胁迫的调控手段[30]。
重金属胁迫能使植物的DNA甲基化发生变化,从而导致转座子和基因的表达发生改变[137]。随着Cu2+处理浓度(0.25、1.0和3.0 mg/L)的增大,拟南芥幼苗基因组甲基化多态性呈增高趋势[138]。Shi 等[139]发现过量的Cu诱导水生黑藻4种DNA甲基化相关蛋白的高表达,显著改变其DNA甲基化模式,而且他们认为DNA去甲基化模式改变的原因可能部分归结于ROS诱导的DNA损伤。
MicroRNA具有调节植物生理生化进程、信号传导、响应生物和非生物胁迫等功能[140]。miR398通过负调控靶基因CSD的表达,调节植物体内铜代谢的平衡,响应各种非生物胁迫和生物胁迫等,在多种逆境胁迫响应中扮演重要角色[36]。在高浓度Cd、Al和Cu等重金属胁迫下,miR319与其靶基因TCP因子的表达量均会发生改变[37]。转录因子SPL7在miRNA响应Cu缺乏或过量时维持植物体内铜稳态过程中发挥重要作用。缺Cu会促进SPL7表达,SPL7通过结合在Cu胁迫响应miRNA基因(如miR397a、miR398b/c和miR857)以及Cu转运蛋白基因(COPT1、COPT2和COPT6)启动子的GATC顺式作用元件上,诱导它们表达并抑制miRNA靶基因转录,从而提高植物对Cu离子的吸收及转运;相反,Cu过量时将导致SPL7失活,可能是通过与特定的Cu-复合物相互作用结合Cu,从而导致SPL7无法结合靶基因启动子中的GTAC基序,因而降低了受SPL7转录激活的miRNA及Cu转运蛋白基因的表达量,抑制植物对Cu离子的吸收,从而提高植物的耐铜性[38]。
4 总结与展望
到目前为止,关于植物体内Cu稳态和解毒方面的研究取得了较大进展,人们对植物响应铜胁迫的机制也有了进一步了解。铜胁迫条件下,植物可以通过根系分泌物具有的理化性质、根系的吸收及固定过程来减少细胞对铜离子的吸收,一旦大量铜离子进入细胞内,与金属离子有高亲和性的硫醇化合物(PCs、MTs和GSH)便会与之结合,减弱铜离子的毒害作用,并且抗氧化系统也会被激活来清除ROS以维持细胞内稳态。另外,植物也可自发调节渗透作用,诱导热激蛋白及相关植物激素合成,细胞自噬及表观遗传机制来响应铜胁迫,维持植物正常生长过程。但是仍有一些方面尚不清楚或很少进行研究。例如,铜离子的吸收、转运和螯合过程与植株的生长发育及环境调节途径密切相关,这些途径如何共同影响铜胁迫下植株表型还需要进一步研究;关于自噬和表观遗传机制调控植物响应铜胁迫过程的研究主要分析了铜胁迫下相关响应基因表达水平的变化,而具体的调控机制尚不明确;植物激素在一定程度上可缓解Cu毒害,但它们响应铜胁迫的分子调控网络尚不清楚,且植物的耐受性与喷施激素的浓度、时间和种类等因素之间存在一定相关性,还需大量研究进行验证。另外,大部分关于铜稳态调节的研究进展都是在植物缺乏铜的情况下取得的,关于铜过量条件下的研究较少,而且对植物生长发育产生危害的铜浓度临界值还没有明确定论。近年来,针对土壤重金属污染这一世界性问题,低污染的植物修复技术受到广泛关注。科学家利用铜胁迫下植株表型特征及组学数据进行富集植物的筛选及富集机理的挖掘,在解决土壤铜污染及改善植物抗铜性等方面发挥重要作用。但值得注意的是,单一的植物修复具有局限性,用于植物修复的超积累植物大部分植株矮小、生长缓慢,修复时间较长,且植物挥发作用使可挥发性重金属 (Hg、Se等) 排到大气中,对环境和人类均会造成危害,故需要进一步加强机理研究。因此,需要考虑植物修复、化学修复和栽培管理等多种技术相结合,以实现对土壤重金属污染修复的最大效果。
因此,今后可以从以上几个方面深入研究,并结合转录组、代谢组和蛋白组学等多组学技术完善植物在铜胁迫下的调控网络机制研究,加强对植物响应铜胁迫分子机制的认识以及推进植物耐铜性研究,以便将基础研究转化为生产技术,为农业上指导平衡施肥提供一定的参考并且进一步改善土壤铜污染严重的现状。
