蛇足石杉HsCAO2基因的克隆、生物信息学分析及载体构建
2021-12-04刘爱佳陈晓英闫志刚冯世鑫张占江缪剑华
刘爱佳,陈晓英,李 翠,闫志刚,冯世鑫,张占江,雷 明,缪剑华*
蛇足石杉基因的克隆、生物信息学分析及载体构建
刘爱佳1, 2,陈晓英1, 3,李 翠1, 3,闫志刚4,冯世鑫4,张占江4,雷 明1,3*,缪剑华1, 3*
1. 广西壮族自治区药用植物园 广西药用资源保护与遗传改良重点实验室,广西 南宁 530023 2. 广西中医药大学药学院,广西 南宁 530200 3. 广西壮族自治区药用植物园 广西壮族自治区中药资源智慧创制工程研究中心, 广西 南宁 530023 4. 广西壮族自治区药用植物园,广西 南宁 530023
为筛选高活性的蛇足石杉铜胺氧化酶(copper-containing amine oxidase,CAO),通过生物工程方法实现石杉碱甲(huperzine A,HupA)的合成、为加快新药创制进度提供理论依据。基于蛇足石杉转录组测序得到的序列片段,利用cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE)技术,扩增、拼接并验证获得该基因的全长cDNA序列,并将其命名为。通过RACE技术得到的cDNA全长为2696 bp,CDS为2199 bp,编码732个氨基酸。氨基酸序列同源性比对发现,HsCAO2具有保守的氨基酸位点和Cu2+结合位点;进化树分析结果表明,HsCAO2与蛇足石杉中的另一个CAO(HsCAO1)同源性最高,达91.67%;蛋白质结构分析结果表明,HsCAO2也可能在生物体里以同源二聚体的形式存在。在此基础上,进一步分别构建了超表达载体pOX-和体外蛋白表达载体pET-28a(+)-HsCAO2。HsCAO2很可能是蛇足石杉中的一个新的功能性CAO,且超表达载体和体外蛋白表达载体的成功构建为进一步研究其功能奠定了基础。
蛇足石杉;石杉碱甲;铜胺氧化酶;基因克隆;载体构建
蛇足石杉(Thunb. ex Murray) Trev.又名千层塔,为石杉科多年生草本蕨类植物。20世纪80年代,Liu等[1]报道从蛇足石杉中提取到的一种生物碱——石杉碱甲(huperzine A,HupA)。后续研究表明,HupA是一种强效、可逆的乙酰胆碱酯酶的抑制剂,并已应用于治疗阿尔茨海默症(Alzheimer’s disease,AD)。进一步研究发现,HupA还可减轻肝缺血再关注损伤[2]、抑制癫痫发作[3]、减轻急性心肌梗死引起的损伤[4]、减轻新生儿缺氧缺血后的认知障碍和脑损伤[5]。除此之外,有最新研究表明,HupA还能显著增强胰岛素神经元信号通路活性,改善2型糖尿病的一些相关认知功能障碍[6]。由此可以看出,HupA具有广泛的应用前景。
除了蛇足石杉,目前已知HupA只存在于其他少部分石杉属Bemhardi和马尾杉属L.植物中[7-9]。这些植物在自然环境中主要靠孢子繁殖,但生长缓慢,且孢子萌发和配子体受精有一定的困难性,再加上人们长期无节制的采挖,使得这些资源尤其是蛇足石杉已濒临灭绝[10]。为解决资源短缺问题,加快新药研发进度,国内外在石杉属植物的组织培养、HupA的化学合成等方面做了很多有意义的工作[11-19],但实现HupA的量化生产之路依旧困难重重。
解析蛇足石杉HupA的生物合成通路,利用生物工程方法在细菌或酵母中实现HupA的批量生产,是保护野生蛇足石杉资源、加快新药创制速度的另一条思路。此类方法已有多个成功的案例报道。Ro等[20-21]小组在酿酒酵母中组装了一条高效合成青蒿酸的代谢途径,使最终的青蒿酸产量提高了500倍。根据同位素示踪等实验结果,绘制了一条HupA生物合成通路图,推测其生物合成可能是从赖氨酸脱羧生成尸碱开始,再经过铜胺氧化酶(copper-containing amine oxidase,CAO)氧化去氨基形成哌啶后形成HupA前体物质,再经过一系列的修饰,最终生成HupA[22-24]。这其中,CAO是关键酶之一。
截至目前,仅有2篇关于蛇足石杉CAO的报道。2012年,Sun等[25]报道从蛇足石杉中克隆到一个基因。利用pET22b(+)载体,Sun等[25]成功实现了该蛋白的体外表达,并将其与不同的底物孵育,发现该蛋白具有催化尸胺合成哌啶的功能。最近,Peng等[26]基于转录组测序结果注释到3条CAO unigenes,但文中未公布其序列,也并未对这些unigenes进行鉴定及cDNA全长的克隆。
本研究基于二代转录组测序数据,结合cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE)技术获得了一个基因的cDNA全长,并将其命名为。在此基础上,对该基因及其编码的蛋白序列进行了各种生物信息学分析,并成功构建了超表达载体pOX-和蛋白体外表达载体pET-28a(+)-,为后续进一步鉴定HsCAO2的生物学功能以及优选CAO用于HupA在酵母或其他菌体中的人工生物合成提供重要理论依据。
1 材料与试剂
1.1 植物材料
实验材料由广西壮族自治区药用植物园重点实验室保存,经广西壮族自治区药用植物园闫志刚主任技师、冯世鑫副研究员鉴定为蛇足石杉(Thunb. ex Murray) Trev.。
1.2 试剂与药品
rTaq、大肠杆菌DH5α化学感受态细胞、Phanta Max Super-Fidelity DNA Polymerase、5 minTMTA/Blunt-Zero Cloning Kit、FastPure Gel DNA Extraction Mini Kit、FastPure Plasmid Mini Kit购于诺唯赞生物科技股份有限公司(南京,中国);KOD-Plus-Neo酶购于TOYOBO公司(东京,日本);T4 连接酶、TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix、限制性内切酶R I、I和I购于全式金生物技术有限公司(北京,中国);SMART RACE 5’/3’ Kit购于Takara公司(东京,日本);Quick-Start Protocol RNeasy Plant Mini Kit购于QIAGEN公司(杜塞尔多夫,德国);植物表达载体pOX、体外蛋白表达载体pET-28a(+)保存于本实验室。引物合成单位是广州天一辉远基因科技有限公司。
2 方法
2.1 蛇足石杉全样cDNA的获取
采用Quick-Start Protocol RNeasy Plant Mini Kit提取蛇足石杉全样的总RNA,RACE模板cDNA的合成方法详见SMART RACE 5’/3’ Kit试剂盒(Takara公司)。PCR模板cDNA的反转录方法详见TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒说明书。
2.2 HsCAO2基因的克隆
基于蛇足石杉转录组数据,筛选到一个基因片段。依据该序列设计RACE引物。用于扩增3’-RACE的引物为HsCAO2-3,用于扩增5’-RACE的引物为HsCAO2-5。
将扩增的RACE片段纯化后连接到Blunt-zero载体、转化DH5α感受态细胞。待LB+卡那霉素平板上长出大小合适的菌落后,挑取若干白斑于LB+卡那霉素的培养基中过夜培养。沾取适量菌液,用通用引物M13R和M13F进行PCR验证后,将扩增出目的条带的菌液送广州天一辉远公司测序。
2.3 HsCAO 1生物信息学分析
利用在线软件ORFfinder(https://www. ncbi.nlm.nih.gov/orffinder)、Conserved domains(https://www. ncbi.nlm. nih.gov/Structure/cdd/ wrpsb. cgi)和Blast(https://blast.ncbi.nlm.nih. gov/Blast.cgi)查找HsCAO2的开放阅读框、保守结构域和同源序列;利用MEGA6.0软件构建HsCAO2蛋白的进化树;利用DNAMAN软件进行氨基酸序列同源性比对;利用在线软件PSIPRED(http://bioinf.cs.ucl.ac. uk/ psipred/psiform. html)对HsCAO2蛋白进行二级结构分析;利用在线软件SWISS-MODEL(https:// swissmodel.expasy.org/)对HsCAO2蛋白的三级结构进行分析。
2.4 pOX-HsCAO2和pET-28a(+)-HsCAO2载体的构建
根据的CDS序列,设计pOX-的构建引物-SEN-I与- ANTI-I和pET-28a(+)-的构建引物-SEN-RI与-ANTI-I(表1)。PCR扩增目的基因。目的片段与Blunt-zero载体连接后转化到DH5α化学感受态细胞中。经广州天一辉远公司测序正确后,提取Blunt-zero-质粒,并使用相应的限制性内切酶分别对测序正确的质粒和pOX、pET-28a(+)载体进行酶切。目的片段先纯化,随后用T4 DNA连接酶连接,转化到DH5α化学感受态细胞中。通过菌落PCR和酶切验证阳性克隆。
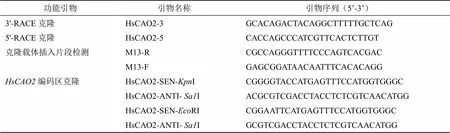
表1 所用的引物
3 结果与分析
3.1 HsCAO2 cDNA全长的克隆与序列分析
依据转录组数据分析得到的一个基因片段设计RACE扩增引物(表1),得到了基因序列的5'端和3'端序列(图1-A和B),并由此克隆到了2697 bp的全长cDNA序列。经分析,该序列有2199 bp的CDS序列,推测其编码732个氨基酸。
3.2 HsCAO2结构域、同源性比对、系统进化树和蛋白结构的分析
将HsCAO2与从NCBI中筛选到的同源性较高的几个物种的CAOs进行氨基酸序列同源性比对,结果显示HsCAO2与蛇足石杉中的另一个CAO(HsCAO1)的同源性最高,达91.67%(图2)。与其他功能性的CAOs序列相似,HsCAO2也含有保守共识序列Asn-Tyr-Asp/Glu、保守的铜离子结合位点以及对活化中心起关键作用的4个氨基酸残基酪氨酸(tyrosine,Tyr)、以及赖氨酸(lysine,Lys)、Asp和Asn(图2)。为进一步预测HsCAO2的进化关系,使用MEGA6.0构建了HsCAO2与其他多个物种中CAOs的进化树,结果表明HsCAO2与HsCAO1的亲缘关系最近(图3)。
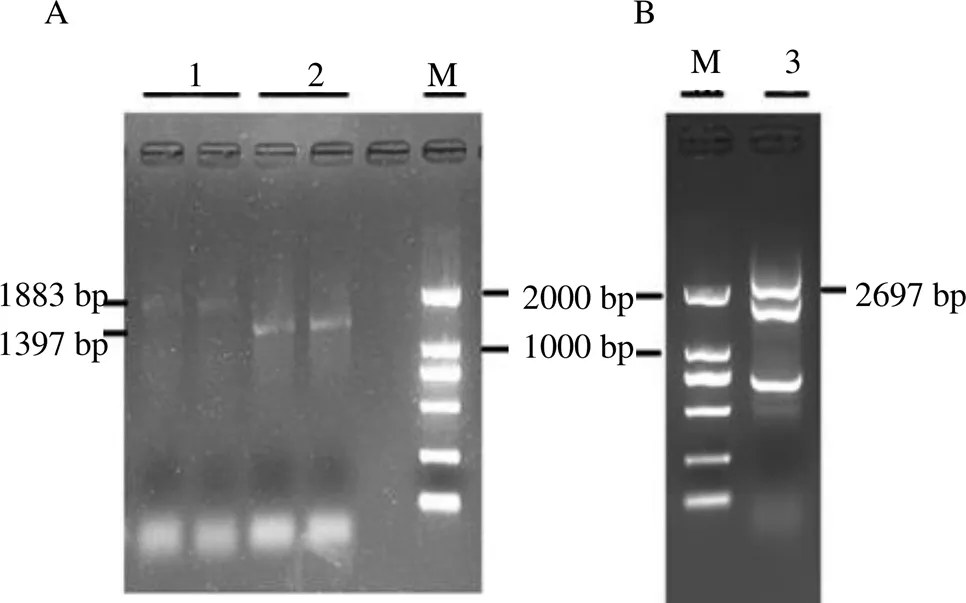
M-Marker 1-5’-RACE PCR 2-3’-RACE PCR 3-HsCAO2 cDNA全长验证
HsCAO2蛋白的二级结构分析结果表明,其二级结构合理,含有少部分α-螺旋和β-折叠,大部分为无规则卷曲,且整个序列中无信号肽、胞外酶、凹角螺旋等结构(图4)。以PSAO and Xenon copper-containing amine oxidase(1W2Z_A)为模板,构建了HsCAO2蛋白的三级结构。结果如图5所示,HsCAO2蛋白在体内可能以同源二聚体的形式存在并发挥催化功能。

CAO保守共识序列用横线表示,铜离子结合位点用*表示,对活化中心起关键作用的4个氨基酸残基用#表示;HsCAO1- Huperzia serrata CAO1,AER93284.1 AtCAO- Arabidopsis thaliana CAO,AAB87690.1 LcCAO- Lens culinaris CAO,AAB34918.3 LsCAO- Lathyrus sativus CAO,ALE71304.1 PsCAO- Pisum sativum CAO,BAA77206.1
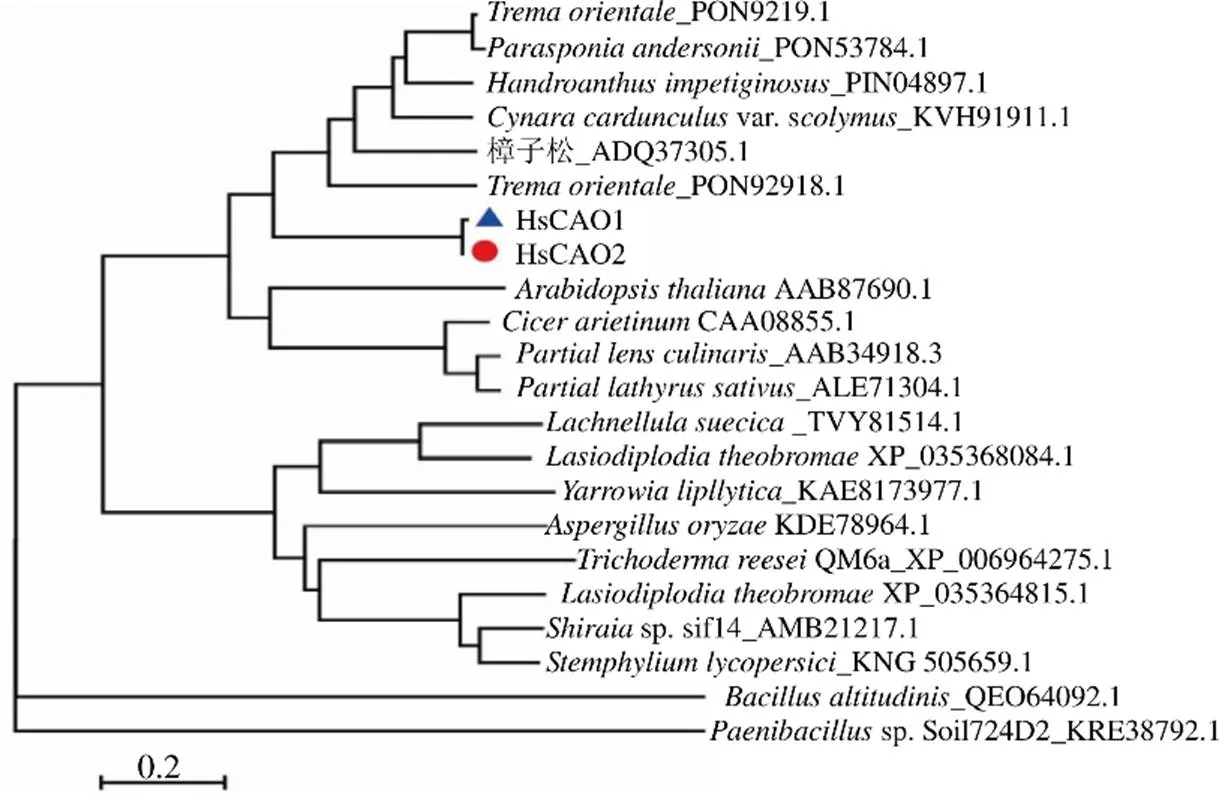
图3 HsCAO2的分子进化树
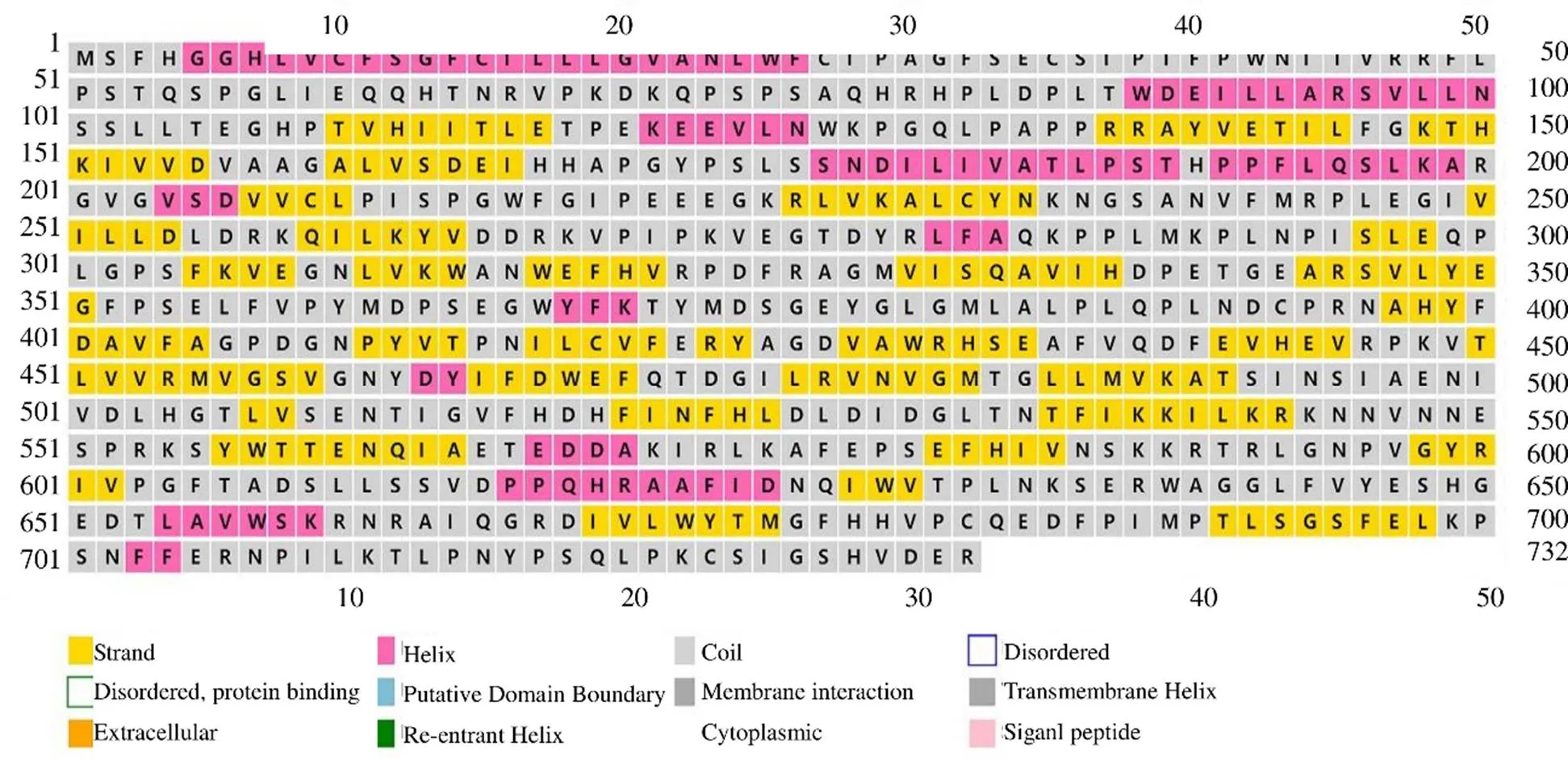
图4 预测的HsCAO2蛋白二级结构
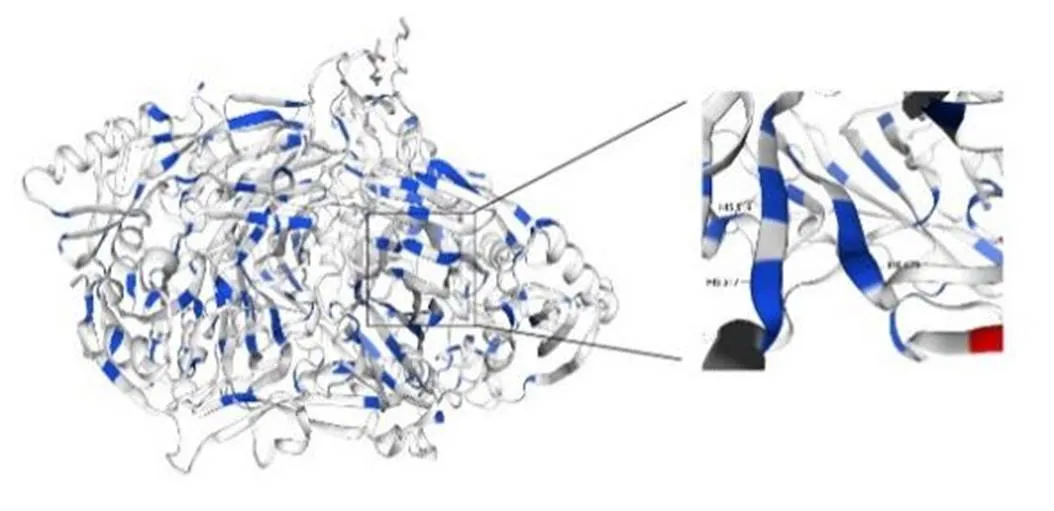
图5 预测的HsCAO2蛋白三级结构和放大部分中的3个组氨酸残基为保守的Cu2+结合位点
3.3 HsCAO2表达载体的构建
pOX-重组载体构建过程如图6所示,在两端引入I和I酶切位点,得到含I和I酶切位点的基因,连接Blunt-zero克隆载体,得到Blunt-zero-。用I和I进行双酶切(图7-A),大小为2199 bp左右的片段为目的片段,回收后与同样用I和I进行酶切的pOX载体用T4 DNA连接酶连接,对重组质粒进行菌液PCR验证(图7-B)和酶切验证(图7-C),获得预期大小为2199 bp左右的目的片段,证明植物表达载体pOX-构建成功。同理如图6所示构建pET-28a(+)-载体,构建过程中RI和I酶切Blunt-zero-(图7-D)、菌液PCR验证(图7-E)和酶切验证(图7-F)所得到的目的片段大小均为2199 bp左右,证明pET-28a(+)-载体构建成功。

图6 pOX -HsCAO2和pET-28a(+)-HsCAO2重组载体构建过程示意图
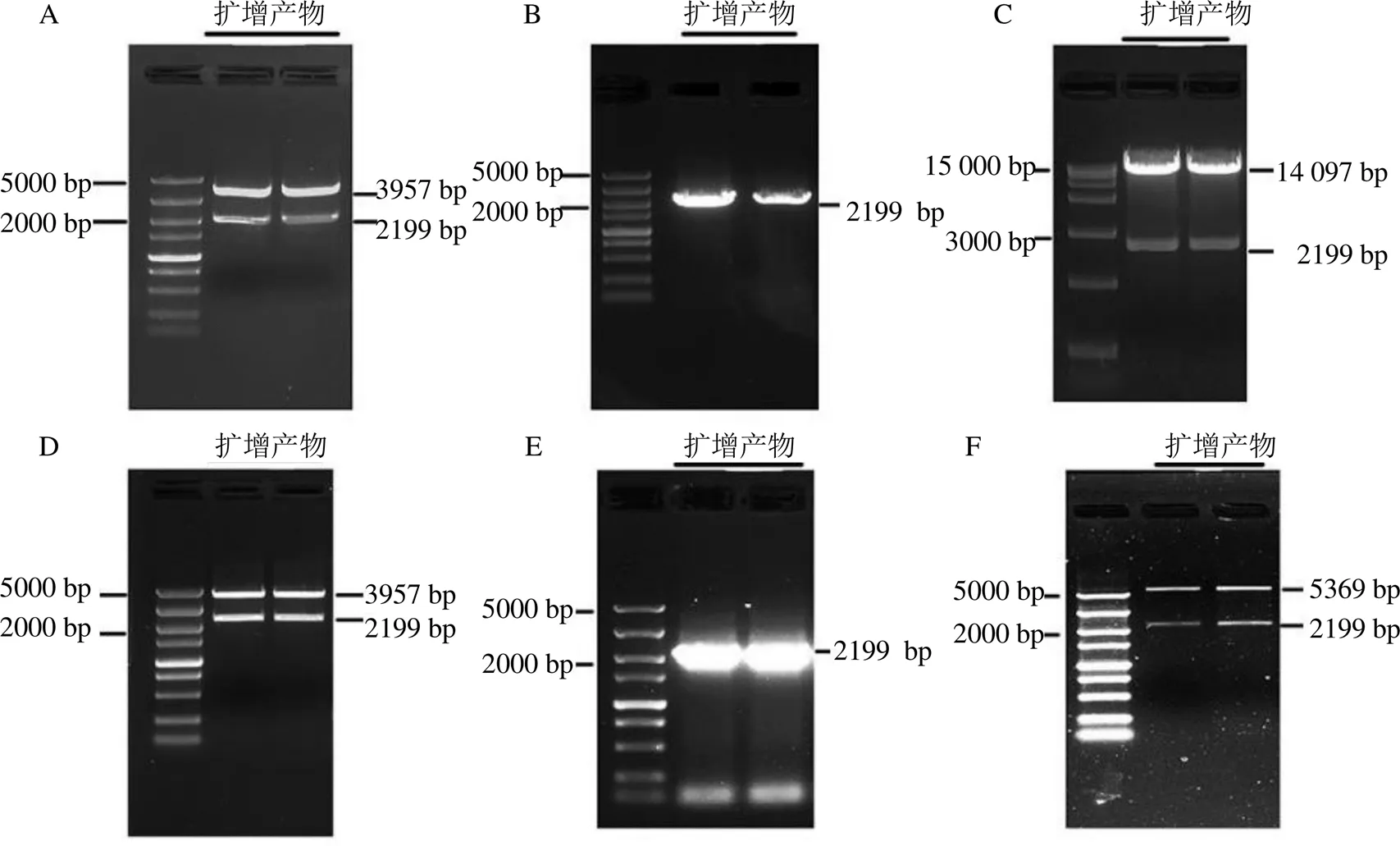
A-含KpnI和Sa1I酶切位点的Blunt-zero-HsCAO2克隆载体的双酶切琼脂糖凝胶电泳图 B-pOX-HsCAO2克隆PCR验证电泳图 C-pOX-HsCAO2双酶切验证电泳图 D-含EcoRI和Sal I酶切位点Blunt-zero-HsCAO2克隆载体的双酶切琼脂糖凝胶电泳图 E-pET-28a(+)-HsCAO2克隆PCR验证电泳图 F-pET-28a(+)-HsCAO2双酶切验证电泳图
3 讨论
为适应生境、吸引昆虫传粉或对抗病原体和草食动物,植物会在体内合成各种各样的防御化合物[27-28]。生物碱是植物体内最重要的防御化合物之一,大约20%的植物均能合成生物碱。在目前已发现的约12 000种生物碱中,很多都具有潜在的药理活性,且一些已被开发为广泛使用的药物[29]。生物碱一般由以苯丙氨酸(phenylalanine,Phe)、Tyr、色氨酸(tryptophan,Trp)、鸟氨酸(ornithine,Orn)以及Lys等氨基酸为前体的初生代谢物进一步合成而来[30]。
HupA属于石松生物碱(lycopodium alkaloids),同位素示踪实验结果表明,HupA生物合成通路的第一步是以L-赖氨酸为底物,经过赖氨酸脱羧酶(lysine decarboxylase,LDC)催化合成尸胺(xadaverine)[22-23]。尸胺在铜胺氧化酶的作用下被催化成哌啶(piperideine),然后再经过多步未知的途径,最后合成HupA[22, 24]。这其中,CAO是限速酶,且其催化底物尸胺是一种非常重要的中间产物,因为它也是喹嗪类生物碱(quinolizidine alkaloids,QAs)以及具有哌啶环和吡啶(pyridine)环生物碱如胡椒碱(piperine)、山梗菜碱(lobeline)等重要生物碱的共有合成前体[31]。
CAO广泛存在于细菌、酵母、植物、真菌、动物等好氧生物中[32]。CAO的生物学功能非常广泛,不同物种间的CAO氨基酸同源性只有20%~40%,但它们几乎都具有2个非常保守的活性位点—2,4,5-三羟基苯丙氨酸醌(2,4,5-trihydroxyphenylalanine quinone,TPQ)辅因子结合位点以及二价铜离子结合位点[33]。本研究中,HsCAO2的氨基酸序列在这些活性位点处也高度保守(图2)。此外,与其他生物体中的CAOs类似,HsCAO2在植物体内也可能是以同源二聚体的形式存在并发挥催化功能的(图5)。进一步的进化树分析结果发现,HsCAO2与蛇足石杉中另一个可以催化尸胺合成哌啶的HsCAO1亲缘关系很近(图3)。这些结果表明,HsCAO2可能也是蛇足石杉中另一个功能性的CAO。
很多物种中都存在多个CAOs。比如,拟南芥中有10个CAOs,但它们参与的生物学过程既有不同之处,也有冗余性[34-35]。为了进一步研究HsCAO2的功能,本研究成功构建了HsCAO2的超表达载体pOX和体外蛋白表达载体pET-28a(+)(图6、7)。后续将通过转基因和蛋白酶-底物体外孵育实验来进一步验证HsCAO2的生物学功能。此外,HsCAO2与HsCAO1以及HupA的时空表达模式的关联性分析,也将为进一步明晰不同的CAOs在HupA生物合成通路中的功能和分工奠定理论基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Liu J S, Zhu Y L, Yu C M,. The structures of huperzine A and B, two new alkaloids exhibiting marked anticholinesterase activity [J]., 1986, 64(4): 837-839.
[2] Xu Z, Wang Y. Huperzine A attenuates hepatic ischemia reperfusion injury via anti-oxidative and anti-apoptotic pathways [J]., 2014, 10(2): 701-706.
[3] Damar U, Gersner R, Johnstone J T,. Huperzine A as a neuroprotective and antiepileptic drug: A review of preclinical research [J]., 2016, 16(6): 671-680.
[4] Sui X Z, Gao C Q. Huperzine A ameliorates damage induced by acute myocardial infarction in rats through antioxidant, anti-apoptotic and anti-inflammatory mechanisms [J]., 2014, 33(1): 227-233.
[5] Wang L S, Zhou J, Shao X M,. Huperzine A attenuates cognitive deficits and brain injury in neonatal rats after hypoxia-ischemia [J]., 2002, 949(1/2): 162-170.
[6] Wang H Y, Wu M, Diao J L,. Huperzine A ameliorates obesity-related cognitive performance impairments involving neuronal insulin signaling pathway in mice [J]., 2020, 41(2): 145-153.
[7] Ma X Q, Jiang S H, Zhu D Y. Alkaloid patterns inand some related genera of Lycopodiaceae Sensu Lato occurring in China and their contribution to classification [J]., 1998, 26(7): 723-728.
[8] Ma X Q, Tan C H, Zhu D Y,. A survey of potential huperzine A natural resources in China: The Huperziaceae [J]., 2006, 104(1/2): 54-67.
[9] Ma X, Tan C, Zhu D,. Huperzine A fromspecies: An ethnopharmacolgical review [J]., 2007, 113(1): 15-34.
[10] 龙华, 李菁, 李鹂, 等. 蛇足石杉扦插及芽胞繁殖研究 [J]. 中药材, 2014, 37(7): 1115-1121.
[11] Ma X, Gang D R.production of huperzine A, a promising drug candidate for Alzheimer's disease [J]., 2008, 69: 2022-2028.
[12] Ishiuchi K, Park J J, Long R M,. Production of huperzine A and otherinspecies grown under controlled conditions and[J]., 2013, 91: 208-219.
[13] Zhao X M, Wang Z Q, Shu S H,. Ethanol and methanol can improve huperzine A production from endophyticES026 [J]., 2013, 8(4): e61777.
[14] Shu S H, Zhao X M, Wang W J,. Identification of a novel endophytic fungus fromwhich produces huperzine A [J]., 2014, 30(12): 3101-3109.
[15] Yan R M, Zhang Z B, Wang Y,. Efficient strategy for maintaining and enhancing the huperzine A production ofsp. Slf14 through inducer elicitation [J]., 2014, 41(7): 1175-1179.
[16] Ying Y M, Shan W G, Zhan Z J. Biotransformation of huperzine A by a fungal endophyte offurnished sesquiterpenoid-alkaloid hybrids [J]., 2014, 77(9): 2054-2059.
[17] Thi Minh Le T, Thi Hong Hoang A, Thi Bich Le T,. Isolation of endophytic fungi and screening of Huperzine A-producing fungus fromin Vietnam [J]., 2019, 9(1): 16152.
[18] Cruz-Miranda O L, Folch-Mallol J, Martínez-Morales F,. Identification of a Huperzine A-producing endophytic fungus from[J]., 2020, 47(1): 489-495.
[19] Xu B F, Fan Z, Lei Y X,. Insights into pipecolic acid biosynthesis in[J]., 2018, 20(8): 2195-2198.
[20] Ro D K, Paradise E M, Ouellet M,. Production of the antimalarial drug precursor artemisinic acid in engineered yeast [J]., 2006, 440(7086): 940-943.
[21] Ro D K, Ouellet M, Paradise E M,. Induction of multiple pleiotropic drug resistance genes in yeast engineered to produce an increased level of anti-malarial drug precursor, artemisinic acid [J]., 2008, 8: 83.
[22] Ma X Q, Gang D R. The[J]., 2004, 21(6): 752-772.
[23] Gerdes H J, Leistner E. Stereochemistry of reactions catalysed by l-lysine decarboxylase and diamine oxidase [J]., 1979, 18(5): 771-775.
[24] Xu B F, Lei L, Zhu X C,. Identification and characterization of-lysine decarboxylase fromand its role in the metabolic pathway ofalkaloid [J]., 2017, 136: 23-30.
[25] Sun J Y, Morita H, Chen G S,. Molecular cloning and characterization of copper amine oxidase from[J]., 2012, 22(18): 5784-5790.
[26] Peng Q Z, Long H, Du C,. RNA-seq of aboveground sporophyte's transcriptome ofand transcriptional understanding of early steps associated with huperzine biosynthesis in forest [J]., 2020, 24: 100159.
[27] Pichersky E, Lewinsohn E. Convergent evolution in plant specialized metabolism [J]., 2011, 62: 549-566.
[28] Pichersky E, Gang D R. Genetics and biochemistry of secondary metabolites in plants: An evolutionary perspective [J]., 2000, 5(10): 439-445.
[29] De Luca V, St Pierre B. The cell and developmental biology of alkaloid biosynthesis [J]., 2000, 5(4): 168-173.
[30] Facchini P J. ALKALOID BIOSYNTHESIS IN PLANTS: Biochemistry, cell biology, molecular regulation, and metabolic engineering applications [J]., 2001, 52: 29-66.
[31] Leistner E, Spenser I D. Biosynthesis of the piperidine nucleus. Incorporation of chirally labeled (1-3)cadaverine [J]., 1973, 95(14): 4715-4725.
[32] Klema V J, Solheid C J, Klinman J P,. Structural analysis of aliphatic versus aromatic substrate specificity in a copper amine oxidase from[J]., 2013, 52(13): 2291-2301.
[33] Chang C M, Klema V J, Johnson B J,. Kinetic and structural analysis of substrate specificity in two copper amine oxidases from[J]., 2010, 49(11): 2540-2550.
[34] Alharbi B, Hunt J D, Dimitrova S,. Mutation ofcopper-containing amine oxidase genealters polyamines, reduces gibberellin content and affects development [J]., 2020, 21(20): E7789.
[35] Groß F, Rudolf E E, Thiele B,. Copper amine oxidase 8 regulates arginine-dependent nitric oxide production in[J]., 2017, 68(9): 2149-2162.
Cloning, bioinformatics analysis and expression vector construction offrom
LIU Ai-jia1, 2, CHEN Xiao-ying1, 3, LI Cui1, 3, YAN Zhi-gang4, FENG Shi-xin4, ZHANG Zhan-jiang4, LEI Ming1, 3, MIAO Jian-hua1, 3
1. Guangxi Key Laboratory of Medicinal Resources Protection and Genetic Improvement, Guangxi Botanical Garden of Medicinal Plants, Nanning 530023, China 2. School of Pharmacy, Guangxi University of Chinese Medicine, Nanning 530200, China 3. Guangxi Engineering Research Center of TCM Resource Intelligent Creation, Guangxi Botanical Garden of Medicinal Plants, Nanning 530023, China 4. Guangxi Botanical Garden of Medicinal Plants, Nanning 530023, China
To screen copper-containing amine oxidase (CAO) with high activity from, reinforce the synthesis of huperzine A (HupA) by bioengineering method, so as to provide the theoretical basis for the progress of new drug development.Based on RNA-seq data and rapid amplification of cDNA ends (RACE) technology, agene namedwas identified from.The full length ofcDNA and coding sequence (CDS) was 2696 and 2199 bp, respectively, encoding a 732-amino acids deduced protein. Sequence alignment results indicated HsCAO2 contained both conserved domains and Cu2+binding sites. Phylogenetic analysis showed that HsCAO2 shared the highest similarity (91.67%) with HsCAO1, another CAO verified in. The secondary and 3-D structures of HsCAO2 simulated by online softwares indicated that HsCAO2 might exist as homodimers in. Furthermore, the overexpression vector pOX-andprotein expression vector pET-28a(+)-were constructed.HsCAO2 might be a new functional CAO which has not been reported before in. The successful construction of the overexpression vector andprotein expression vector lays a foundation for further study of its biological function.
(Thunb. ex Murray) Trev.; huperzine A; copper-containing amine oxidase; gene identification; vector construction
R286.12
A
0253 - 2670(2021)23 - 7309 - 08
10.7501/j.issn.0253-2670.2021.23.025
2021-05-03
国家中药材产业技术体系(CARS-21);对发展中国家科技援助项目(KY201904001);广西创新驱动发展专项资金项目(桂科AA18242040);广西壮族自治区药用植物园基金(桂药基202002)
刘爱佳(1995—),硕士研究生,主要从事药用植物资源研究。Tel: (0771)3132106 E-mail:1435145742@qq.com
缪剑华(1961—),研究员,主要从事药用植物保育学研究。Tel: (0771)2443020 E-mail: mjh1962@vip.163.com
雷 明(1982—),副研究员,主要从事药用植物资源研究。Tel: (0771)5602850 E-mail: leiming@gxyyzwy.com
[责任编辑 时圣明]
