冬凌草中1个新的对映-贝壳杉烷二萜
2021-12-04陈春霞吴继洲
刘 旭,陈春霞,吴继洲
•化学成分 •
冬凌草中1个新的对映-贝壳杉烷二萜
刘 旭1, 3,陈春霞2, 3*,吴继洲3
1. 华中科技大学同济医学院附属同济医院 药学部,湖北 武汉 430040 2. 武汉软件工程职业学院,湖北 武汉 430070 3. 华中科技大学同济医学院药学院,湖北 武汉 430040
研究鄂西地区产冬凌草的化学成分。采用多种柱色谱法进行分离纯化,并经波谱分析鉴定化合物的结构。从湖北建始县产冬凌草的乙醇浸提物中,分离鉴定出6个对映-贝壳杉烷二萜,分别为3β,6β,14β,15β-四乙酰氧基-20-醛-对映-贝壳杉-16-烯-7-酮(1)、川藏香茶菜素O(2)、enmenin(3)、enmenin monoacetate(4)、乙酰化毛萼晶F(5)、荛花香茶菜乙素(6)。化合物1为1个新化合物,命名为建始冬凌草素J,为香茶菜属植物极为少见的一类型对映-贝壳杉二萜,结构特点为C-20氧化为醛基而未与C-3、C-7、C-11形成常见的环氧桥结构。化合物2和4为首次从该植物中分离得到。
冬凌草;对映-贝壳杉烷;二萜;建始冬凌草素J;川藏香茶菜素O;荛花香茶菜乙素
冬凌草(Hemsley) H. Hara系唇形科(Labiatae)香茶菜属多年生草本植物,在河南民间用于治疗咽炎、支气管炎等炎症和虫蛇咬伤。1972年被以民间抗癌草药发掘出来,后续研究证实了冬凌草在体外对癌细胞的细胞毒作用,对多种动物移植性肿瘤也有抗肿瘤作用[1],尤其是特征性成分冬凌草甲素(oridonin)更是成为活性与机制研究的明星分子[2-3]。同时国内研究者相继对产自河南、河北、贵州等多个不同县市地区的冬凌草的化学成分研究取得了不同程度的进展,发现其富含结构新颖、多变的对映-贝壳杉类二萜化合物,且结构特点随产地、生境不同有着明显的区别[4-5]。
为全面了解湖北省内冬凌草资源利用的物质基础,从地理生境独特的湖北省恩施州建始县采集了冬凌草样品,以其95%乙醇提取物的醋酸乙酯萃取部位为研究对象,利用柱色谱分离技术及多种波谱手段进行了深入研究,得到6个对映-贝壳杉烷二萜,其中5个已知化合物经NMR数据对比鉴定为川藏香茶菜素O(pharicin O,2)、enmenin(3)、enmenin monoacetate(4)、乙酰化毛萼晶F(acetonide of maoyecrystal F,5)、荛花香茶菜乙素(wikstroenioidin B,6)。1个新化合物利用2D NMR确定了平面和立体结构为3β,6β,14β,15β-四乙酰氧基-20-醛-对映-贝壳杉-16-烯-7-酮(1),命名为建始冬凌草素J(图1)。化合物2和4为首次从该植物中分离得到。
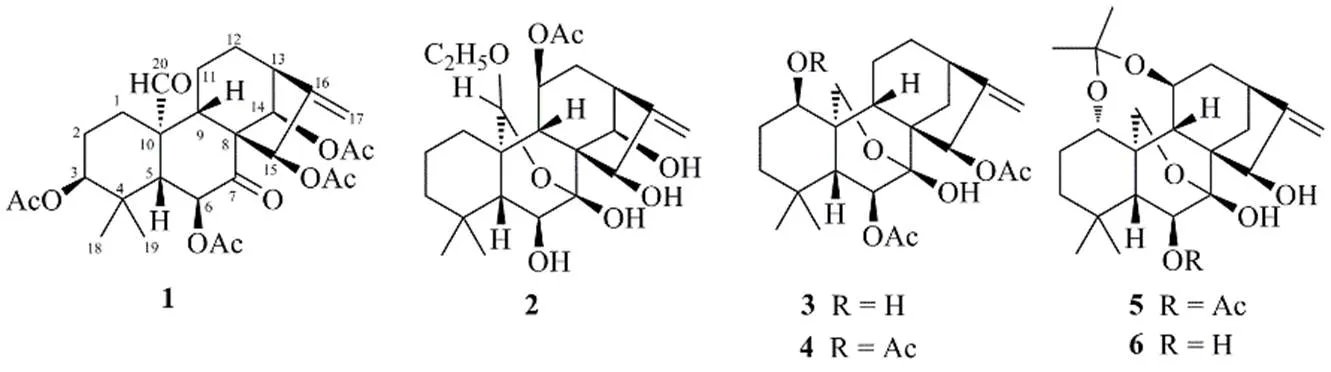
图1 化合物1~6的化学结构
1 仪器与材料
JASCO DIP-370型数字式旋光仪(日本分光株式会社);Shimadzu UV-2401A型紫外光谱仪(日本岛津制作所);Tenor27型红外光谱仪(德国布鲁克光谱仪器公司);ESIMS和HRESIMS用API-QSTAR飞行时间(美国应用系统公司)、Xevo TQ-S三重四级杆(英国沃特世公司)和Bruker HCT/Esquire离子阱质谱仪(德国布鲁克道尔顿公司);DRX-500型核磁共振仪(瑞士布鲁克公司)。半制备型HPLC为Agilent1100 HPLC(DAD检测器,美国安捷伦公司),色谱柱为Zorbax SB-C18(美国安捷伦公司,250 mm×9.4 mm,5 μm,3 mL/min)。反相色谱Lichroprep RP18(40~63 μm,美国Merck公司)。MCI(75~150 μm,日本Mitsubishi化学公司)。薄层硅胶板和柱色谱用正相硅胶(100~200目)均为青岛海洋化工厂生产。色谱纯甲醇(国药集团化学试剂有限公司),其他试剂为分析纯。
实验药材2019年采自湖北省恩施州建始县,经武汉植物园王映明教授鉴定为唇形科为香茶菜属植物冬凌草(Hemsley) H. Hara的干燥地上部分。
2 提取与分离
冬凌草地上部分(干质量10 kg)粉碎后用30 L 95%乙醇在室温下浸泡4次,每次持续3 d。提取液几乎蒸干后,用20 L醋酸乙酯和5 L水分散、萃取4次。得到醋酸乙酯部分(干质量约550 g)用600 g 100~200目硅胶拌样,干法装柱,以不同比例的氯仿-丙酮(1∶0~0∶1)进行梯度洗脱,用薄层色谱进行检测,合并相同组分,除去纯氯仿的部分(主要为油状物)和纯丙酮的部分(主要为黄酮类),得到剩余5个部分A~E。
B部分(120 g)用MCI树脂脱色,以90%甲醇-水洗脱后,用正相硅胶色谱柱,石油醚-丙酮(20∶1~1∶1)梯度洗脱,得到B1~B5。B4(7.6 g)用反相RP-C18柱色谱,甲醇-水(40%~90%)梯度洗脱得到10个组分。B4/8(500 mg)通过半制备反相色谱得到化合物1(7 mg)和4(32 mg)。B4/6(630 mg)用同样的半制备色谱得到化合物2(4.3 mg)。B4/4(920 mg)用正相硅胶色谱柱,以氯仿-丙酮(40∶1~30∶1)梯度洗脱进行纯化得到化合物3(150 mg)。
C部分(120 g)采用同样的方法脱色后,先用正相硅胶柱色谱,以石油醚-丙酮(20∶1~1∶1)梯度洗脱,得到C1~C5。C5(12 g)利用反相柱色谱得到7个组分,其中的C5/3(1.7 g)再次利用正相柱色谱,氯仿-丙酮(20∶1、10∶1、2∶1、1∶1)梯度洗脱得到C5/3/1~C5/3/8。C5/3/2(120 mg)和C5/3/5(90 mg)分别用半制备反相色谱法,以甲醇-水(55%~75%)梯度洗脱,分别得到化合物5(18 mg)和6(15 mg)。
3 结构鉴定

13C谱和DEPT谱给出了除了4个乙酰氧基之外的5个季碳(其中1个酮羰基碳,1个2杂化的双键季碳,3个骨架上的饱和季碳),8个次甲基(其中1个醛基,4个为氧化的次甲基对应4个乙酰氧基取代),5个亚甲基(含1个2杂化的环外亚甲基),2个角甲基,以上结构特征符合对映-贝壳杉烷-16-烯骨架含有环外双键,5、9、13位3个次甲基,4、8、10位3个季碳,18、19、20位3个角甲基的特征(表1)。2D NMR谱中,H-1、H-5、H-9与醛基(C206.9 d)的HMBC相关说明是C-20被氧化为醛基(图2)。另外的偕二甲基[H1.16 (3H, s, CH3-18),H0.90 (3H, s, CH3-19)] 又和其中1个氧化次甲基(C79.3 d)相关,所以确定C-3位为乙酰氧取代,并且符合1H-1H COSY确定的H2-1/H2-2/H-3连续自旋系统。还有H-5/H-6和H-9/H2-11/H2-12/H-13/H-14的1H-1H COSY自旋系统,加上H-6与C-4、C-10,H-14与C-9、C-12的HMBC相关,共同确定了C-6、C-14位的乙酰氧取代。H-15与C-9和C-17的HMBC相关确定了C-15位的乙酰氧取代。而酮羰基与H-5、H-9、H-15的相关将羰基归属于C-7位。H-20与H-6、H-14、H3-19,H-15与H-13α的ROESY相关说明了H-6、H-14、CH3-19和H-15同C-20位醛基一样处于环系的α-取向,H-3与CH3-18、CH3-19之间的NOE效应说明了H-3应该为椅式构象A环的平伏位置,即H-3也为α-取向。图2中,在没有氧桥、A环B环均为椅式构象的情况下,H-6α/H-5β之间偶合常数为13.5 Hz,佐证了二者相反的竖直取向。H-9β/H-5β的NOE效应证实了H-9同样为β-取向。结合香茶菜属植物中发现大量对映-贝壳杉烷二萜的经验[1-4],推断化合物1的绝对构型也应该为对映-贝壳杉烷型,因此新化合物1被确定为C-20位氧化但未成环的对映-贝壳杉烷二萜,即3β,6β,14β,15β-四乙酰氧基-20-醛-对映-贝壳杉-16-烯-7-酮;经Sci-finder检索,为1个新化合物,命名为建始冬凌草素J。
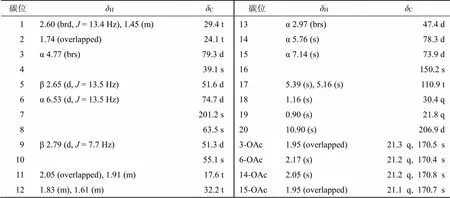
表1 化合物1的核磁共振数据(500/125 MHz,C5D5N)
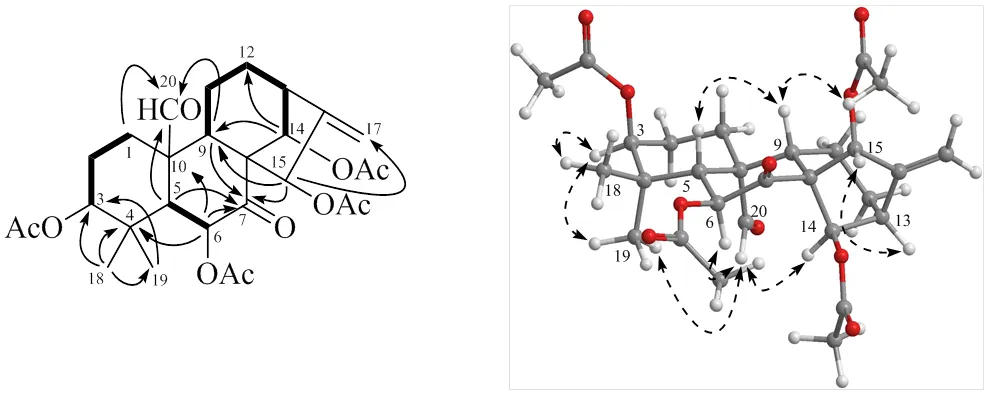
图2 化合物1的关键HMBC相关(HC)、1H-1H COSY相关()和ROESY相关 (HH)
化合物2:白色粉末。1H-NMR (500 MHz, C5D5N): 6.20 (1H, m, H-11α), 5.84 (1H, d,= 2.3 Hz, H-15α), 5.74 (1H, s, H-17a), 5.48 (1H, s, H-20), 5.42 (1H, s, H-17b), 5.39 (1H, s, H-14α), 4.18 (1H, t,= 5.1 Hz, H-6α), 3.97, 3.47 (各1H, m, CH3CH2O-20), 3.23 (1H, d,= 8.4 Hz, H-13α), 3.19 (1H, m, H-12a), 2.92 (1H, d,= 7.7 Hz, H-9β), 2.12 (1H, brd,= 12.4 Hz, H-1a), 2.04 (3H, s, OAc-11), 1.63 (1H, d,= 5.1 Hz, H-5β), 1.11 (3H, t,= 7.0 Hz, CH3CH2O-20), 1.18 (3H, s, H3-18), 1.05 (3H, s, H3-19);13C-NMR (125 MHz, C5D5N): 29.9 (C-1), 19.2 (C-2), 41.8 (C-3), 34.6 (C-4), 58.5 (C-5), 73.9 (C-6), 101.6 (C-7), 54.0 (C-8), 46.9 (C-9), 40.4 (C-10), 68.8 (C-11), 41.7 (C-12), 48.0 (C-13), 77.0 (C-14), 73.4 (C-15), 159.5 (C-16), 110.5 (C-17), 34.1 (C-18), 23.3 (C-19), 102.0 (C-20), 170.7, 22.0 (3-OAc), 64.4, 15.8 (20-OCH2CH3)。以上数据与文献报道基本一致[6],故鉴定化合物2为川藏香茶菜素O。
化合物3:无色针晶(80%甲醇-水)。1H-NMR (500 MHz, C5D5N): 6.23 (1H, s, H-15α), 5.87 (1H, d,= 7.0 Hz, H-6α), 5.22 (1H, s, H-17a), 5.07 (1H, s, H-17b), 4.16 (1H, d,= 9.0 Hz, H-20a), 4.14 (1H, d,= 9.0 Hz, H-20b), 3.71 (1H, brs, H-1α), 2.31 (1H, d,= 7.0 Hz, H-5β), 1.23 (3H, s, H3-18), 1.02 (3H, s, H3-19), 2.15, 2.12 (6H, s, 2×OAc);13C-NMR (125 MHz, C5D5N): 65.3 (C-1), 26.8 (C-2), 34.3 (C-3), 33.8 (C-4), 50.1 (C-5), 75.4 (C-6), 95.7 (C-7), 51.2 (C-8), 38.9 (C-9), 40.9 (C-10), 15.3 (C-11), 31.9 (C-12), 37.0 (C-13), 27.6 (C-14), 75.4 (C-15), 160.0 (C-16), 108.7 (C-17), 33.2 (C-18), 23.6 (C-19), 66.4 (C-20), 171.3, 171.2 (2×OAc), 22.0, 21.4 (2×OAc)。以上数据与文献报道基本一致[7],故鉴定化合物3为enmenin。
化合物4:无色针晶(80%甲醇-水)。1H-NMR (500 MHz, C5D5N): 6.18 (1H, s, H-15α), 5.78 (1H, d,= 6.9 Hz, H-6α), 5.21 (1H, s, H-17a), 5.08 (1H, s, H-17b), 4.80 (1H, brs, H-1α), 4.10 (1H, d,= 9.7 Hz, H-20a), 4.06 (1H, d,= 9.7 Hz, H-20b), 2.85 (1H, dd,= 12.7, 5.3 Hz, H-9β), 1.17 (3H, s, H3-18), 0.96 (3H, s, H3-19), 2.26, 2.11, 2.07 (各3H, s, 3×OAc);13C- NMR (125 MHz, C5D5N): 70.1 (C-1), 23.6 (C-2), 34.6 (C-3), 33.7 (C-4), 50.8 (C-5), 74.6 (C-6), 95.5 (C-7), 51.2 (C-8), 38.8 (C-9), 39.6 (C-10), 15.2 (C-11), 31.5 (C-12), 36.9 (C-13), 27.6 (C-14), 75.1 (C-15), 159.5 (C-16), 109.0 (C-17), 32.8 (C-18), 23.2 (C-19), 65.3 (C-20), 171.0 (2×OAc), 170.2 (OAc), 22.0, 21.3, 20.9 (3×OAc)。以上数据与文献报道基本一致[7],故鉴定化合物4为enmenin monoacetate。
化合物5:无色方晶(80%甲醇-水)。1H-NMR (500 MHz, C5D5N): 5.69 (1H, d,= 6.0 Hz, H-6α), 5.47 (1H, s, H-17a), 5.23 (1H, s, H-17b), 4.98 (1H, s, H-15α), 4.55 (1H, d,= 10.0 Hz, H-20a), 4.50 (1H, m, H-11α), 4.35 (1H, d,= 10.0 Hz, H-20b), 3.86 (1H, dd,= 12.4, 4.8 Hz, H-1β), 2.48 (1H, d,= 9.6 Hz, H-9β), 2.73 (1H, m, H-13α), 1.61 (1H, d,= 6.0 Hz, H-5β), 1.10 (3H, s, H3-19), 0.82 (3H, s, H3-18), 2.15 (3H, s, OAc), 1.36 [6H, s, (CH3)2C];13C-NMR (125 MHz, C5D5N): 73.7 (C-1), 26.5 (C-2), 39.5 (C-3), 33.6 (C-4), 54.9 (C-5), 75.3 (C-6), 95.9 (C-7), 52.5 (C-8), 47.7 (C-9), 40.3 (C-10), 63.7 (C-11), 39.9 (C-12), 36.8 (C-13), 27.3 (C-14), 74.8 (C-15), 161.1 (C-16), 108.3 (C-17), 31.7 (C-18), 22.4 (C-19), 64.5 (C-20), 169.3 (OAc), 21.4 (OAc), 100.8 [(CH3)2C], 24.8, 24.7 [(CH3)2C]。以上数据与文献报道基本一致[8],故鉴定化合物5为乙酰化毛萼晶F。
化合物6:白色粉末。1H-NMR (500 MHz, C5D5N): 5.48 (1H, s, H-17a), 5.22 (1H, s, H-17b), 4.51 (1H, d,= 9.7 Hz, H-20a), 4.36 (1H, d,= 9.7 Hz, H-20b), 4.23 (1H, d,= 5.0 Hz, H-6α), 2.76 (1H, d,= 9.0 Hz, H-9β), 1.52 (1H, d,= 5.0 Hz, H-5β), 1.14 (3H, s, H3-19), 1.08 (3H, s, H3-18), 1.32, 1.28 [6H, s, (CH3)2C];13C-NMR (125 MHz, C5D5N): 75.4 (C-1), 27.0 (C-2), 40.8 (C-3), 33.8 (C-4), 57.6 (C-5), 74.5 (C-6), 97.5 (C-7), 52.6 (C-8), 47.9 (C-9), 40.3 (C-10), 63.8 (C-11), 40.0 (C-12), 37.0 (C-13), 26.7 (C-14), 74.0 (C-15), 161.6 (C-16), 107.8 (C-17), 33.1 (C-18), 22.8 (C-19), 64.4 (C-20), 100.7 [(CH3)2C], 2×24.9 [(CH3)2C]。以上数据与文献报道基本一致[9],故鉴定化合物6为荛花香茶菜乙素。
4 生物活性
为了寻找具有细胞毒活性的二萜化合物,对本次实验所分离得到的除量极少的新化合物1之外的5个已知二萜化合物,进行了5种肿瘤细胞株(HL-60、SMMC-7721、A549、MCF-7、SW-480)的体外细胞毒活性实验,但均无活性(IC50>40 μmol/L),这与一般认为的D环α,β-不饱和酮结构是活性基团的认识相一致。
5 讨论
之前的系统研究发现冬凌草中对映-贝壳杉烷型二萜的氧化程度普遍较高,且容易形成3α,20-环氧[10]、7α,20-环氧、11α,20-环氧[11]等多种氧桥,甚至是氮杂桥结构[12],即便C-6、C-7位间发生断裂生成延命素类或螺环内酯类时,C-20依然形成6,20-环氧[13]或7,20-环氧结构[10],因而认为C-20氧桥和整个分子的笼状结构能够起到稳定平面结构和构象的作用。同时C-20大多表现为氧化度较低的-CH2O-片段,极少数表现为氧化度更高的半缩醛(如Pharicin N[6])、缩醛结构(如化合物2),或者是进一步氧化的酯羰基(如rabdoternin A[6])。此次发现的化合物1中C-20为孤立醛基,它可能是20位甲基氧化度由低升高,再形成半缩醛、缩醛(甚至氮杂缩合)、酯环的关键过渡态,只是由于游离羟基被乙酰化而阻止了氧桥的形成,因此能够稳定存在而被幸运的发现。
萜类化合物,特别是香茶菜二萜一直是天然来源抗肿瘤分子研究的重点[14-15],本研究对冬凌草的二萜类成分进行了深入研究,化合物2和4均为首次从该植物中分离,同时新化合物1中C-20氧化程度更高、更活泼的醛基可能预示着C-20形成更多氧桥、氮桥、其他缩合物或者多聚体的可能性,这些新发现为从冬凌草中找到更多具有抗肿瘤活性的二萜化合物、综合利用鄂西地区冬凌草资源奠定了基础。
利益冲突 所有作者均声明不存在利益冲突
[1] Sun H D, Huang S X, Han Q B. Diterpenoids fromspecies and their biological activities [J]., 2006, 23(5): 673-698.
[2] 刘楠, 李纳, 马晓华, 等. 中药影响实验性自身免疫性脑脊髓炎CD4+T细胞亚群分化的研究进展 [J]. 中草药, 2021, 52(4): 1177-1184.
[3] 李小江, 邬明歆, 孔凡铭, 等. 中药有效成分抗肿瘤活性及作用机制研究进展 [J]. 中草药, 2020, 51(9): 2587-2592.
[4] Liu M, Wang W G, Sun H D,. Diterpenoids fromspecies: An update [J]., 2017, 34(9): 1090-1140.
[5] Wen C M, Chen S, Yuan F,. Diterpenoids fromand their nitric oxide production inhibitory activity [J]., 2019, 9(69): 40628-40635.
[6] Hu Z X, Liu M, Wang W G,. 7α, 20-Epoxy--kaurane diterpenoids from the aerial parts of[J]., 2018, 81(1): 106-116.
[7] Mori S, Koizumi T, Shudo K,. Studies on the constituents ofKUDO. II. the structures of enmenin, enmelol, and ememodin [J]., 1970, 18(5): 884-889.
[8] Zhang J X, Han Q B, Zhao A H,. Diterpenoids from[J]., 2003, 74(5): 435-438.
[9] Wu S H, Zang H J, Chen Y P,. Diterpenoids from[J]., 1993, 34(4): 1099-1102.
[10] Liu X, Xue Y B, Dong K,. Three new ent-kaurane diterpenoids fromand their cytotoxicities [J]., 2012, 10(6): 464-470.
[11] Liu X, Zhan R, Wang W G,. Three new 11, 20-epoxy-ent-kauranoids from[J]., 2012, 35(12): 2147-2151.
[12] Liu X, Yang J, Wang W G,. Diterpene alkaloids with an aza--kaurane skeleton from[J]., 2015, 78(2): 196-201.
[13] Liu X, Wang W G, Du X,. Enmein-type diterpenoids from the aerial parts ofand their cytotoxicity [J]., 2012, 83(8): 1451-1455.
[14] 张金芳, 张晓瑞, 郑敏思, 等. 葫芦素类化合物的药理作用研究进展 [J]. 医药导报, 2020, 39(12): 1710-1716.
[15] 卜兰, 刘菲, 熊亮, 等. 益母草属萜类化学成分及其药理作用研究进展[J]. 世界中医药, 2020, 15(9): 1237-1246.
A new-kaurane diterpenoid from
LIU Xu1, 3, CHEN Chun-xia2, 3, WU Ji-zhou3
1. Department of Pharmacy, Tongji Hospital, Tongji Medical College Huazhong University of Science and Technology, Wuhan 430040, China 2. Wuhan Vocational College of Software and Engineering, Wuhan 430070, China 3. College of Pharmacy, Tongji Medical College Huazhong University of Science and Technology, Wuhan 430040, China
To investigate the chemical constituents fromcollected in the west of Hubei Province.Various column chromatography techniques were used to isolate and purify the compounds and their structures were identified by spectral data.From ethanol extract of plants in Jinshi County, six-kaurene diterpenoids were isolated and identified, of which one new compound 3β,6β,14β,15β-tetracetoxy-20-aldehyde--kaur-16-en-7-one (1), and other known ones as pharicin O (2), enmenin (3), enmenin monoacetate (4), acetonide of maoyecrystal F (5), and wikstroenioidin B (6).The new compound 1 named as jianshirubesin J is identified as a rare-kaurane diterpenoid in genusfor its oxygenated C-20 as an aldehyde instead of a common epoxy-bridge with C-3, C-7, or C-11. And compound 2 and 4 are isolated from this plant for the first time.
(Hemsley) H. Hara;-kaurane; diterpenoid; jianshirubesin J; pharicin O; wikstroenioidin B
R284.1
A
0253 - 2670(2021)23 - 7083 - 05
10.7501/j.issn.0253-2670.2021.23.001
2021-06-11
湖北省自然科学基金(2020CFB616)
刘 旭(1985—),男,博士,研究方向为天然产物研究。Tel: 15827283993 E-mail: hustliuxu@aliyun.com
陈春霞,女,博士,主要从事天然药物化学研究。E-mail: 2068639367@qq.com
[责任编辑 王文倩]
