茶树根系耐铝内生真菌的筛选鉴定
2021-12-04章顺成武平安耿园明张宽朝
章顺成,武平安,李 静,丁 月,吴 昊,耿园明, 张宽朝,余 梅
茶树根系耐铝内生真菌的筛选鉴定
章顺成,武平安,李 静,丁 月,吴 昊,耿园明, 张宽朝*,余 梅*
(安徽农业大学生命科学学院,合肥 230036)
茶树是典型的喜铝耐铝植物,其根系微生物在铝元素的吸收转化中起重要作用。从茶树根系分离鉴定出一株耐铝的内生真菌,进行了显微镜形态鉴定及18S rDNA序列分析,分析了该菌株对不同重金属的耐受程度,研究铝对该菌生长的影响,并利用电感耦合等离子原子发射光谱仪(ICP-AES)对该菌株耐受Al3+进行了研究分析。结果发现,显微镜形态观察及18S rDNA序列表明该菌为粘红酵母属粘红酵母(),命名为A3。粘红酵母A3对不同重金属的耐受性为:Al3+> Mn2+> Cu2+,其中铝浓度可达250 mmol·L-1。当培养基中添加了150 mmol·L-1的Al3+,菌液pH值为2.0~3.0,粘红酵母A3生长良好。ICP-AES结果显示该菌株铝离子含量与培养基中Al3+浓度呈正相关,说明该菌株在一定范围内对Al3+具有吸附作用;同时测定该菌株的含水量随培养基中铝含量增加而增大,揭示该菌株对铝毒害的规避与其通过含水量的增加平衡细胞液有关系。分离的耐铝真菌为茶树的耐铝机制提供新的思路,并为其定殖到其他作物规避铝胁迫提供微生物资源,以提高植物的抗性,增加产量。
茶树;耐铝;内生菌;粘红酵母
植物内生菌是指生活在植物细胞内或细胞间隙的微生物资源[1]。植物与内生菌之间可以相互作用,内生菌可以诱导植物进行相关生物合成[2],而且植物也选择内生菌并对其代谢进行调控[3]。在长期进化过程中,有些内生菌在与植物共生时能够调节植物对逆境的适应,如因受到重金属胁迫、盐分、干旱、高温而引起的细胞毒害时,可以提升其适应环境胁迫的响应机制并促进植物生长[4-10]。对植物内生菌的有效利用是内生菌研究的方向之一,近年来农业生产中对内生菌的应用也有一些进展[11]。植物内生菌数量大,增值较快,利用植物内生菌将其定殖到植物体内,对提高植物的抗性、增加产量等有一定的应用前景[8]。
酸性土壤占世界可耕作土壤的 30% ~ 40%,且呈逐年上升趋势,铝毒是酸性土壤中作物生产的主要限制因素[12]。在植物中有两类不同的耐铝机制:从根尖排除铝和在植物中积累铝[13]。茶树是铝积累型植物,其体内铝含量是其他植物的几十倍,特别是老叶中的铝含量可高达30 mg·g-1。茶树积累铝却并不表现出其根尖生长受抑制及根冠表皮脱落等典型铝毒症状,而且适宜浓度的铝还能促进茶树的生长[14]。茶树的耐铝机制是否与其内生菌及土壤中的耐铝微生物有关,引起了研究者的广泛关注。赵希俊等[15]从健康茶树体内分离出53株耐铝内生细菌,通过促生指标评测,筛选出一株具有显著促生功能的内生细菌G3。Zhang等[16]分离到一株耐铝微紫青霉菌()F-13,该菌能在含100 mmol·L-1铝离子的培养基中生长。本研究从茶树品种‘舒茶早’中筛选出耐铝性能较高的内生菌株,并进行了系统研究,以期为提示茶树喜铝耐铝机理奠定基础,为茶树的优质高效栽培提供参考。
1 材料与方法
1.1 供试材料
春季从安徽农业大学农翠园的茶树品种园中挑选生长旺盛、无病害的五年生‘舒茶早’茶树,采集其主根、侧根带回实验室。去除根系表面土壤,用自来水冲洗干净,吸干表面水后备用。
1.2 试验方法
1.2.1 茶树耐铝内生菌的分离 (1)根系表面消毒。将清洗干净的根系用75%乙醇处理1 min,然后用0.10%的升汞处理12 min,无菌水冲洗3 ~ 5次,无菌吸水纸吸干表面水分。
(2)茶树耐铝内生菌的分离。将经过表面消毒的根系剪成约2 cm长的圆柱体,接入PDA固体培养基,观察2周无污染后,揭去表皮,再切成0.5 cm大小的片段,转接至新的PDA固体培养基,观察记录,每个处理设置3个重复,每个重复接入3块组织。待组织块边缘有菌丝生长,即可进行择优选取。将选取的菌落挑出接种至液体PDA培养基中28℃、180 r·min-1培养,在培养过程中逐渐提高铝离子浓度至100 mmol·L-1。
1.2.2 茶树耐铝内生菌的纯化及形态学观察 将菌液接种于含100 mmol·L-1铝离子的PDA固体培养基中,每个平板挑取2 ~ 4个单菌落(具体个数根据平板上长出的单菌落决定),重复4次四区划线操作,最终得到纯化的单菌落,然后再进行多次纯化接种到斜面培养基上进行保存。观察菌株菌落,并用光学显微镜分析菌落形态。
1.2.3 茶树耐铝内生菌的种属鉴定及其系统进化树构建 使用真菌基因组DNA快速抽提试剂盒,对分离得到的耐铝性能优良且生长速率快的菌株进行基因组DNA提取。使用真菌18S rDNA的通用引物NS1(5'- GTAGTCATATGCTTGTCTC - 3')正向引物和NS8(5'- TCCGCAGGTTCACCTACGGA - 3')反向引物,PCR扩增内生菌的18S rDNA。PCR反应条件:94 ℃预变性5 min,循环条件为94 ℃ 30 s; 55 ℃ 30 s; 72 ℃ 60 s,30个循环;72 ℃延伸7 min。对PCR扩增产物进行测序,测序结果经过比对拼接后,在NCBI数据库中检索分析。选取相似菌种的18S rDNA序列并下载相关序列,使用MEGA5.1构建系统进化树,分析内生菌的亲缘关系。
1.2.4 3种金属离子MIC( minimum inhibitory concentration)测定 用含Al3+、Mn2+、Cu2+等重金属浓度分别为0 ~ 250 mmol·L-1的培养基在96孔板中对菌株进行MIC检测,重复3次,于28 ℃培养箱培养3 d。
1.2.5 加铝和不加铝条件下内生菌的生长曲线绘制
取鉴定过种属的菌落,先液体培养至适宜浓度,分别接种于不含铝离子和铝离子浓度为150 mmol·L-1的PDA液体培养基中,28 ℃、180 r·min-1培养。每12 h分别取出3瓶培养液,以无菌PDA培养基作为对照,测定OD600的值。
1.2.6 铝胁迫条件下内生菌培养液pH变化 取鉴定过种属的菌落,先液体培养至适宜浓度,分别接种于不含铝盐和铝离子浓度为150 mmol·L-1的PDA液体培养基中,28℃、180 r·min-1培养。每12 h分别取出3瓶培养液,用pH计测定菌液的pH值。
1.2.7 耐铝内生菌水含量及铝含量的测定 采用电感耦合等离子原子发射光谱法(ICP-AES)测定铝含量。
取适量生长旺盛的耐铝菌株分别接种于铝含量为0、50、100、150和200 mmol·L-1的PDA固体培养基中,培养7 d,取菌体,称重。于105 ℃烘4 ~ 6 h,将温度降低到70 ℃烘至恒重,常温下干燥器中保存。
按公式(1)计算细胞含水量:

称取0.25 g烘干后的菌体,加入10 mL体积比为9:1的高氯酸:硝酸混合液,于180 ℃电热板上浓缩至体积小于0.5 mL后冷却待用。将上述液体定容至25 mL,采用电感耦合等离子原子发射光谱法测定所得溶液的铝含量,对结果进行相关分析。
按公式(2)计算细胞铝含量:
细胞内铝含量/(mg·g-1)=实验样品铝含量/(mg·g-1)× 50 (2)
2 结果与分析
2.1 茶树耐铝内生菌的分离结果
茶树的根经过分离纯化得到的耐铝菌落在PDA固体培养基上肉眼观察为浅橙红色的粘质状菌落,表面可由光滑到褶皱,有光泽,质地粘稠有时发硬(图1)。光学显微镜下观察,该菌落为规则的圆球形,个体以单细胞状态存在(图2)。
2.2 茶树耐铝内生菌的种属鉴定及其系统进化树构建
对分离出的茶树耐铝内生菌进行18S rDNA测序,分析结果显示,菌株序列长度为1 736 bp,经过NCBI中BLAST比对,该菌株与strain HK29-3的同源性100%,依据18S rDNA序列比对结果及同源性分析说明该菌株为酵母科、红酵母属、粘红酵母种。茶树耐铝内生菌系统进化树见图3。
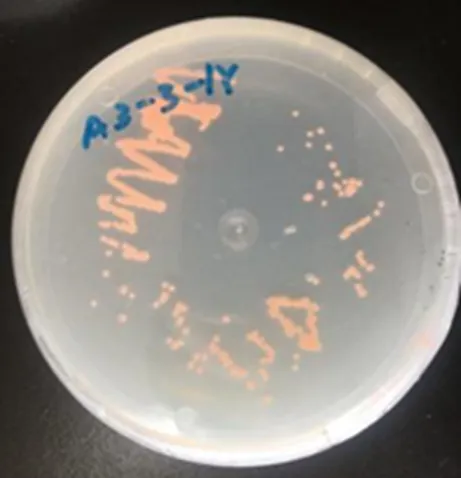
图 1 菌落形态
Figure 1 Colony

图 2 光学显微镜下的菌体形态(×400)
Figure 2 Morphology of fungus under an optical microscope(×400)
2.3 3种重金属离子MIC测定
多种重金属MIC结果(图4)显示对铝的耐受度较高,达到250 mmol·L-1,对Mn2+耐受达50 mmol·L-1,对 Cu2+耐受度较低。
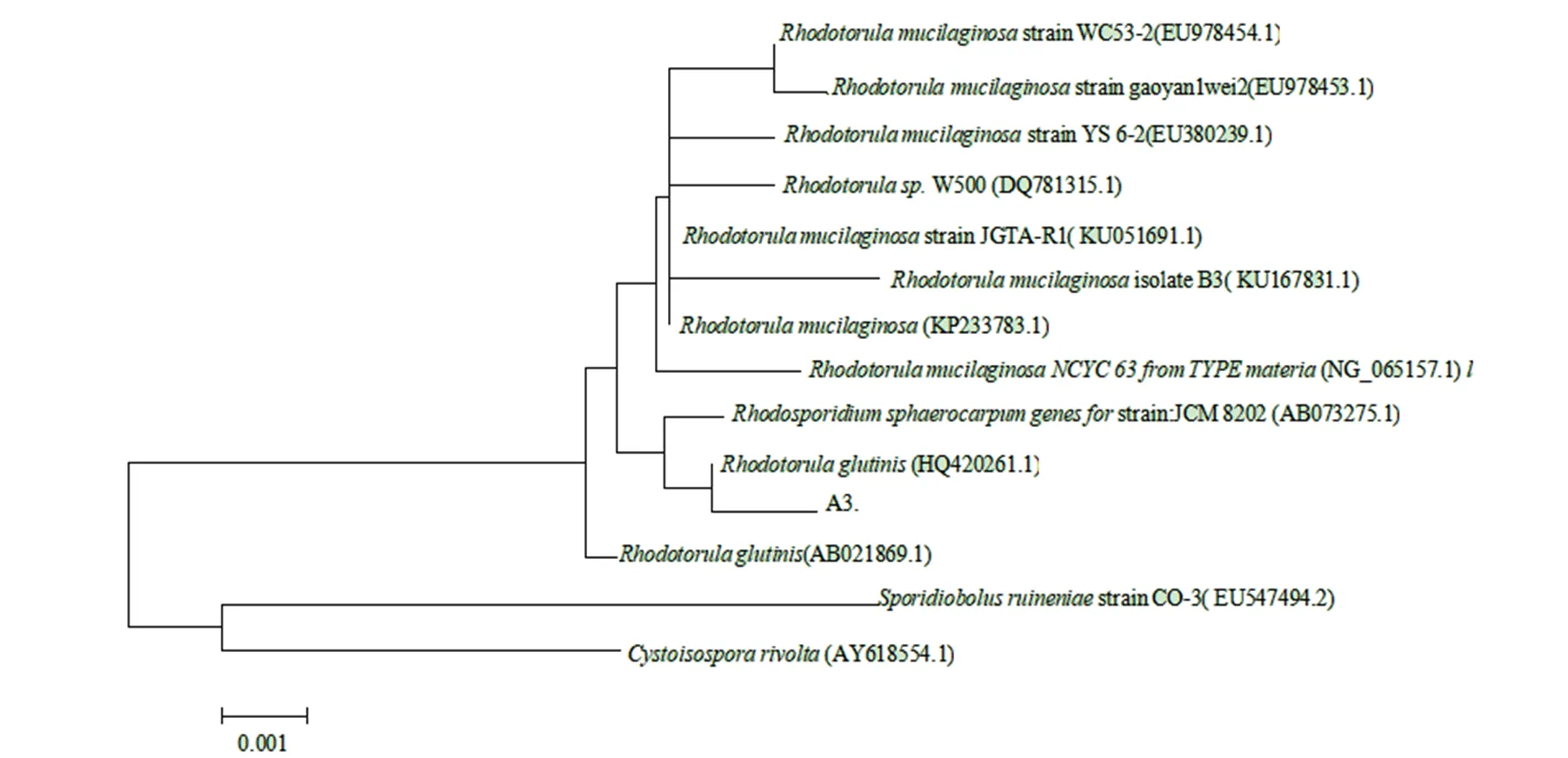
图3 茶树耐铝内生菌的系统发育分析
Figure 3 Phylogenetic analysis of the aluminum-tolerant endophytic fungus
2.4 菌株A3的生长曲线
如图5所示,菌株A3在PDA培养基中36 h达到一个峰值,随后下降;而培养60 h时又达到一个高峰,结合图6的pH值变化,显示该菌落在一定范围内适合在较低pH值的培养基中生长。两组实验均设置了3个重复。
菌株A3在添加浓度为150 mmol·L-1的Al3+中与对照相比,其生长受到铝离子的影响, 在12 h、48 h和120 h的培养时间里,可以观察到这3个时间点其生长速度接近对照。说明铝离子对粘红酵母A3生长有一定的抑制作用,但其在150 mmol·L-1Al3+中仍能够适应铝离子胁迫。

图4 耐铝内生菌对3种金属的MIC
Figure 4 MIC of three metals of the isolated alumi num- tolerant endophytic fungus
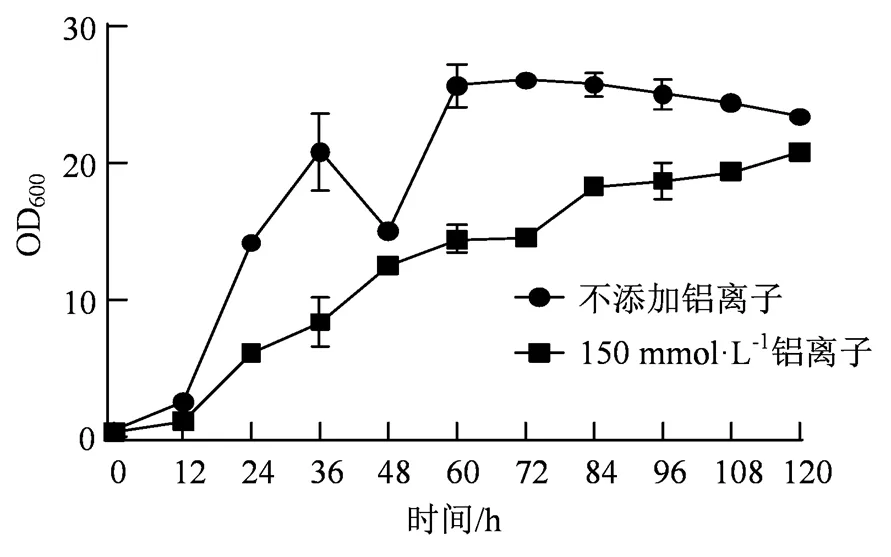
图5 Al3+对分离菌株生长的影响
Figure 5 Effect of Al3+on the growth of the isolated strain
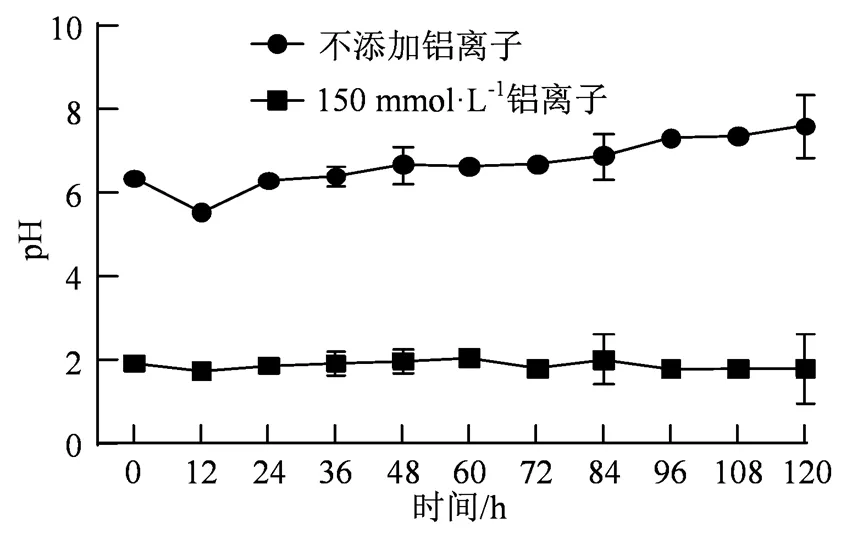
图6 Al3+对菌株pH值的影响
Figure 6 Effects of Al3+on the pH value of the strain

图7 不同浓度Al3+对菌株细胞内铝离子含量的影响
Figure 7 Effects of different concentrations of Al3+in the me dium on Al3+content in the strain
2.5 茶树耐铝内生菌铝胁迫pH变化
将A3菌分别接种于不含铝盐和铝离子浓度为150 mmol·L-1的PDA液体培养基中,在28 ℃、180 r·min-1条件下进行培养。生长情况(图6)显示,随着生长时间的增加,未加铝盐的培养基中菌体pH在培养12 h下降,说明此时菌体有酸性代谢物质产生,随后pH缓慢上升。与对照相比,添加了150 mmol·L-1的Al3+的培养基中的菌液pH基本维持下2左右不变,并且生长良好,说明该菌株耐酸性较强。pH值远低于未加铝盐的,可能是因为铝盐呈现酸性。该菌株在120 h培养过程中基本维持pH值为2。
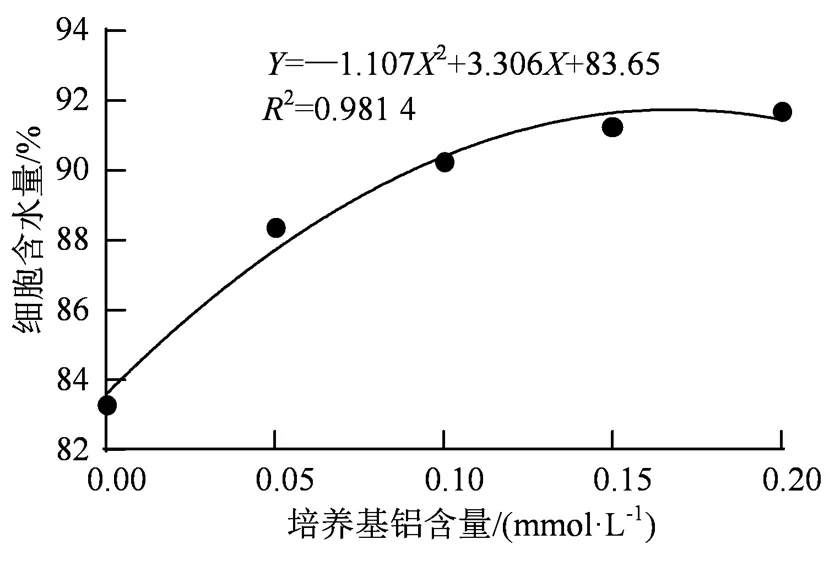
图8 不同浓度Al3+对菌株细胞内含水量的影响
Figure 8 Effects of different concentrations of Al3+in the medium on intracellular water content of the strain
2.6 茶树耐铝内生菌铝含量测定
如图7所示,菌体内铝含量与培养基铝离子含量呈正相关,说明菌体对铝离子的吸附能力较强,铝离子不容易被饱和,也反应出铝离子的载体通道比较多。每种铝含量设置3个重复,3次实验数据方差较小,故不设置误差线。
2.7 茶树耐铝内生菌细胞含水量的测定
如图8所示,培养基铝离子含量在0~0.10 mol·L-1范围内,耐铝菌株A3细胞含水量与培养基内铝离子浓度呈正向协同关系。菌株A3对铝离子的适应可能与细胞过多摄入水有关。通过铝离子通道进入A3细胞的铝离子数量越多,胞内铝离子浓度越高,A3细胞即反射性地主动摄入更多的水,从而形成较大物理静水压,以对抗由于铝离子浓度升高而产生的高化学渗透压。受菌体细胞体积所限,细胞摄入水速度不断下降,水摄入量不能与培养基内在0.10~0.20 mol·L-1高铝浓度下所进入细胞的铝盐含量成一阶正比函数关系。
3 讨论与结论
本研究从茶树品种‘舒茶早’的根中分离、筛选得到了1株耐受铝离子浓度为250 mmol·L-1、耐受锰离子浓度为50 mmol·L-1的菌株,经鉴定为粘红酵母。该菌株耐铝水平较Wang等[17]从土壤中分离的红酵母的耐铝程度更高。
与对照相比,铝离子在150 mmol·L-1浓度下对粘红酵母A3生长具有一定的抑制作用。这与Wang等人发现的红酵母RS1可在高达200 mmol·L-1的A13+中生长,但是50 mmol·L-1的A13+就对其产生了毒害作用相一致[17]。Thompson等[18]也发现 Al 可以明显地抑制真菌的生长,而葛德永[19]和赵丽伟[20]等研究发现,低浓度的 A13+(10 mmol·L-1)可以促进耐铝菌丝体和酵母细胞的生长。耐铝霉菌的生长是对铝表现出依赖性,在无铝条件下,菌株不生长或生长不好。Wakao等[21]发现一些嗜酸菌也是依靠铝的,高Al环境可以明显促进其生长。这些差异可能是由菌体对pH和铝敏感程度不同造成的。
本研究中分离到的耐铝菌株A3在培养基不加铝的条件下,培养基pH的变化由菌株细胞代谢引起,pH有一定的变化,表明该菌株生长旺盛,有较多的酸性及碱性代谢产物产生。但其在150 mmol·L-1铝离子胁迫时,该菌株的pH却基本无改变,说明其在铝离子胁迫下不通过产生酸性或碱性物质来转变铝离子形式,以应对铝离子胁迫,而可能是通过在胞内产生配合物以络合铝离子的方式来减轻毒害的,这与Wang等[17]的研究相同。低铝时菌体活动对pH有明显影响,高铝时pH变化不明显。小西茂毅等[22]发现多聚天冬氨酸和多聚谷氨酸可以减轻铝引起的花粉管生长抑制作用。他们分离到耐铝真菌培养后的介质对铝引起的花粉管生长抑制有减轻作用,将耐铝细菌培养后的介质加入可以逆转铝胁迫引起的花粉管生长抑制,表明分离到的耐酸铝在其生长过程中,释放出某些物质,可能是蛋白质和络合剂,从而屏蔽了离子态铝,提高了培养基的pH。
耐铝菌株A3在250 mmol·L-1的铝离子浓度范围内,其胞内铝离子含量占总铝离子含量是定值,这说明这种选择透过性不因铝离子浓度升高而降低。研究还发现,耐铝菌株A3伴随着铝离子胁迫程度的增加其吸水量相应增大,这与耐铝菌通过吸收水含量调节细胞、维持细胞内的平衡达到规避铝胁迫的目的有关。相对于培养基中高浓度铝,耐铝微生物能保持细胞极低铝浓度,说明高耐铝微生物主要通过有效地将铝屏蔽于细胞外达到解铝毒目的[23-24],但关于微生物屏蔽铝的具体机制并不清楚。对于进入到细胞质内的铝,微生物主要通过有机酸或其他螯合物质与铝螯合减轻细胞内铝毒害[25]。胡振民等[26]研究发现,红酵母 RS细胞壁磷含量在 70 mmol·L-1铝处理后显著升高。关于耐铝菌株A3的耐铝机制仍需进一步对其进行研究,我们现在正在做这方面的工作。
耐铝菌A3耐铝、酸程度较高,可以应用于铝、酸含量较高的污染土壤中,这些微生物可以通过减少土壤溶液中的铝,在不影响土壤的微生物群落和动物种群的条件下[19],对缓解植物的铝胁迫有一定的应用前景。
[1] BUSBY P E, RIDOUT M, NEWCOMBE G. Fungal endophytes: modifiers of plant disease[J]. Plant Mol Biol, 2016, 90(6): 645-655.
[2] ETALO D W, JEON J S, RAAIJMAKERS J M. Modulation of plant chemistry by beneficial root microbiota[J]. Nat Prod Rep, 2018, 35(5): 398-409.
[3] LIU J, LIU G. Analysis of secondary metabolites from plant endophytic fungi[J]. Methods Mol Biol, 2018, 1848: 25-38.
[4] 冯君, 王宇楠, 于翠梅, 等. 植物内生菌对重金属胁迫下植物生长的影响综述[J]. 江苏农业科学, 2019, 47(18): 42-45.
[5] 翟大才, 房震, 吕彩云, 等. 黄精内生菌枯草芽胞杆菌HJ-2的抑菌活性研究[J]. 农业生物技术学报, 2019, 27(9): 1664-1672.
[6] 谭佳缘, 孙蔓蔓, 夏师慧, 等. 重金属胁迫和内生菌对植物氮代谢影响的研究进展[J]. 新农业, 2019(17): 7-10.
[7] BHATTACHARJEE S, ROY DAS A, SAHA A K, et al. Fungal endophytes from medicinal plants: growth promotion inL. andL.[J]. Vegetos, 2019, 32(3): 381-386.
[8] MASTAN A, RANE D, DASTAGER S G, et al. Development of low-cost plant probiotic formulations of functional endophytes for sustainable cultivation of[J]. Microbiol Res, 2019, 227: 126310.
[9] VIGANI G, ROLLI E, MARASCO R, et al. Root bacterial endophytes confer drought resistance and enhance expression and activity of a vacuolar H+-pumping pyrophosphatase in pepper plants[J]. Environ Microbiol, 2019, 21(9): 3212-3228.
[10] LLORENS E, SHARON O, CAMAÑES G, et al. Endophytes from wild cereals protect wheat plants from drought by alteration of physiological responses of the plants to water stress[J]. Environ Microbiol, 2019, 21(9): 3299-3312.
[11] YANG B, MA H Y, WANG X M, et al. Improvement of nitrogen accumulation and metabolism in rice (L.) by the endophyte Phomopsis liquid ambari[J]. Plant Physiol Biochem, 2014, 82: 172-182.
[12] MA J F, SHEN R, ZHAO Z, et al. Response of rice to Al stress and identification of quantitative trait Loci for Al tolerance[J]. Plant Cell Physiol, 2002, 43(6): 652-659.
[13] MA J F. Role of organic acids in detoxification of aluminum in higher plants[J]. Plant Cell Physiol, 2000, 41(4): 383-390.
[14] KOCHIAN L V, HOEKENGA O A, PINEROS M A. How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency[J]. Annu Rev Plant Biol, 2004, 55: 459-493.
[15] 赵希俊, 宋萍, 封磊, 等. 一株具有耐铝促生作用的茶树内生细菌的分离鉴定[J]. 江西农业大学学报, 2014, 36(2): 407-412.
[16] ZHANG D M, DUINE J A, KAWAI F. The extremely high Al resistance ofF-13 is not caused by internal or external sequestration of Al[J]. Biometals, 2002, 15(2): 167-174.
[17] WANG C, ZHAO X Q, AIZAWA T, et al. High aluminum tolerance ofsp. RS1 is associated with thickening of the cell wall rather than chelation of aluminum ions[J]. Pedosphere, 2013, 23(1): 29-38.
[18] THOMPSON G W, MEDVE R J. Effects of aluminum and manganese on the growth of ectomycorrhizal fungi[J]. Appl Environ Microbiol, 1984, 48(3): 556-560.
[19] 葛德永, 姚槐应, 黄昌勇. 茶园土壤耐酸铝微生物的分离鉴定及其耐铝特性研究[J]. 浙江大学学报(农业与生命科学版), 2007, 33(6): 626-632.
[20] 赵丽伟, 罗义勇, 谭浩, 等. 茶园土壤耐酸铝酵母菌的分离鉴定及其耐铝特性的初步研究[J]. 中国微生态学杂志, 2011, 23(9): 792-796.
[21] WAKAO N, YASUDA T, JOJIMA Y, et al. Enhanced growth ofand related acidophilic bacteria at high concentrations of aluminum[J]. Microb Environ, 2002, 17(2): 98-104.
[22] 小西茂毅, 陆建良. 耐酸铝细菌的分离及其特性鉴定[J]. 茶叶, 1995, 21(4): 26-29.
[23] YOSHIMURA E, NAGASAKA S, SATO Y, et al. Extraordinary high aluminium tolerance of the acidophilic thermophilic alga,[J]. Soil Sci Plant Nutr, 1999, 45(3): 721-724.
[24] HAMEL R, APPANNA V D, VISWANATHA T, et al. Overexpression of isocitratelyase is an important strategy in the survival ofexposed to aluminum[J]. Biochem Biophys Res Commun, 2004, 317(4): 1189-1194.
[25] MAILLOUX R J, LEMIRE J, KALYUZHNYI S, et al. A novel metabolic network leads to enhanced citrate biogenesis inexposed to aluminum toxicity[J]. Extremophiles, 2008, 12(3): 451-459.
[26] 胡振民, 赵学强, 王超, 等. 细胞壁组分在红酵母RS1高耐铝中的作用研究[J]. 土壤, 2017, 49(2): 256-260.
Screening and identification of aluminum-tolerant endophytic fungi in tea plant roots
ZHANG Shuncheng, WU Ping'an, LI Jing, DING Yue, WU Hao, GENG Yuanming, ZHANG Kuanchao, YU Mei
(School of Life Sciences, Anhui Agricultural University, Hefei 230036)
Tea plants are typical aluminum-tolerant plants, and their root microorganisms play important roles in the absorption and transformation of aluminum. In this study, an endophytic fungi with aluminum tolerance was isolated from the roots of tea plants. Microscopic morphological identification and 18S rDNA sequence analysis were carried out to analyze the tolerance degree of the strain to different heavy metals and to study the effect of aluminum on the growth of the strain. The tolerance ability of the strain to Al3+was analyzed by inductively coupled plasma atomic emission spectrometer (ICP-AES),and the results showed that the fungus belonged to, numbered A3 by microscopic morphology observation and 18S rDNA sequence analysis. The tolerance of the strain to three heavy metals was: Al3+> Mn2+> Cu2+, and the strain could grow in the presence of Al3+up to 250 mmol·L-1. The pH value of the strain in the culture medium was 2.0 - 3.0 when 150 mmol·L-1Al3+was added to the medium. ICP-AES results showed that the aluminum ion content in the strain was positively correlated with the Al3+concentration in the medium, which indicated that the strain has adsorption ability on the Al3+in a certain range. Meanwhile, it was also determined that the water content of the strain increased with the increase of the aluminum content in the medium, which revealed that the avoidance of aluminum toxicity of the strain might be related to the equilibrium cell fluid through the increase of water content. The aluminum-tolerant fungus isolated in this study might provide new ideas for the aluminum-tolerant mechanism of tea plants, and provide microbial resources for their colonization in other crops to avoid aluminum stress, so as to improve plant resistance and increase yield.
tea plant; aluminum resistant; endophyte;
S571.1; X172
A
1672-352X (2021)05-0744-06
10.13610/j.cnki.1672-352x.20211022.005
2021-10-25 15:57:11
[URL] https://kns.cnki.net/kcms/detail/34.1162.s.20211022.1530.010.html
2020-09-15
国家级大学生创新项目(dg194205)资助。
章顺成,硕士研究生。E-mail:15156046608@163.com
通信作者:余 梅,博士,副教授。E-mail:yumei@ahau.edu.cn 张宽朝,高级实验师。E-mail:zhangkch1980@126.com
