益生菌快速检测技术研究进展
2021-12-04吕秀莉李柏良ang霍贵成岳莹雪郭佳瑶
吕秀莉 - 李柏良 -ang 霍贵成 - 岳莹雪 - 郭佳瑶 -
(东北农业大学乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
益生菌广泛存在于人和一些动物肠道中,传统研究用的益生菌主要包括双歧杆菌、乳杆菌和酵母菌等,这些益生菌在维持肠道内菌群平衡、治疗便秘和腹泻、增强机体免疫力、降低血清胆固醇、改善肥胖、延缓衰老和抗肿瘤等方面起着重要的作用[1-4]。近年来,“肠—脑轴”和“肠—肝轴”等概念的提出,更使人们认识到益生菌可以通过改变肠道菌群状况来调控宿主的情绪和认知情况,并通过肠道与其他器官的双向交流实现对其他器官疾病的预防[5-6]。与传统益生菌对某些疾病起到缓解与预防的作用不同,下一代益生菌的相关研究是以治疗疾病为核心[7-8],目前下一代益生菌的主要研究对象为梭菌属中的柔嫩梭菌和丁酸梭菌、拟杆菌属中的脆弱拟杆菌和卵形拟杆菌以及嗜黏蛋白—阿克曼氏菌等,且其在某些疾病的治疗中起到积极作用[9-10]。
随着益生菌研究的逐渐深入,不论是在食品或保健产品的质量管控方面还是在新型益生菌的研究方面,益生菌的检测与筛选工作都是十分重要的。肠道内的益生菌大多为厌氧菌,培养条件较为苛刻,传统培养方法周期长,过程繁琐,难以满足快速检测的需要[11]。文章拟对益生菌的检测方法进行综述,并展望快速检测方法的发展前景,旨在为进一步提高中国食品的品质提供一定参考。
1 免疫学检测技术
1.1 酶联免疫吸附技术
酶联免疫吸附测定(ELISA)是目前发展较为完善的免疫学检测方法。酶联免疫吸附检测时,抗原(抗体)首先结合在固相载体表面,此时该抗原(抗体)仍保留其免疫活性,再加入一种同样保持着免疫活性的抗体(抗原)与酶结合而成的复合物,最后加入底物与酶作用,利用底物与酶发生的显色反应对样本中微生物进行定性和定量分析与检测[12-13]。
在益生菌检测方面,双抗体夹心ELISA技术可应用于双歧杆菌等传统益生菌的检测,其基本原理如图1所示。传统酶联免疫吸附检测技术具有操作简单方便、适用范围广和效率高等诸多优点,但其在灵敏度和特异性方面有所不足,双抗体夹心-ELISA技术由于增加了一层抗体,使得检测的灵敏度进一步提高。袁耀武等[14]制备了鼠和兔抗长双歧杆菌和两歧双歧杆菌的免疫血清,利用双抗体夹心ELISA法成功检出了发酵乳制品中的双歧杆菌,试验过程耗时8 h,检测的最低浓度为107CFU/mL。
1.2 电化学免疫传感器检测技术
电化学免疫传感器检测技术是建立在传感技术与抗原—抗体特异性反应基础上的检测技术,其中电极被用作固定载体和传感元件,抗原(抗体)作为敏感元件,经固定化技术与电极表面结合,产生的反应信号会转换为容易测量的电信号,实现对待测物的定量检测[16]。
在益生菌检测方面,Xue等[17]使用电化学磁珠免疫传感器对乳制品中的鼠李糖乳杆菌进行了检测,通过将磁珠与针对鼠李糖乳杆菌菌毛亚基 SpaA 的特异性抗体偶联,捕获样本中的鼠李糖乳杆菌,然后加入酶标记的抗体进行反应,最后分离免疫复合物,用电极测量电流信号的变化。试验证明电化学磁珠免疫传感器检测鼠李糖乳杆菌具有特异性,不与其他乳酸菌发生交叉反应,且检出限低。在新型传感器的制备与应用方面,Zhao[18]将金纳米粒子电沉积在电极表面,制备了一种超灵敏电化学免疫传感器,制备方案如图2所示,将其用于短乳杆菌的检测,并对影响传感器传感效果的因素进行了研究。由于采用了夹心结构,其所设计的电化学免疫传感器可以在104~109CFU/mL范围内线性检测短乳杆菌。
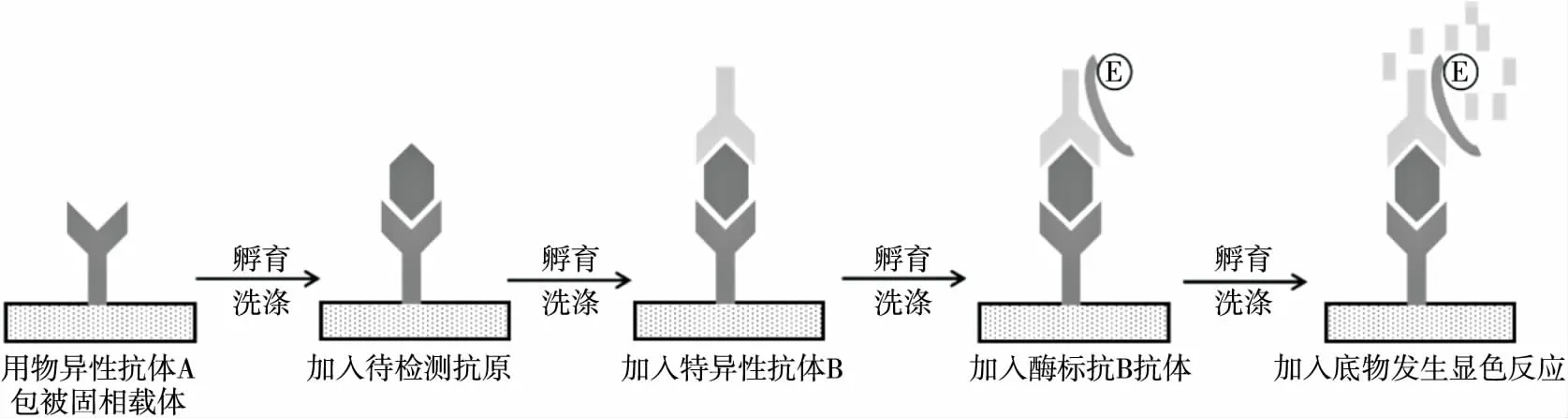
图1 双抗体夹心ELISA检测法原理与流程图[14-15]Figure 1 Flowchart of modified double antibody sandwich-ELISA
1.3 不同标示物的免疫层析检测技术
免疫层析(ICTS)的原理与ELISA相似,其区别为免疫层析技术中免疫反应是在硝酸纤维素膜等载体上通过毛细管迁移进行的,依靠被标记的抗体作为视觉信号来检测样本中的抗体特异性抗原[19]。免疫层析技术作为一类快速检测技术备受重视,传统的免疫层析方法大多以胶体金作为标示物,通过金颗粒在检测线处的聚集对待检物进行定性或者半定量检测,检测灵敏度较低,且最早的试纸条只能用来检测单种目标物[20]。因此,除常规的胶体金外,其他许多优良的新型标示物也被用于免疫层析技术中,在微生物检测中发挥重要作用。以新材料为标示物的免疫层析技术在微生物检测中的应用详见表1。
随着分子生物学技术不断成熟以及各学科的交叉应用越来越普遍,近年来在免疫层析技术的应用中除开发更多新型标示物外,与核酸扩增技术相结合的免疫层析试纸条也逐渐被开发出来。此类试纸条可以在核酸层面对样品进行检测,因此相比于传统免疫层析法来说具有更高的灵敏性和特异性[29]。陈诗胜等[30]结合PCR技术开发了检测致奶牛乳房炎的无乳链球菌、金黄色葡萄球菌、大肠杆菌和停乳链球菌4种重要致病菌的核酸免疫层析试纸条方法,结果显示用此方法检测4种菌的灵敏度比凝胶电泳提高了10~100倍。
综上,免疫层析技术已在致病菌等微生物的检测中发挥重要作用,而在益生菌检测方面的应用较少,随着生活水平的进一步提高,人们对于食品的关注将不仅限于其安全性,对食品品质及功能性也会有更高的要求,免疫层析技术将因其快速简便的特点在益生菌的检测中发挥极大作用。
2 分子生物学检测技术
微生物遗传信息的相对稳定,使针对微生物DNA特
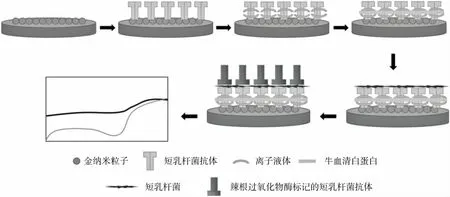
图2 短乳杆菌免疫传感器的制备方案[18]Figure 2 Scheme of preparation of Lactobacillus brevis immunosensor

表1 在免疫层析技术中应用的新型纳米材料Table 1 Application of new nanoparticles in ICTS
异性序列的分子生物学检测技术得到了广泛应用。不同的分子生物学检测技术其应用范围不同,且分子生物学检测技术已经不局限于单个技术的推广与应用,而是趋向多种技术互相结合、优势互补,不仅大大缩短了检测时间,提高了检测效率,而且在检验结果的精度上也有所提高,为实现高通量检测创造了条件,促进了微生物检测技术的发展[31]。
2.1 以核酸分子杂交为基础的检测技术
2.1.1 核酸探针技术 核酸探针技术以微生物特异性核酸片段为基础设计核酸探针,经变性、退火和复性过程使探针能与被检测核苷酸序列的一段单链cDNA或cRNA分子结合,依据不同指示剂选用相应的方法进行检测[32]。
2.1.2 肽核酸荧光原位杂交技术 荧光原位杂交技术(FISH)是由核酸分子杂交技术发展而来,被广泛应用于遗传学研究中的一项技术,可以鉴定核酸分子之间的同源性。此技术对特异性核苷酸片段进行荧光标记,使其作为探针与待检样品中的靶基因经过碱基互补配对,实现特异性结合,通过荧光检测体系对杂交体的检测实现对样本中微生物的定性和定量分析[33]。FISH技术具有特异性强和显微镜可视性的特点,在病原微生物诊断、产前诊断和评价微生物群落等方面均有应用[34-35]。
由于细胞核糖体含量低、细胞壁通透性差以及存在rRNA的高级结构等多种因素,DNA探针在试验中常表现出较低的荧光信号,与 DNA探针相比,肽核酸(PNA)具有更高的热稳定性和特异性[36]。近年来,针对一些细菌的特异性序列的PNA探针已被用于益生菌的检测。Machado等[37]利用PNA-FISH技术对牛乳中的36株不同乳酸菌属菌株和20株其他细菌进行了检测,并测定了探针对各种乳杆菌菌株和其他相关细菌菌株的特异性和敏感性,试验表明此方法的灵敏度和特异性分别为100%和95%。此外,Ferreira等[38]建立了一种微流控技术结合PNA-FISH技术的酿酒酵母菌快速识别方法,其过程如图3所示。流经微通道的酵母细胞被捕获后,PNA探针会以恒定的流速与被捕获的酵母细胞杂交,杂交后用洗涤液去除结合松散的探针,再用外荧光显微镜检查被荧光标记的酵母细胞。
2.1.3 基因芯片技术 基因芯片又称DNA芯片,能够进行大规模高通量筛选,其原理是以已知序列的寡核苷酸、cDNA或基因片段作为探针,将其有序地固定在支持物上,然后与被标记的样品DNA进行杂交,通过自动化仪器对杂交信号的强弱进行检测,定性、定量地对待测样本中的基因序列进行分析,从而达到检测样品中是否含有某种微生物的目的[39-40]。

图3 微通道中的FISH分析示意图[38]Figure 3 Schematic illustration of the concept to perform the FISH assay in non-widened pillar-based microchannels
基因芯片技术已被应用于肠道微生物群分析中[41],在益生菌检测方面,Patz等[42]通过一种快速的DNA微阵列技术对植物叶片进行了群落分析,并证明了双歧杆菌属、乳杆菌属和链球菌属的存在,试验表明植物叶片中含有大量潜在的益生菌作用菌属和菌种,可被视为益生菌的重要来源。Boesten等[43]使用了适于测定尚未完全测序的基因组差异的基于随机克隆的微阵列方法,构建了与人类肠道相关的6种双歧杆菌的基因组DNA芯片,并对双歧杆菌的多样性和功能性进行了分析。近年来,随着一些种属特异性基因不断被发现,基因芯片技术将有更多的靶基因可供选择,这将大大提高检测的准确性[44-45]。
2.2 脉冲凝胶电泳技术
脉冲凝胶电泳技术(PFGE)是一种分离大分子DNA片段技术,利用限制性核酸内切酶对细菌的全基因组DNA进行消化,产生不同大小的 DNA 片段,通过脉冲电场方向、电流大小与时间不断变化,大片段DNA分子在凝胶中被重新定向,从而实现有效分离[46-47]。PFGE技术具有特异性强和灵敏度高的特点,但是利用PFGE方法鉴定亲缘关系较近的不同种细菌的特异性较差,Yang等[48]从商业发酵食品样品中分离了乳酸杆菌和嗜热链球菌,并利用PFGE技术分别对其进行遗传指纹图谱分析,结果从43株乳酸菌中分离出24种PFGE分型,从34株嗜热链球菌中分离出32种PFGE分型,表明所使用的限制性内切酶对大多数菌株都有较好的分型效果,但部分遗传关系相近的不同种类的菌株表现出相同的PFGE模式。
2.3 PCR及其衍生技术
聚合酶链式反应(PCR)可以看作是生物体外的特殊DNA复制过程,该方法通过数十个变性、退火和延伸的循环使目标核酸序列实现指数扩增[49]。核酸体外扩增技术在分子生物学领域被用来定性、定量地分析和检测微量核酸。近年来,随着研究的不断深入,在传统PCR检测技术的基础上衍生出一系列新的PCR检测技术[50-51],基于PCR技术的各种检测方法已被广泛用于益生菌尤其是下一代益生菌检测中。
2.3.1 PCR-DGGE技术 基于PCR的变性梯度凝胶电泳(DGGE)是一种可将长度相同但序列不同的DNA片段分离的电泳方法,不同组成的DNA双链在含有不同浓度变性剂的聚丙烯酰胺凝胶中迁移率不同,通过变性剂梯度使长度相同但碱基排列不同的DNA片段停在凝胶的不同位置,从而呈现出不同条带[52]。DGGE法是分析复杂微生物体系的有效分子工具,被广泛应用于食品菌群结构的分析中,同时被用于分析发酵食物及肠道中微生物多样性的研究[53-54]。Nalepa等[55]利用PCR-DGGE方法对16S rRNA基因的高度可变区进行扩增,从而对原料乳和微生物群进行定性分析,测定了生乳中明串珠菌、短乳杆菌和植物乳杆菌含量;通过对干酪样品进行检测,揭示了明串珠菌、发酵乳杆菌和植物乳杆菌等细菌的广泛存在。
2.3.2 实时荧光定量PCR技术 实时荧光定量PCR检测(RT-qPCR)是指向反应体系中加入荧光基团,在PCR指数扩增期间通过连续监测荧光信号的强弱变化,实时监测特异性产物的量,与传统PCR检测技术相比,其自动化程度更高、动态范围更广[56]。近年来,RT-qPCR技术已成为试验中最常用的检测技术,在传统益生菌和下一代益生菌研究中均有所应用。Stachelska[57]采用RT-qPCR技术,对奶酪中的德氏乳杆菌和嗜热链球菌进行检测与计数,结果表明,该检测技术能够定量检测10~103CFU/g的产物,且计数结果与传统菌落计数相比差异不显著。在下一代益生菌鉴定中,秦倩倩等[58]建立了一种实时荧光定量检测粪便中阿克曼氏菌的方法,通过选择特异性高的引物及优化退火温度等实现了阿克曼氏菌的定量检测,检出限达102CFU/mL。
2.3.3 PMA-PCR技术 RT-qPCR技术虽然已被广泛应用于直接定量检测混合样品中的微生物,但其并不能区分活菌与死菌。活细胞和损伤细胞主要是靠细胞膜是否完整来判断,叠氮溴化丙锭(PMA)作为一种活菌染料,可以渗入受损或死亡的细胞,并在暴露于光下时共价结合到基因组DNA上,被结合的DNA无法进行PCR扩增,据此原理可实现对活菌的定量检测[59]。PMA-PCR技术不仅能够选择性地检测目标微生物的活菌数,而且保留了PCR技术的高灵敏度和强特异性,成为了检测样品中益生菌活菌数的有利方法[60]。段亮杰等[61]建立了一种PMA-qPCR法,针对发酵食品中常见的5种乳杆菌设计特异性引物,并优化了PMA处理条件,以增强PMA对死亡细胞或膜损伤细胞细胞膜的渗透性。此外,针对益生菌在冻干和储存过程中易受低温的影响使活力降低的问题,Shao等[62]建立了一种适用于保加利亚乳杆菌的PMA-PCR方法,该方法可有效检测德氏乳杆菌细胞活力,为冻干过程中冷冻保护剂的选择提供了依据。
2.3.4 dd PCR技术 目前PCR技术已发展到第3代,即数字 PCR,液滴式数字 PCR(dd PCR)是一种比较新的数字PCR方法,在核酸的精确定量方面具有独特优势。dd PCR技术是在进行扩增前,将反应体系分成数万个液滴,液滴可能不含有待扩增的目标基因,也可能含有1个或数个待扩增基因片段。经循环扩增后,读取每个液滴中的荧光信号,有荧光信号为1,无荧光信号为0,最后利用泊松分布的原理及阳性液滴的数量计算目标DNA的绝对数量。目前,dd PCR技术被应用于复杂样本中微生物准确定量检测,Gobert等[63]将PMA处理与dd PCR相结合,对仔猪粪便中的1株鼠李糖乳杆菌和2株副干酪乳杆菌亚种进行定量,揭示了样本中不同副干酪乳杆菌菌株之间的PMA效率差异。在有害微生物的存在下,PMA-dd PCR技术可用于少量活细菌细胞的特异性定量,且无需建立标准曲线。
2.4 核酸等温扩增技术
PCR技术是目前应用最为广泛的核酸体外扩增技术,但其需要使用热循环仪,制约了其应用。等温扩增和PCR的主要区别在于整个扩增反应在恒温下即可进行,大大简化了反应条件,此外,等温扩增过程中酶活性不受干扰,因此等温核酸扩增具有更高的扩增效率和更大的DNA产量[64]。近年来,等温扩增技术正逐渐成为替代PCR的最佳微生物检测方法。等温扩增技术的基本原理各不相同,已有10余种不同的等温扩增技术被应用于微生物检测中,其中LAMP技术以其检测速度快、灵敏度高和特异性强等优点在益生菌检测中有一定的应用,范一灵等[65]针对双歧杆菌属细菌16S rDNA基因特异性区段设计LAMP引物,根据反应体系的颜色或浊度变化特异性地检测样品中双歧杆菌属细菌,并在1 h内对产品中双歧杆菌属细菌进行了定性和初步定量,极大地缩短了检测时间。近年来不断涌现了更多更完善的新型等温扩增技术,为微生物中益生菌的等温扩增检测技术的出现奠定了基础[66]。
3 总结与展望
目前,食品及医药领域中含益生菌的各类产品较多,产品质量不一,而活菌的含量和种类与产品的质量密不可分,因此,建立一种快速检测益生菌的技术是十分必要的。文章介绍的各种检测技术各有其优缺点,相比之下,等温扩增技术的检测时间短且反应简单,适用于现场的快速检测,鉴于其高效性、小型化及自动化等优势,等温核酸扩增技术将会在微生物检测方面得到更广泛的应用,发展前景更为广阔,但其也存在易产生假阳性和假阴性的缺点,需进一步加强对此技术反应体系和反应条件的不断优化。
由于遗传信息的稳定性,分子生物学检测技术可以提供更为准确的细菌分类鉴定方法,使得分子生物学检测技术逐步取代传统的微生物检测方法。因此,结合不同分子生物学技术的特点,从基因表达水平上对微生物的鉴定与检测进行研究,尤其是将检测技术应用于微生物的实地筛查检测,是后续相关研究的主要趋势。此外,基于免疫反应发展起来的各类检测技术具有操作简便、检测速度快等优点,也是目前检测技术研究与开发中极重要的一方面,在未来的益生菌检测中具有极大的应用潜力。
