鱼皮胶原蛋白中透明质酸酶抑制肽的制备工艺优化
2021-12-04韩秋煜石崎松一郎
韩秋煜 - 石崎松一郎 包 斌
(1. 上海海洋大学食品学院,上海 201306;2. 东京海洋大学海洋技术研究科,日本 东京 1080075;3. 食品科学与工程国家级实验教学示范中心〔上海海洋大学〕,上海 201306)
低附加值的商品是鱼类副产物开发的主要目标市场,包括鱼粉[1]、肥料、宠物食品等廉价商品。因此,将鱼副产物进行高值化利用,减少海洋生物资源浪费和环境污染的同时也为食品行业提供更多潜在的受益[2]。由于陆生动物来源的胶原蛋白及其水解物会诱发疯牛病等疾病,存在使用风险[3],而含有30%~40%胶原蛋白的鱼类副产物则被认为是其良好的替代品[4-5]。剑鱼因鱼体较大,在加工过程中产生的大量废弃副产物(鱼皮)可为制备胶原蛋白提供丰富的原料来源。
透明质酸(Hyluronic acid,HA)是存在于细胞外基质中的糖胺聚糖,由N-乙酰葡糖胺和葡萄糖醛酸的重复单元组成[6]。当癌症、炎症、氧化应激发生时,细胞外基质的动态平衡被破坏,内源性高分子量HA被透明质酸酶和活性氧迅速降解,导致低分子量(≤250 kDa)的HA增加,刺激促炎细胞因子产生[7], 继而增加疾病发生的风险。因此HA的合成和降解之间的平衡是维护健康的重要因素。
肽活性的产生是由于其前体受外源酶水解或胃肠消化[8-9]。因其良好的生物活性、生物相容性和安全性[10-11],胶原蛋白肽已被广泛应用于抗高血压[12]、抗氧化[13]、抗肿瘤[14]和化妆品[15]等领域。Arunkumar等[16]研究发现,褐藻(S.tennerimum)叶片提取物中单宁含量较高,有较高的透明质酸酶抑制率(37.67±2.30)%。Aryani等[17]发现科兰当鱼尾鳍的乙酸乙酯提取物具有较好的透明质酸酶抑制性(IC50为4 mg/mL)及一定的抗过敏作用。但是有关鱼皮胶原蛋白肽的透明质酸酶抑制性研究较少,其提取工艺的优化尚未见报道。
试验拟以剑鱼鱼皮为原料,利用酶解法提取胶原蛋白中的胶原蛋白肽,通过响应面试验优化其提取工艺,并比较胶原蛋白肽粗提物和胶原蛋白透明质酸酶的抑制性,旨在为从剑鱼中提取具有潜在生物活性的胶原蛋白肽提供依据。
1 材料与方法
1.1 材料
剑鱼(Xiphiasgladius):将鱼体运入实验室后于4 ℃下保存至少6 h,分离鱼皮及鱼肉并切碎,处理后立即放入-85 ℃冰箱贮存,直至试验开始(剑鱼种类已由实验室进行鉴定,X.gladius),日本宫城县气仙沼市鱼市场;
蛋白酶、木瓜蛋白酶、三硝基苯磺酸、透明质酸、牛血清白蛋白、透明质酸酶、胃蛋白酶(1∶10 000)、氢氧化钠、乙酸、盐酸、氯化钠、三羟甲基氨基甲烷、异丙醇羟脯氨酸、氯胺T、ρ-二甲基氨基苯甲醛、异丙醇:日本大阪和光纯药工业株式会社;
胰蛋白酶、α-凝乳蛋白酶、胶原酶、L-亮氨酸、十二烷基硫酸钠:美国Sigma公司;
马弗炉:TMF-4000型,日本东京理化器械株式会社;
磁力搅拌器:RCH-1000型,日本东京理化器械株式会社;
冷冻离心机:CR22N21N型,日立株式会社;
冷冻干燥机:FD-1000型,日本东京理化器械株式会社。
1.2 原料理化成分分析
1.2.1 水分含量 采用比重法[18]。
1.2.2 粗蛋白含量 采用凯氏定氮法,计算时换算系数取6.25。
1.2.3 灰分含量 用马弗炉于550 ℃下焚烧16 h。
1.3 胶原蛋白提取
将鱼皮或鱼肉均质后,于0.1 mg/mL的NaOH中浸泡48 h以脱去非胶原蛋白,过滤清洗至中性,将固形物置于10%异丙醇中36 h以脱脂,每隔6 h更换浸泡液。将脱脂和脱非胶原蛋白的鱼皮或鱼肉清洗至中性,以m鱼皮或鱼肉∶V醋酸溶液为1∶40 (g/mL)于含有质量分数0.1%胃蛋白酶的0.5 mg/mL醋酸溶液中浸泡48 h,10 000 r/min离心60 min。将NaCl加入上清液中进行盐析,至终质量浓度为1.2 mg/mL,并保存过夜。10 000 r/min离心60 min,将沉淀以1∶10 (g/mL)完全溶解于0.5 mg/mL醋酸溶液中,用0.1 mg/mL NaOH溶液调节pH值至7,加入NaCl至终质量浓度为2.4 mg/mL后保持过夜。4 ℃、12 000 r/min离心40 min,收集沉淀物并于0.5 mg/mL醋酸溶液中复溶,用2.4 mg/mL NaCl盐析出的沉淀物即为酶溶性胶原蛋白(PSC)。将胶原蛋白溶于0.5 mg/mL醋酸溶液中,先使用0.1 mg/mL醋酸溶液透析24 h,用冷蒸馏水透析至少48 h。PSC溶液冻干后于-25 ℃保存。
1.4 聚丙烯酰胺凝胶电泳(SDS-PAGE)
根据Laemmli[19]的方法稍作修改。将胶原蛋白样品溶于0.5 mg/mL的醋酸溶液中,使其终质量浓度为2 mg/mL,85 ℃孵育1 h,25 ℃、5 000 r/min离心5 min,除去不可溶解的碎片。上清液置于β-巯基乙醇中,与2倍浓度上样缓冲液(60 mmol Tris-HCl,pH 8.0,含25%甘油、2% SDS、0.1% 溴酚蓝)以V上清液∶V缓冲液为1∶1混合。在7.5%解析凝胶和4%堆积凝胶上进行SDS-PAGE。用质量分数为0.1%的考马斯亮蓝R-250染色25 min,并使用微波法脱色。
1.5 水解度测定
采用TNBS法[20]。
1.6 透明质酸酶抑制试验
根据Meyer[21]的方法稍作修改。将25 μL样品与25 μL 30 U/mL的透明质酸酶溶液混匀,37 ℃孵育10 min。加入50 μL质量分数为0.04%的透明质酸溶液(溶解于0.15 mg/mL NaCl—0.01 mg/mL磷酸缓冲液中,pH 5.3),37 ℃孵育45 min。加入900 μL牛血清白蛋白(2.5 mg/mL),室温静置10 min,于540 nm处测定吸光度。以超纯水和单宁酸分别作为阴性、阳性对照,所有试验测定3次。按式(1)计算抑制率。
(1)
式中:
R——抑制率,%;
S——样品吸光度;
Sb——不含透明质酸酶的样品空白的吸光度;
C——对照的吸光度;
Cb——不含透明质酸酶的对照空白的吸光度。
1.7 胶原蛋白酶解响应面优化
根据单因素试验结果,选择具有较大影响的复合酶比(m胶原蛋白酶∶m蛋白酶)、酶解温度和酶解时间作为因素,以透明质酸酶抑制率作为响应因素,根据Box-Behnken原理优化胶原蛋白酶解工艺条件。
1.8 数据处理
采用Office 365和SPSS 8.0软件对数据进行处理及绘图;运用Design-Expert 8.0.6软件进行响应面试验设计与分析。
2 结果与分析
2.1 成分分析
由表1可知,鱼肉中的水分和蛋白质含量均显著高于鱼皮(P<0.05),但灰分含量占鱼皮的10.60%(1.73 g/100 g)。产于西班牙的剑鱼(X.gladius)鱼皮中的水分、蛋白质、灰分含量分别为42.87,16.28,2.49 g/100 g[22],而捕于广西钦州的野生马面鱼(Navodonseptentrionalis)其粗蛋白含量(15.75%)[23]低于宁波产的(36.73%)[24],说明鱼种及生活水域影响鱼类的基本理化成分。异丙醇羟脯氨酸也可以作为量化某一组织中胶原蛋白含量的参数[25]。假设组织中的异丙醇羟脯氨酸含量全部由胶原蛋白提供,以每100 g样品中含有11.2 g和10.9 g异丙醇羟脯氨酸作为鱼皮和鱼肉胶原蛋白的计算指标,剑鱼鱼皮中的胶原蛋白含量最高(11.03 mg/100 g),但低于鳕鱼皮(58.5 mg/100 g)[26]。此外,鱼皮中异丙醇羟脯氨酸含量(0.99 mg/g)显著高于鱼肉(0.09 mg/g)(P<0.05)。从软骨中提取的大眼鲷的异丙醇羟脯氨酸含量为5.71 mg/g,但鱼皮的为19.5 mg/g[27],表明鱼体中不同部位含有的异丙醇羟脯氨酸含量不同。鱼类之间胶原蛋白含量的差异可能取决于鱼的种类、环境[26]和鱼体部位。

表1 鱼皮和鱼肉组分分析†
2.2 SDS-PAGE图谱
由图1可知,鱼皮和鱼肉PSC提取物的电泳图谱相似,均由2α1和α2链组成,并含有微量的β链。由于α3(I)的电泳迁移位置与α1(I)相同,因此无法确认α3链的存在[28-29]。根据电泳迁移率和亚单位组成,认为图1所示的剑鱼鱼皮中提取的胶原蛋白为PSC-I。α1(I)链(130 kDa)和α2(I)链(120 kDa)的分子量略高于从鲤鱼皮中分离的ASC-I (120,116 kDa)[30],但与尼罗罗非鱼皮中分离的ASC-I和PSC-I分子量相近[31],说明物种的不同影响了分子量。此外,剑鱼中提取的PSC-I对胃蛋白酶的敏感性较高,表现为鱼肉来源的胶原蛋白存在多个低于100 kDa的弱α亚单位。正常情况下,在胶原蛋白的SDS-PAGE模式中可观察到β带和γ带。但图1中的β带强度较低,所提胶原蛋白交联度较低。而交联度的变化可能是由于捕捞季节的不同,饥饿的鱼含有更高的高交联胶原蛋白(高分子量)[25,29]。
2.3 胶原蛋白酶解工艺优化
2.3.1 水解度与透明质酸酶抑制率的相关性分析 由图2可知,水解度与透明质酸酶抑制率的相关指数为0.719(P>0.001),非常显著,可以确定透明质酸酶抑制率与水解度之间存在显著正相关性,说明在一定范围内,胶原蛋白肽的水解度越高,透明质酸酶抑制率越高,二者呈线性关系。因此,仅选择透明质酸酶抑制率作为响应面优化设计的相应指标,也可以得到具有较高可信度的结果。
2.3.2 响应面回归模型的建立及方差分析 在单因素试验的基础上,以复合酶比(m胶原蛋白酶∶m蛋白酶)、酶解温度和酶解时间为影响因素,以透明质酸酶抑制率为响应值,采用Box-Behnken设计对胶原蛋白酶解工艺进行优化,试验因素和水平见表2,试验设计及结果见表3。由表3可知,胶原蛋白肽的透明质酸酶抑制率为18.98%~41.93%,最佳抑制率高于从鱿鱼中提取的胶原蛋白肽(32.21%)[32],但低于蚕茧提取物(约52%)[33]。

M. 蛋白标品 1. 鱼皮胶原蛋白 2. 鱼肉胶原蛋白图1 剑鱼中PSC-I的SDS-PAGE图谱Figure 1 SDS-PAGE pattern of PSC-I derivedfrom swordfish
利用线性项和二次项的回归系数对表3进行多元回归拟合,得透明质酸酶抑制率与各酶解条件的二次回归方程为:
Y=40.12+1.91A-2.98B+1.57C-0.42AB-9.01AC+2.87BC-6.80A2-8.09B2-2.85C2。
(2)
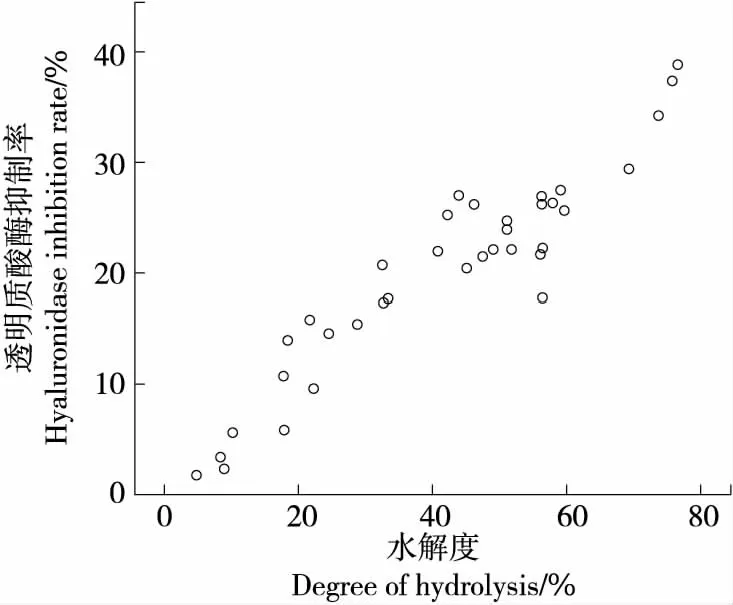
图2 水解度与透明质酸酶抑制率的相关性分析Figure 2 Correlation analysis of DH and HAaseinhibition rate

表2 响应面分析因素和水平Table 2 Response surface analysis factors and levels

表3 Box-Behnken试验设计及结果
由表4可知,模型F值为23.22,拟合性显著[34];失拟项P值为0.252 5>0.05,不显著[35]。因此,该模型的拟合值可以用来分析胶原蛋白肽的最佳水解条件。方差分析结果表明透明质酸酶抑制率受酶解时间的影响比酶解温度和复合酶比的更显著。
2.3.3 响应面交互分析 由图3可知,BC的响应面陡峭,说明酶解温度和酶解时间的相互作用显著;酶解时间和复合酶比有相对显著的交互作用,而酶解温度与复合酶比的交互作用相对较弱。
2.3.4 最佳工艺验证 根据响应面分析,从剑鱼鱼皮中得到PSC-I肽的最佳工艺条件为复合酶比(m胶原蛋白酶∶m蛋白酶)7.98∶2.02,酶解温度31.70 ℃,酶解时间6.00 h。在此工艺条件下,理论预测I型胶原蛋白肽的透明质酸酶抑制率为41.06%。为方便操作,将最佳条件修正为复合酶比(m胶原蛋白酶∶m蛋白酶)8∶2,酶解温度32 ℃,酶解时间6 h,此条件下的透明质酸酶抑制率为(42.35±0.06)%(n=3),与理论预测值的相对误差仅3.05%,说明建立的模型与实际较为吻合。经优化后,胶原蛋白的透明质酸酶抑制率显著高于阴性对照(2.32%)(P<0.05),但仅为阳性对照的0.51倍。由于粗肽的纯度不高,各肽段由于C端和N端的氨基酸序列不同,出现抑制作用。因此,该粗肽需进一步纯化筛选,以获得更高的透明质酸酶抑制活性。
3 结论
对剑鱼皮中I型胶原蛋白进行提取后,利用响应面法优化得到具有透明质酸酶抑制活性的胶原蛋白肽的最佳酶解条件为复合酶比(m胶原蛋白酶∶m蛋白酶)8∶2,酶解温度32 ℃,酶解时间6 h,此条件下的透明质酸酶抑制率为(42.35±0.06)%(n=3),与理论预测值的相对误差为3.05%,说明建立的模型与实际较为吻合。但是胶原蛋白肽对透明质酸酶的抑制机理仍没有充分研究,因此对该活性肽的进一步纯化和表征,并分析其抑制机理将是下一步研究的方向。
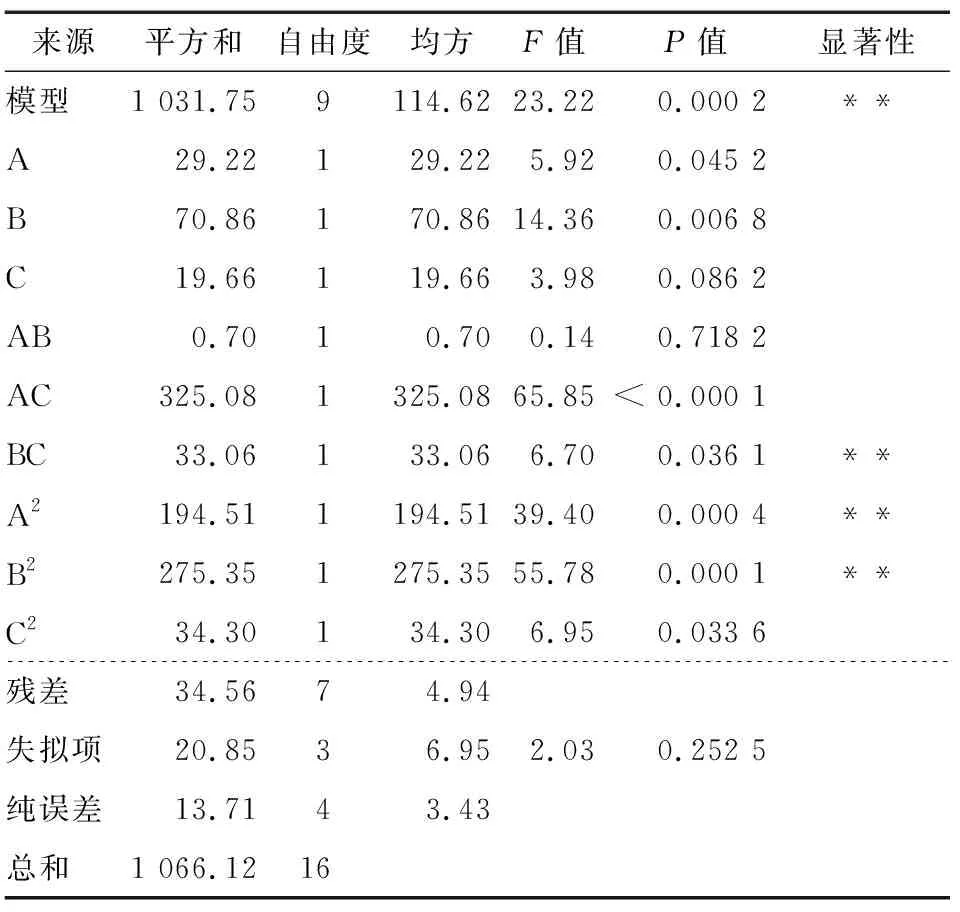
表4 回归模型的方差分析†
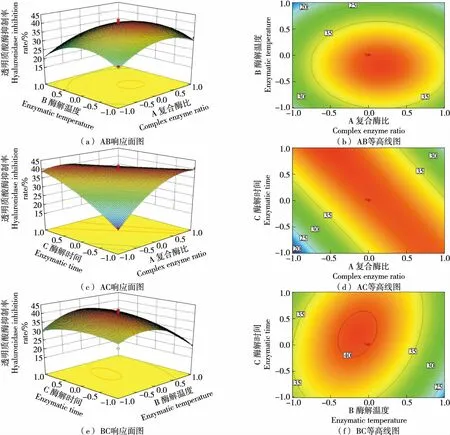
图3 各因素交互作用的响应面及等高线图Figure 3 Response surface and contour plots of interactive effects
