米诺环素抑制5-脂氧合酶对未控制失血性休克大鼠肝组织的保护作用
2021-12-04郑强温天明舒其琛杨虎翟祥龙刘世平
郑强 温天明 舒其琛 杨虎 翟祥龙 刘世平
1成都市第一人民医院急诊科(成都 610000);2川北医学院附属医院急诊科(四川南充 637000)
米诺环素(Minocycline,MC)是一种半合成的第二代四环素衍生物,它除了良好的抗菌作用外,还具有抗炎、抗凋亡、抑制基质金属蛋白酶、清除氧自由基、免疫抑制等其它作用,在多种脏器缺血再灌注损伤中发挥了组织细胞保护作用,减轻了组织缺血再灌注损伤[1]。已有研究表明在失血性休克大鼠模型中用MC 可明显减轻休克引起的细胞坏死、凋亡与氧化应激等,但具体机制不完全清楚[1]。有研究发现MC 可抑制5-脂氧合酶(5-LOX)的表达及其活性、进而抑制LTs、LTB4 等的生成,减轻中性粒细胞浸润[2]。而使用抑制5-LOX 抑制剂MK-886 可减少缺血再灌注后内脏器官损伤[3]。据此推测MC 可通过抑制5-LOX 的表达,抑制炎症反应,从而发挥脏器保护作用。
1 材料与方法
1.1 动物分组及SD 大鼠失血性休克模型的制备动物分组:选用250 ~300 g 的SD 大鼠(由川北医学院动物实验中心提供),使用1%戊巴比妥钠35 mg/kg 腹腔内注射麻醉,固定,碘伏消毒,外科手术分离右股动、静脉并置管,股动脉连接三通管后接压力转换器(Pclab-530C 生物医学信号采集系统)、计算机行持续血流动力学监测和抽血,股静脉用于输液。置管成功后分为:假手术组(空白组)10 只:仅作置管观察。液体复苏组(对照组)10只:复苏时静脉给予相应的生理盐水。MK-886 组(实验组1):复苏时静脉给予MK-886(使用DSMO溶解后生理盐水稀释)1.2 mg/kg。米诺环素组(实验组2)10 只:复苏时静脉给予米诺环素20 mg/kg。
未控制失血性休克模型的制备[1]分为4 期:(1)未控制创伤性失血性休克模型建立:模拟院前急救人员到达之前期(0 ~0.5 h),使MAP 控制在30 ~35 mmHg:通过股动脉导管抽取血液及断尾复制未控制休克大鼠模型。(2)止血前液体复苏期:模拟院前急救期(0.5 ~1.5 h):通过股静脉通道给予上述药物后以乳酸林格氏液进行液体复苏,同时予以断尾失血,使MAP 控制在50 ~60 mmHg。(3)止血及液体复苏期:模拟院内救治期(1.5 ~3.5 h[2]):予以手术止血、血液回输及乳酸林格氏液复苏,目标MAP ≥80 mmHg。(4)标本收集(3.5 ~24 h):拔出动静脉置管,放回鼠笼,自由饮食,24 h 后采集血液标本后处死采集肝脏组织。
1.2 标本处理与指标检测
1.2.1 数据与标本收集(1)死亡率;(2)0-0.5 h失血量;断尾失血量(5 mL 烧杯测量);(3)平均动脉压(MAP)、心率(HR):0、0.5、1.5、2.5、3.5 h(Pclab-530C 生物医学信号采集系统)采集;(4)0.5 ~1.5 h 输液量(微量输液泵输入);(5)Elisa 法检测血3.5 h TNF-α、IL-6、肝组织LTs、LTB4 和5-LOX;(6)肝组织一部分用10%甲醛溶液固定,石蜡包埋后备病理组织学检查,另一部分制成匀浆,用比色法检测丙二醛(MDA)、TBA 法检测髓过氧化物酶(MPO)分析;(7)全自动生化分析仪(日立7600 型)检测血3.5 h 谷丙转氨酶(ALT)、谷草转氨酶(AST)水平。
1.2.2 TNF-α、IL-6、ALT、AST 的检测标本检测均为抽取SD 大鼠1 mL 全血后分离血清获得。取一部分定量肝组织碾磨并生理盐水定量稀释后测定MDA、MPO、LTs、LTB4 和5-LOX。取小块肝组织,于10%甲醛溶液中固定24 h,逐级乙醇脱水、二甲苯浸泡、浸蜡、石蜡包埋、切片、附贴、HE 染色后由我院病理科2 位有经验的病理学医生采用双盲法对每个标本进行分析。注:米诺环素、MK-886、IL-6、MPO、LTs、LTB4 和5-LOX 试剂盒购自武汉六合生物技术有限公司;MDA 试剂盒购自南京建成科技有限公司;ALT、AST 试剂盒购自四川迈克科技有限公司。以上标本的检测均按照操作说明书进行并严格遵守各实验室标准操作规程。
1.3 肝缺血再灌注损伤的Suzuki′s 病理学评分标准见表1。

表1 IRI 的Suzuki′s 病理学评分标准Tab.1 Suzuki′s pathological scoring criteria for IRI
1.4 统计学方法计量资料数据用均数±标准差表示,均数间差异比较用单因素方差分析。计数资料的数据进行χ2检验,P<0.05 为差异有统计学意义。所有统计均采用SPSS 25.0软件包进行分析。
2 结果
2.1 基本资料在未控制失血性休克SD大鼠模型的基本资料如MAP 及HR 由Pclab-530C 生物医学信号采集系统采集,见图1。空白组、对照组、实验组1 与实验组2 死亡率分别为0、50%、30%与20%,两两比较差异有统计学意义(P<0.05);0.5~1.5 h 补液量分别为0、(8.7 ± 2.9)、(7.5 ± 3.0)与(6.1 ± 1.9)mL,两两比较差异有统计学意义(P<0.05),见表2。
表2 各组的基本实验资料Tab.2 Basic experimental data of each group±s
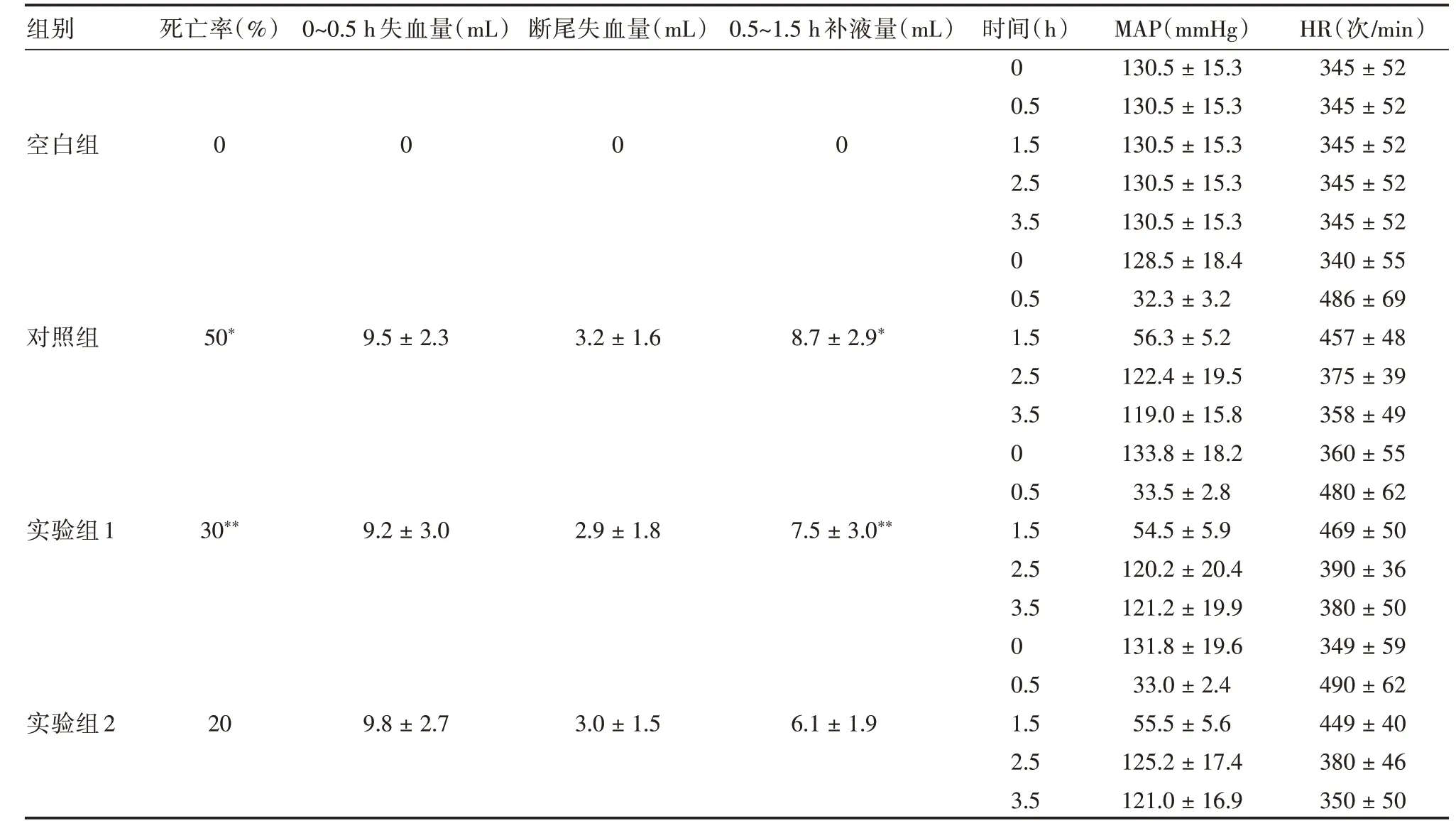
表2 各组的基本实验资料Tab.2 Basic experimental data of each group±s
注:对照组分别与实验组1 和实验2 比较,*P <0.05;实验组1 与实验组2 比较,**P <0.05
h 失血量(mL)断尾失血量(mL)0.5~1.5 h 补液量(mL) 时间(h)MAP(mmHg)HR(次/min)0130.5±15.3345±52 0.5130.5±15.3345±52 0 0 0 1.5130.5±15.3345±52组别空白组对照组实验组1实验组2死亡率(%)0 50*30**20 0~0.5 9.5±2.3 9.2±3.0 9.8±2.7 3.2±1.6 2.9±1.8 3.0±1.5 8.7±2.9*7.5±3.0**6.1±1.9 2.5 3.5 0 0.5 1.5 2.5 3.5 0 0.5 1.5 2.5 3.5 0 0.5 1.5 2.5 3.5 130.5±15.3 130.5±15.3 128.5±18.4 32.3±3.2 56.3±5.2 122.4±19.5 119.0±15.8 133.8±18.2 33.5±2.8 54.5±5.9 120.2±20.4 121.2±19.9 131.8±19.6 33.0±2.4 55.5±5.6 125.2±17.4 121.0±16.9 345±52 345±52 340±55 486±69 457±48 375±39 358±49 360±55 480±62 469±50 390±36 380±50 349±59 490±62 449±40 380±46 350±50
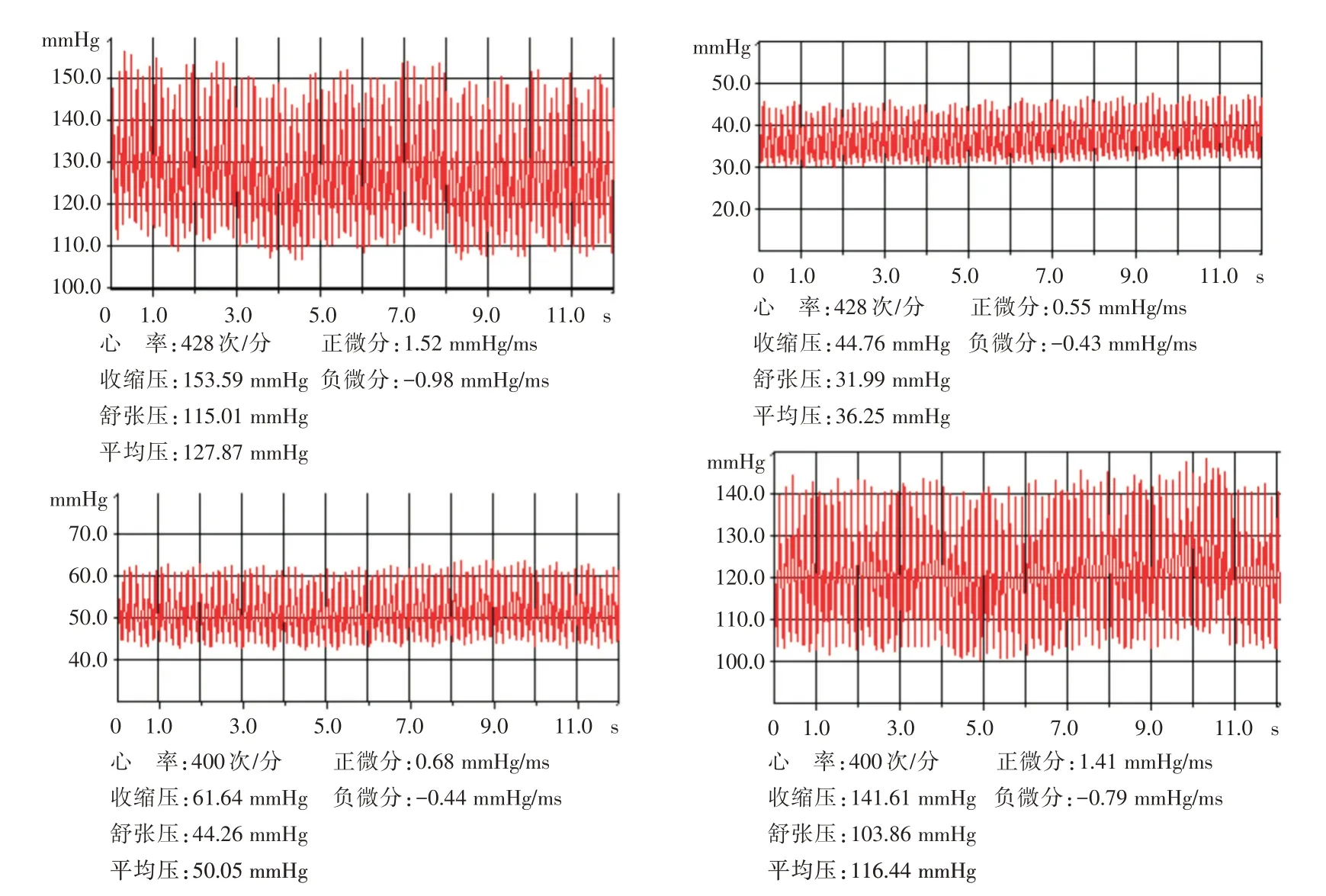
图1 实验组1、实验组2 及对照组未控制失血性休克模型血压和心率电脑采集图(Pclab-530C 生物医学信号采集系统)Fig.1 Computer images of blood pressure and heart rate of uncontrolled hemorrhagic shock models in experimental group 1,experimental group 2 and control group(PCLAB-530C biomedical signal acquisition system)
2.2 各组的TNF-α、IL-6 及肝功的变化实验组2 TNF-α、IL-6 含量明显低于实验组1 与对照组(P<0.05),实验组1与对照组比较(P>0.05);而实验组1 肝功能(ALT、AST)与实验组2 比较差异无统计学意义(P>0.05),实验组1 与对照组比较,差异有统计学意义(P<0.05)。见表3。
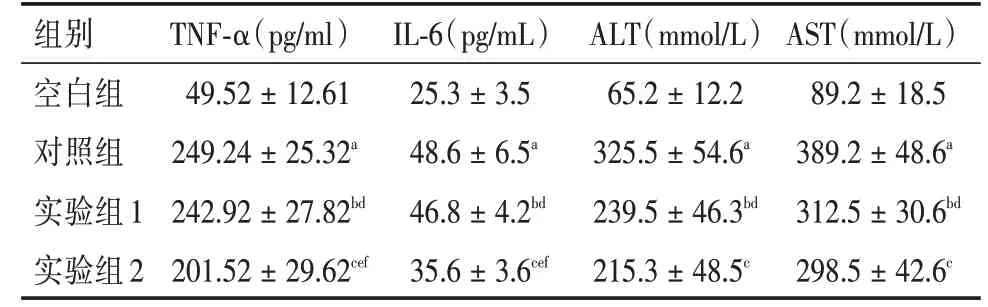
表3 各组TNF-α、IL-6、ALT、AST 值Tab.3 TNF-α,IL-6,ALT and AST values in each group x±s
2.3 各组肝脏组织LTs、LTB4和5-LOX的变化实验组1 与实验组2 肝脏组织LTs、LTB4、5-LOX 值明显低于对照组(P<0.05);且实验组1 与实验组2比较差异无统计学意义(P>0.05)。见图2。
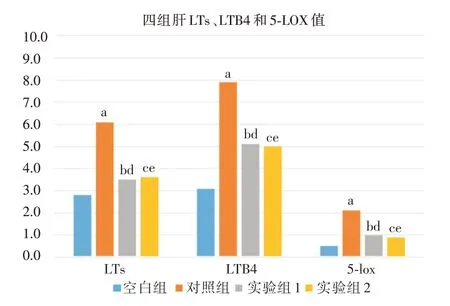
图2 各组肝LTs、LTB4 和5-LOX 的变化Fig.2 Changes of liver LTS,LTB4 and 5-LOX in each group
2.4 各组肝组织MDA 及MPO 的变化空白组肝组织MDA 及MPO 值均低于对照组、实验组1 及实验组2(P<0.05);对照组肝组织MDA 及MPO 值均高于实验组1 及实验组2(P<0.05)。见表4。

表4 各组肝组织MDA 及MPO 值Tab.4 MDA and MPO values in liver tissue of each group x±s
2.5 各组肝组织病理切片对照组较实验组2 和实验组1 肝细胞浑浊肿胀明显,肝细胞大片状变性坏死,大部分肝小叶组织结构破坏,炎性细胞浸润明显。见图3。

图3 各组肝组织病理切片(HE,×200)Fig.3 The pathological sections of liver tissue in each group were stained by(HE,×200)
2.6 各组肝组织的Suzuki′s 病理学评分对照组肝组织的Suzuki′s 评分值(5.60±1.58)高于实验组1(3.35 ± 0.89)和实验组2(3.29 ± 0.92),差异有统计学意义(P<0.05);实验组1 与实验组2 肝组织的Suzuki′s 评分值比较差异无统计学意义(P>0.05)。
3 讨论
创伤失血性休克的处理主要在于早期的液体复苏,恢复机体有效血容量,满足组织的灌注,阻止器官组织缺血坏死[4-7]。然而,在液体复苏时,往往引起组织再灌注损伤。组织产生大量的氧自由基,氧自由基可作为信息分子,广泛激活炎症系统,导致全身炎症反应综合症(systemic inflammatoryresponse syndrome,SIRS),引起循环衰竭和器官损伤,进一步发展可导致多器官功能障碍综合症(multiple organ dysfunction syndrome,MODS)甚至多器官功能衰竭(multiple organ failure,MOF)发生[8-11]。因此早期复苏的效果及炎症反应的控制直接决定了创伤后多器官功能不全综合征、多器官功能衰竭的发生率。如何防治器官缺血再灌注损伤是救治失血性休克、治疗并预防MODS、提高患者生存率的重要临床问题。米诺环素是一种半合成的第二代四环素衍生物,它除了良好的抗菌作用外,还具有抗炎、抗凋亡、抑制基质金属蛋白酶、清除氧自由基、免疫抑制等作用。研究表明[12-14],米诺环素在多种脏器如脑、心、肺、肝等缺血再灌注损伤中发挥了组织细胞保护作用,减轻了组织缺血再灌注损伤。然而其机制有待进一步明确。
TNF-α、IL-6 能够诱导多种促炎介质,如细胞因子和趋化因子,并最终导致广泛的炎症反应,进而损伤细胞及组织器官[15]。ALT 及AST 主要反映肝功能指标,当肝功能受损时ALT 及AST 则与损伤程度呈正相关。本研究结果显示,在TNF-α、IL-6、ALT、AST 值的比较中,对照组与实验组1 及实验组2 分别比较,差异均有统计学意义,说明米诺环素与和5-LOX 抑制剂MK-886 均可抑制TNF-α 及IL-6,保护肝肾等多个器官。实验组2 TNF-α、IL-6值低于实验组1,但实验组1 肝功能(ALT、AST)与实验组2 比较差异无统计学意义,说明米诺环素与MK-886 在未控制失血性休克模型中对肝脏具有等同的保护作用,但米诺环素对除肝脏外的器官保护作用要优于MK-886。
5-LOX 不仅参与肿瘤及癌症的发生发展,还与炎症反应中的促炎因子的释放密切相关[16]。MDA与MPO 不但与人类多种疾病的发生、发展密切相关,还参与调节炎症反应的许多过程,在炎症反应中大量的MDA 与MPO 聚集在炎症部位而发生氧化反应,进而形成大量的超氧化物和氧化物,最终造成炎症部位组织细胞损伤[17]。本研究结果显示,对照组与实验组1 及实验组2 分别比较MDA及MPO 值有明显差异,说明米诺环素与MK-886 均可抑制MDA 及MPO,保护肝肾等多个器官。但实验组1 除肝脏组织MDA 及MPO 值与实验组2 肝脏组织MDA 及MPO 值相近。但对照组与实验组1肝组织5-LOX、LTs 和LTB4 值及实验组2 分别比较差异有统计学意义,实验组1 与实验组2 比较,差异无统计学意义,说明米诺环素与MK-886 在未控制失血性休克模型中对肝脏均具有保护作用。肝组织的Suzuki′s 评分值也印证了上诉说法,说明米诺环素可能与MK-886 一样,通过抑制5-LOX 发挥抗炎作用,从而发挥组织保护作用。
肝组织病理切片显示对照组较实验组2 和实验组1 肝细胞浑浊肿胀明显,肝细胞大片状变性坏死,大部分肝小叶组织结构破坏,炎性细胞浸润明显。以上病理进一步说明了米诺环素与MK-886 在未控制失血性休克模型中对肝脏具有保护作用。本研究显示米诺环素与MK-886 在未控制失血性休克模型中对肝脏保护的同时明显降低了病死率。
综上所述,在未控制失血性休克模型中MC 与5-LOX 抑制剂MK-886 一样可通过抑制5-LOX 进而抑制LTs、LTB4、TNF-α、IL-6、MAD 和MPO 等炎症介质和细胞因子,减轻缺血再灌注后器官组织和细胞的损伤,进而降低死亡率。为院前及院内急救使用米诺环素救治创伤性失血性休克所致的多器官衰竭的早期预防和治疗提供新的思路和实验依据。
