四氯化硅氢化关键反应的密度泛函理论模拟研究
2021-12-04王虎虎彭文才张建树张金利
王虎虎,彭文才,张建树,张金利,2*
(1石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,新疆 石河子 832003;2天津大学化工学院,天津 300072)
电子级多晶硅被广泛应用于电子信息、半导体工业和太阳能产业。目前,世界上多晶硅生产工艺主要利用改良西门子法,该法每生产1 t多晶硅副产11~20 t四氯化硅(SiCl4,STC)。对STC进行回收利用,不仅利于环境保护而且避免资源浪费[1-4]。其中将STC进行加氢生产三氯氢硅(SiHCl3,TCS)等中间产物并进一步用于生产多晶硅,可实现闭环生产和清洁利用[5-7]。目前,STC氢化主要有冷氢化、热氢化和等离子氢化3种工艺[8-11]。无论哪种工艺,STC与氢气反应生成三氯氢硅、二氯硅烷、一氯硅烷和硅烷等反应均是工艺的核心。然而,目前关于STC氢化所涉及反应的研究尚不成熟,尤其是对反应机理的理解并不透彻。
本文利用Gaussian软件在B3LYP方法和6-311+G(2d,p)基组条件下,对STC氢化所涉及反应的能量变化、活化能垒进行计算,得到相关热力学和动力学参数,提出了合理的反应路径,以期为该过程的工艺优化和工业化开发提供依据。
1 计算方法
本文采用Gaussian16量子化学计算程序包,利用密度泛函理论(Density Functional Theory,DFT)方法在B3LYP/6-311+G(2d,p)水平上优化反应物、产物和自由基。利用TS(Berny)方法获取过渡态并保证有且只有一个虚频,同时通过内禀反应坐标(Intrinsic Reaction Coordinate,IRC)方法验证反应通道中反应物、过渡态和产物的连接关系,以证明过渡态的正确性。所有能量均提取软件计算的势能(HF),并以字母E表示,单位统一换算为kJ/mol。定义ΔE为化学反应过程中的能量变化,计算式为式(1);定义DE为化学键离解为双自由基所需的能量,计算式为式(2);定义EA为反应过渡态和反应物之间的能量差,计算式为式(3)。各反应以R加序号表示,所涉及的过渡态用TS加对应序号表示。
ΔE=∑E产物-∑E反应物,
(1)
DE=∑E自由基-∑E分子,
(2)
EA=E过渡态-∑E反应物。
(3)
2 结果和讨论
2.1 表观反应能量变化
四氯化硅氢化反应的一种初始产物为三氯氢硅(可以看作四氯硅烷中的一个氯原子被氢气中的氢原子取代),另一种产物为氯化氢。后续会进行一系列连串的取代反应,生成二氯氢硅、一氯氢硅和硅烷。
该体系所涉及的系列反应及其反应能量变化如表1所示。由表1可见:该体系所涉及的反应均是吸热的,需要不断由外界提供能量才能顺利进行。其中生成三氯氢硅的R1吸热量最低,为50.46 kJ/mol,后续的三步生成二氯氢硅、一氯氢硅和四氯硅烷的R2~R4吸热量均超过60 kJ/mol,因而从热力学平衡角度讲,R1更为有利;R5为R1~R4的总反应,吸热236.48 kJ/mol。因此,从化学工程角度看,该体系不能依靠自生热推动反应持续进行。
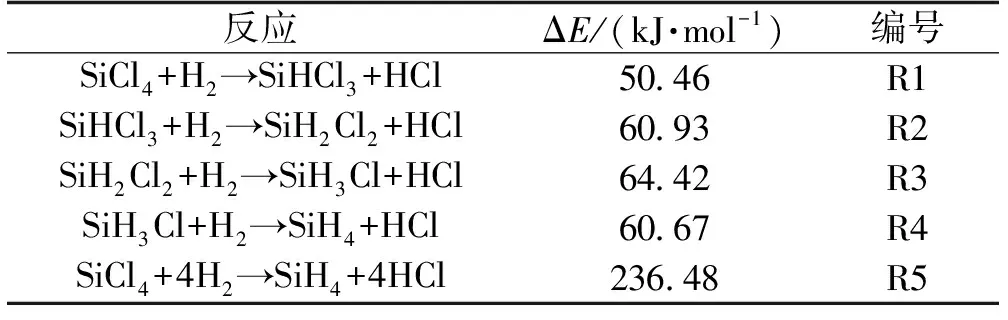
表1 四氯化硅氢化过程表观反应及过程能量变化
2.2 化学键离解能
该过程所涉及的反应均为典型的自由基反应,其发生与各步反应物和产物的断键及成键能量紧密相关,本文计算结果如表2所示,从表2中可获取原料链引发和产物链终止的能量。
由表2可见:原料四氯化硅的Si—Cl键能和氢气的H—H键能分别为414.02kJ/mol和460.14kJ/mol,由于链式反应倾向于从最弱的键的断裂开始,所以由SiCl4断裂形成氯原子(Cl)和三氯硅自由基(SiCl3)将是链引发的主反应。在链终止阶段,自由基与自由基互相结合形成产物,其中键能较强的产物形成后不容易断裂,将成为主产物;而键能较弱的产物,尤其比SiCl4中Si—Cl键键能低很多的产物基本不会生成,如Cl2(221.79kJ/mol)和SiCl3-SiCl3(275.98kJ/mol),或生成后容易重新裂解,直到形成更稳定的产物。这与文献中关于产物分布的实验结果一致[12-13]。
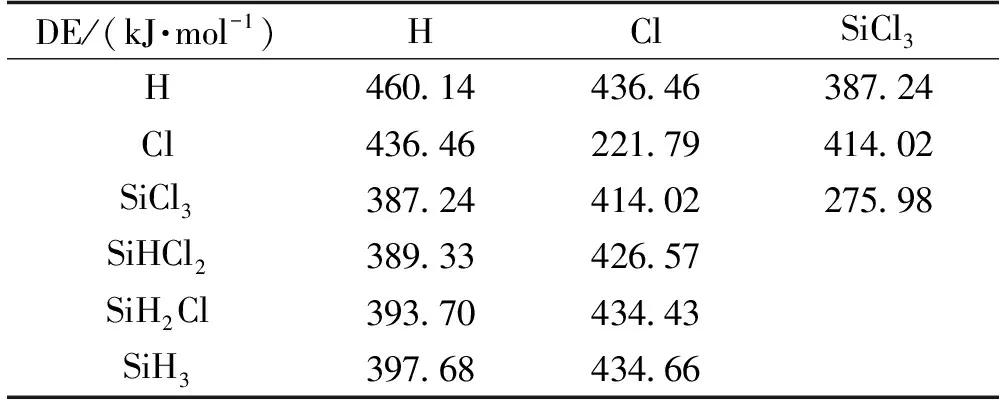
表2 四氯化硅氢化过程涉及的自由基及解离能
2.3 反应机理
反应机理详细描述了化学反应所涉及的每步基元反应化学键断裂和形成及其能量变化,这对于复杂化学反应的分析和实验条件的确定至关重要。四氯硅烷的氢化反应遵循连锁自由基反应机理,包括引发、扩展和终止三个典型阶段。表3列出了四氯化硅氢化过程中所涉及的基元反应及其能量变化和相应的活化能。该步骤产生了三氯硅自由基和氯原子两个活泼物种,用来引导后续反应的发生。
链扩展反应涉及自由基与分子之间的诸多反应,表3中给出了各自的能量变化和活化能计算结果。下面分析与表2中R1,也就是生成三氯氢硅的反应所涉及的基元反应。链引发后产生的氯原子和三氯硅自由基均可能进攻氢气,并夺取其中一个氢原子生成氯化氢(R7)和三氯氢硅(R8)以及氢原子,两个反应的ΔE均为正值,表明其在热力学上是不利的。由于R7的活化能低于R8,单纯从这一步来看,反应更倾向于按照R7发生。然而,链式反应需要氢原子与四氯化硅继续反应从而使氯原子(R9)或三氯硅自由基(R10)再生才能持续循环下去。R9和R10的反应物相同(均为H和SiCl4),但产物和反应历程有很大差别。R9中H原子直接进攻SiCl4中的Si原子,得到SiHCl3分子和Cl原子。而R10中H原子夺取SiCl4中的Cl原子,得到SiCl3自由基和HCl分子。两反应所涉及的过渡态TS9和TS10的结构如图1所示。
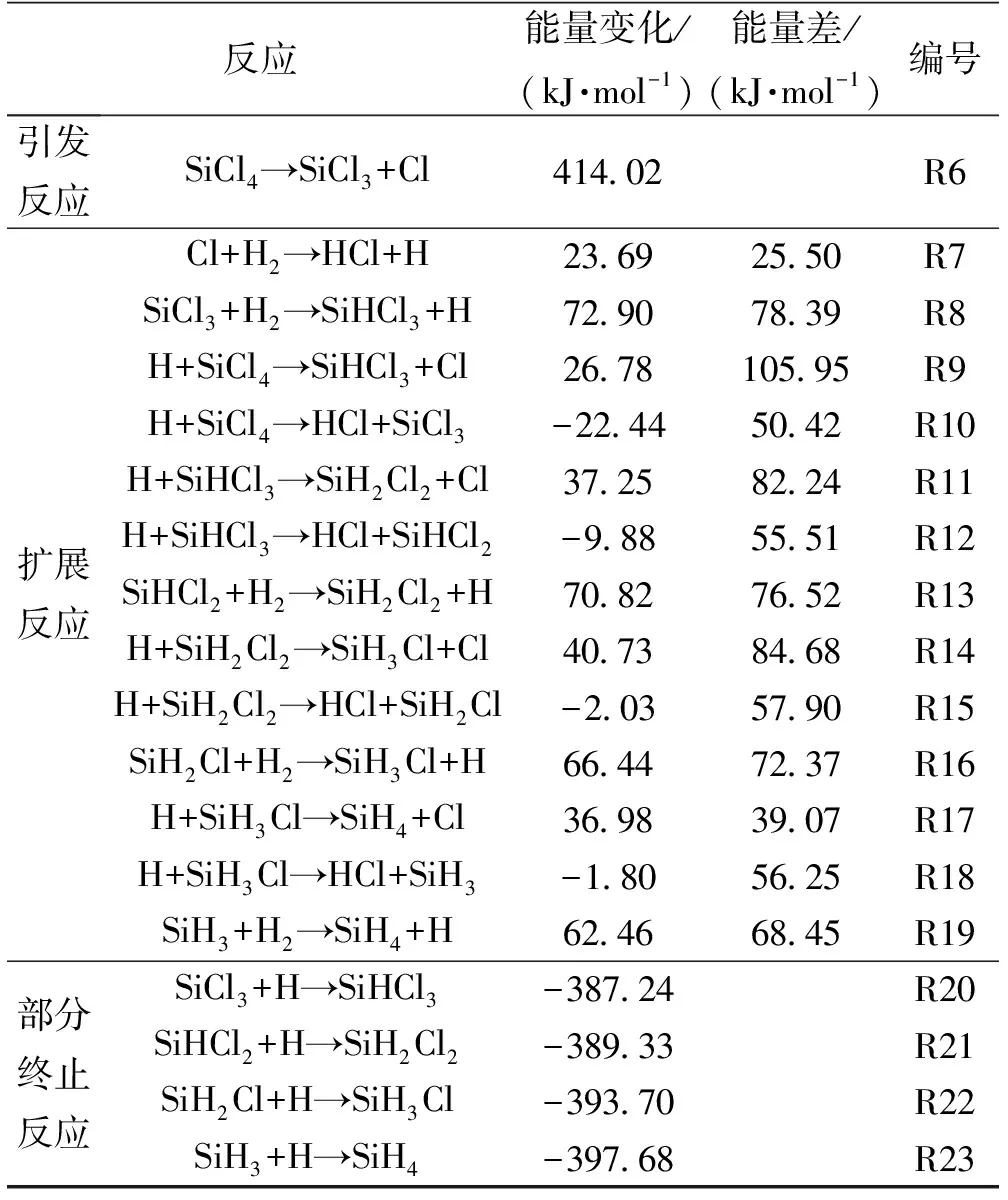
表3 四氯化硅氢化过程基元反应过程能量变化及过渡态与反应物能量差
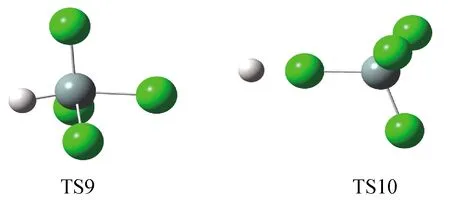
白球—H,灰球-Si,绿球—Cl
尽管反应R10是放热的,但是不足以抵偿反应R8的吸热量,因而该反应需要源源不断由外界供给能量才能顺利进行。这两种反应路径分别经过R7至R9和R8至R10完成循环,其势能图绘制于图2当中(其中TS7至TS10分别为各反应的过渡态)。
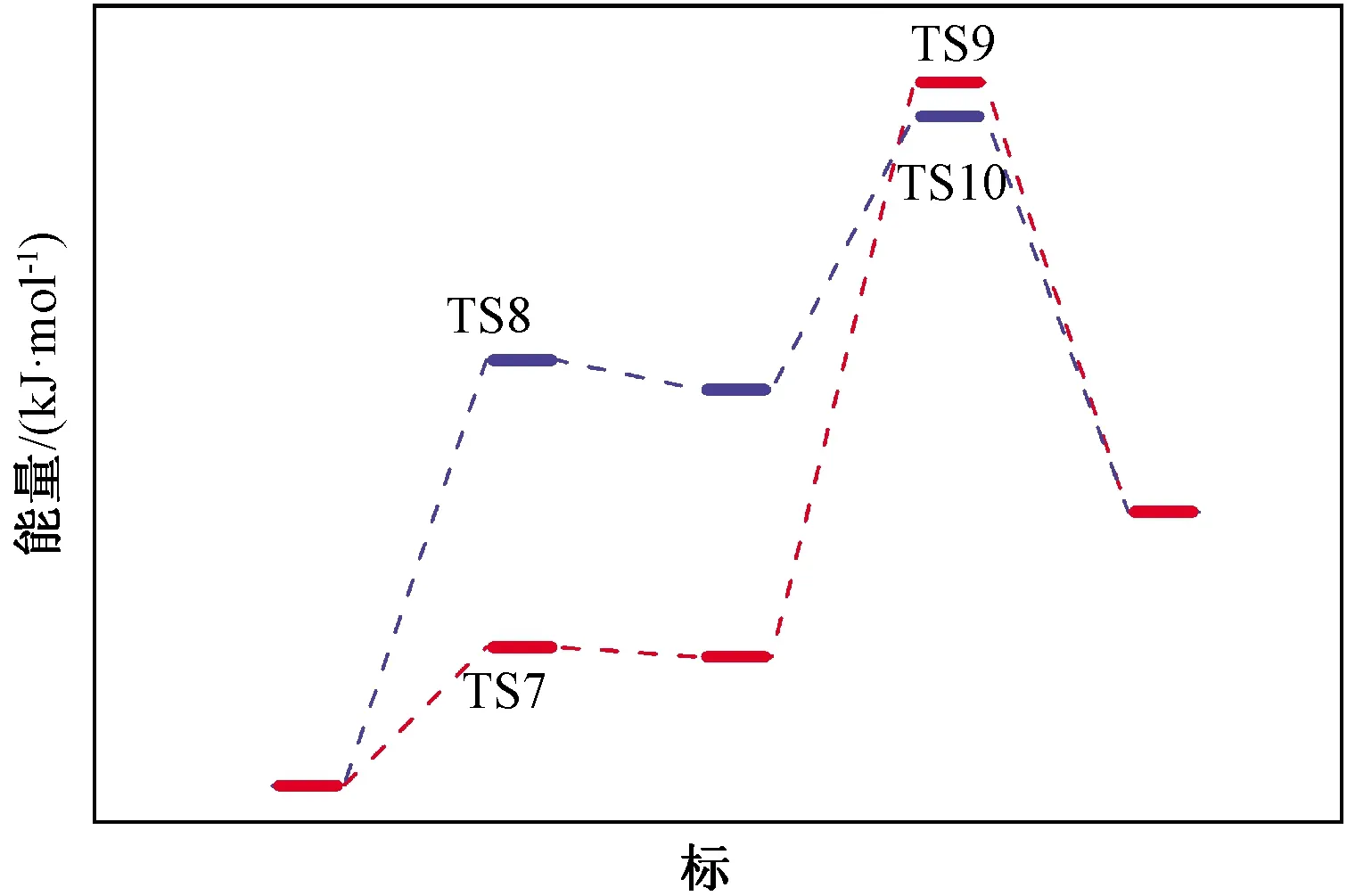
图2 四氯化硅氢化生成三氯氢硅反应势能图
由图2可知:R9的能垒为105.95 kJ/mol,远远高于R7、R8和R10的能垒,限制了循环按照R7至R9路线进行的速率,因而,反应更倾向于按照R8至R10发生。R10得到的SiCl3自由基可进一步通过R8进行传递,进行下一个循环,而无需链引发过程。此外,R8的能垒高于R10的能垒,将是循环过程中的限速步骤。
用同样的方法,可绘制出生成二氯硅烷、一氯硅烷和硅烷的势能图,经由R7→R9→R7→R11→R7→R14→R7→R17和R8→R12→R13→R15→R16→R18→R19的两种路径(图3)。对比这两种路径可发现,前者生成三氯氢硅、二氯氢硅和一氯氢硅的决速步R9、R11和R14的能垒均高于后者中的R8、R13和R16,表明这三种产物倾向于沿着后一种路径获得。前者中生成硅烷的决速步R17的能垒则低于后者中的R19,这意味着生成硅烷的反应倾向于按照前一种路径进行。自由基和自由原子可以互相结合形成更稳定的分子,从而终止链式反应。在四氯化硅氢化过程中,涉及多种自由基,因而可能以多种方式结合生成产物。表3中R20至R23列出了生成目标产物的链终止过程,可见这些反应由于生成了较强的化学键而释放较多的能量得到结构相对稳定的分子。
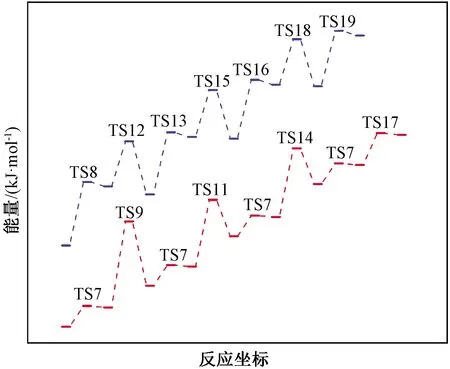
图3 四氯化硅氢化合成三氯氢硅、二氯氢硅、一氯氢硅和硅烷过程的反应势能图
如前所述,由于Cl2、Si2Cl6等副产物的结合能均远远小于目标产物的结合能,因而在实验条件不易生成或即使生成也很容易重新裂解。此外,在反应混合物中,自由基和原子的浓度是很低的,因而它们之间互相结合的概率很小,因而链终止反应在初期很少发生。在反应初期,仅仅需要少量SiCl4的裂解来引发,这是由于后续扩展发生需要的能量远远低于引发过程。第一步扩展消耗的自由基,在第二步重新获取,并重新进入反应循环。通过这种方式,链式反应可以循环往复很多次。
四氯硅烷氢化过程中一个现实的问题是如何控制三氯硅烷、二氯硅烷、一氯硅烷和硅烷等产物的选择性。行之有效的一种办法是维持四氯化硅大大过量,因为这种情况下活泼的中间体与硅烷接触的概率远远大于三氯硅烷,从而使二氯硅烷等后续产物的产率显著降低。这与实验室和工业实践结果相吻合[14-15]。
通过上述计算及分析结果还可知:
(1)四氯化硅氢化过程是吸热反应,且需要较高的能量使四氯化硅裂解以引发反应,从热力学和动力学角度分析可知反应温度应较高。但过高的反应温度会诱导副反应如含硅化合物深度分解为固体硅,从而使反应网络复杂化,而且会对设备提出更高的要求。因此,反应温度应从多角度做出选择。
(2)该过程涉及的所有反应的反应物和产物分子数相等,所以压力对平衡无影响,但提高压力可以加快反应速率,而且提高压力会对设备和能耗提高要求,因此,适宜的反应压力需要综合考虑后确定。
(3)开发合适的催化剂、降低四氯化硅或氢气裂解的能垒是工艺开发和节能降耗的关键。目前,普遍采用Cu、CuCl、Cu2O等铜基催化剂来加速热氢化和冷氢化反应,其机理可能为加强了SiCl4的吸附和活化[1,12-13]。铁、钴、镍等能够活化氢气裂解的催化剂也有所尝试,但效果均不如铜基催化剂[16]。
3 结论
(1)四氯化硅氢化合成三氯氢硅、二氯氢硅、一氯氢硅和硅烷的反应均为吸热反应,需要外界提供能量才能持续进行。
(2)四氯化硅的Si—Cl键键能比氢气中H—H键键能低,链式反应由断裂Si—Cl键引发。
(3)生成三氯氢硅的能垒比后续生成、二氯氢硅、一氯氢硅和硅烷的能垒低,在原料充足的情况下将会是主产物。
