根际促生细菌对1年生樟子松生长及土壤理化指标的影响1)
2021-12-03罗佳煜宋小双邓勋宋倩王俊凯王子卓宋瑞清
罗佳煜 宋小双 邓勋 宋倩 王俊凯 王子卓 宋瑞清
(东北林业大学,哈尔滨,150040) (黑龙江省森林保护研究所) (东北林业大学)
樟子松(Pinussylvestrisvar.mongolica)是欧洲赤松的一种地理品种,自然分布在中国大兴安岭山区、中国呼伦贝尔沙质平原红花尔基、俄罗斯和蒙古部分地区,具有耐寒、耐旱、适应性强、生长快等特点。它是目前我国“三北防护林计划”和“治沙工程”中使用的主要针叶树种,在生态建设和环境恢复中发挥着重要作用。
林业苗圃生产中,化学肥料和农药的大量使用掩盖甚至阻碍了土壤微生物对植物营养的影响和贡献,造成植物根际土壤微生物多样性降低,功能单一化,减少使用化学农药和肥料,强调根际微生物对植物的促生抗逆作用,多使用微生物菌肥的,对于保障农林业的可持续发展意义重大[1]。植物根际是植物与土壤环境互作的界面,大量的微生物生活在植物根际区域,它们的生长会受到植物根系分泌物的影响[2]。植物根际微生物组群体高度复杂,被认为是植物的“第二基因组”,其中细菌的数量和种类最为丰富[3-4]。植物根际微生物能够很大程度的影响植物生长,并且在抵抗病原物对植物的侵染方面具有重要作用。当植物受到病原物侵袭时,植物可以从土壤中募集具有拮抗作用的微生物[5]。1978年,美国奥本大学Kloepper首次提出Plant Growth-Promoting Rhizobacteria(PGPR)的概念:定殖于植物根际,能够促进植物生长的一类细菌[6]。目前,研究较为广泛的包括芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、黄杆菌属(Flavobacterium)、伯克霍尔德菌属(Burkholderia)等[7]。PGPR可通过固氮、溶磷、产生铁载体及分泌植物激素等作用机制促进植物生长,如在减少肥料施用量的条件下,解淀粉芽胞杆菌(Bacillusamyloliquefacuens)和短小芽孢杆菌(B.pumilus)能够促进番茄的生长及对N素的吸收[8]。韦建玉[9]等得出施加微生物菌肥可提高植物土壤基本养分含量,改善物理性状,增加微生物量,对种子的育苗或种植都有促进作用[10]。本研究通过接种不同PGPR菌株,测定樟子松1年生苗生物量、营养指标,土壤理化性质和酶活性的质量浓度,分析研究PGPR菌株对樟子松1年生生长及土壤理化指标的影响,为植物PGPR菌肥改善土壤环境、促进苗木生长、降低病害发生,以“菌化苗”形式在后续造林中提高苗木成活率提供理论基础。
1 材料与方法
1.1 樟子松根际土壤样品采集及细菌分离
樟子松根际土壤样品采自东北林业大学哈尔滨实验林场樟子松1年生苗,挖出根系后,采用抖土法获得根际土样品,过60目筛后冰箱4 ℃保存。细菌分离采用梯度稀释法,将樟子松根际土壤梯度稀释液分别涂布于TYG、TSB、YEM、M408、M715以及TWYE6种不同培养基平板,28 ℃黑暗条件下培养5 d,挑取不同形态的菌落,进行划线纯化,将获得的根际细菌保存到R2A液体培养基中,放置于冰箱中4 ℃保存。
1.2 樟子松根际促生细菌筛选
樟子松根际IAA产生菌采用Salkowski比色剂定性筛选,采用IAA标准曲线法进行定量筛选,产铁载体菌株采用CAS平板法定性筛选,解磷细菌采用NBRIP培养基定性筛选,钼锑抗比色法定量筛选[11]。
1.3 根际促生细菌16SrRNA基因测序
将分离纯化的细菌接种于1 mL LB培养基中,30 ℃,200 r·min-1振荡培养24 h后12 000 r·min-1离心5 min后,去掉上清液,加入PCR体系:10×扩增缓冲溶液5.0 μL,d NTP引物1 μL,上下游引物(10~20 pmol)各2 μL,Taq DNA聚合酶(10 U/μL)1 μL,加超纯水至50 μL。采用细菌16S rRNA基因通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)进行16S rRNA基因的PCR扩增。PCR反应程序:94 ℃预变性4 min;94 ℃变性45 s,56 ℃退火45 s,72 ℃延伸90 s,30个循环;72 ℃延伸10 min。1%琼脂糖凝胶电泳检测得到PCR扩增产物,样品送上海美吉生物进行测序分析。
1.4 根际促生细菌对樟子松1年生苗的接种效应
1.4.1 PGPR接种菌剂制备
将-20 ℃保存的前期试验筛选得到PGPR菌株划线接种到牛肉膏蛋白胨(NB)固体培养基上,30 ℃黑暗条件下培养72 h后,挑取单菌落接种到牛肉膏蛋白胨(NB)液体培养基中(28 ℃,180 r·min-1)振荡培养48 h后,4 ℃条件下8 000 r·min-1离心10 min,去掉上清液后无菌水冲洗3次,接种前调整终浓度OD600吸光度为0.6。
1.4.2 樟子松育苗
V(草炭土)∶V(蛭石)∶V(河沙)=2∶1∶1混合配制成育苗基质土壤,121 ℃下高温高压灭菌2 h,装入营养钵(15 cm×13 cm)中室温放置7 d后进行播种[12]。樟子松种子催芽后播入营养钵中,每钵播30粒种子,置于东北林业大学实验林场温室中培养,幼苗出土后,每钵定苗至15株。进行常规的日常管护[13]。
1.4.3 接种试验设计
樟子松出苗14 d后进行接种,共2个接种方式:1)CK为PD培养基作为对照;2)单接种PGPR菌株;采取打孔灌根方式接种,每盆PGPR菌株菌剂、PD培养基50 mL(即每盆打直径10 mm、深5 cm的5个小孔,注入菌剂)。共7个处理,每个处理20次重复(即每个处理20盆300株樟子松1年生苗),共140盆,接种完成后在温室中正常管护。
1.4.4 樟子松1年生苗取样
植物取样:接种处理90 d,苗木渡过生长期后取样植物,用于测定指标。每个处理随机取1年生苗100株,用无菌水清洗根际,滤纸吸干后用于指标测定。
根际土取样:每处理采集樟子松苗的同时,轻轻抖动根际土收集于无菌样品袋中,过2 mm筛后放入装有冰袋的保温箱中带回实验室,用于测定土壤养分指标的风干后常温保存;测定土壤酶指标的土壤在冰箱4 ℃保存。
1.4.5 植物生长指标测定
1)生物量指标:分别测定1年生苗的苗高、地径、地上部分及地下部分鲜质量,干燥箱85 ℃烘干后测定地上部分及地下部分干质量。
2)苗木养分指标:樟子松1年生苗烘干后分为根、茎、叶3部分,研磨成粉状用于测定植物营养成分,包括全氮、全磷、全钾、有机质质量分数。全氮(TN)测定采用凯氏定氮仪(K9840);全磷(TP)的测定采用Mo-Sb比色法;全钾(TK)采用火焰光度计法测定;有机质(OM)测定采用重铬酸钾外加热法测定[21]。
1.4.6 土壤指标测定
1)土壤酶活性测定:采用南京建成生物土壤酶测定试剂盒,按照说明书测定土壤酸性磷酸酶活性、过氧化氢酶活性、蔗糖酶活性及脲酶活性含量。
2)土壤养分指标:全氮(TN)的测定采用凯氏定氮法;速效氮(AN)用碱性水解法测定;全磷(TP)的测定采用Mo-Sb比色法;速效磷(AP)的测定采用双酸浸出的钼锑抗比色法;总钾(TK)的测定采用火焰光度计;速效钾(AK)的测定采用乙酸铵(CH3COONH4)浸提剂火焰光度计;用重铬酸钾氧化加热法测定有机质(OM)。
1.5 数据处理和分析
序列测定结果利用BLAST软件(http://www.ncbi.nlm.nih.gov/blast/Blast.cgi)与GenBank数据库中的序列进行比对分析,选取同源性较高的相关序列用MEGA4.1软件(http://www.megasoftware.net/mega4.1.html)分析,用邻接法构建系统发育树,自展数(bootstrap)为1000。植物和土壤指标测定数据采用Excel 2019进行初步处理,数据由平均值±标准误表示;每个指标设置3个重复,使用SPSS19.0进行单因素方差分析,使用Origin2019处理数据并绘图。
2 结果与分析
2.1 樟子松根际PGPR菌株筛选
从樟子松1年生苗根际土壤分离纯化得到215株细菌,通过产IAA能力、解磷作用、产铁载体的定性和定量筛选,得到6株高效的PGPR菌株(表1),其中菌株2-6、3-13产IAA能力较强,IAA质量浓度分别为68.41、67.79 mg/L;菌株1-11、1-12解磷能力较强,磷质量浓度分别为96.5、86.17 mg/L;菌株1-42、6-13产铁载体能力较强。

表1 樟子松根际PGPR菌株定性和定量筛选
2.2 樟子松根际PGPR细菌的16SrRNA基因测序分析
将筛选所得根际细菌的16S rRNA基因序列与Genbank对比分析,其中1-11、1-42与Pseudomonasfluorescens(MK100909.1、MH518308.1)同源性为100%,1-12与Ralstoniapickettii(GQ895735.1)同源性为100%,2-6与Herbaspirillumchlorophenolicum(NR114143.1)同源性为100%,3-13与Staphylococcuscapitis(JX094948.1)同源性为100%,6-13与P.lini(MH304256.1)同源性为100%。菌株测序序列上传Genbank并编号:P.fluorescens(MK880640)1-11、R.pickettii(MK880641)1-12、P.fluorescens(MK880644)1-42、H.chlorophenolicum(MK880645)2-6、S.capitis(MK880646)3-13、P.lini(MK880647)6-13,菌株保存于东北林业大学森林微生物实验室。
2.3 PGPR接种对樟子松苗生物量指标的影响
不同接种处理对樟子松苗生物量的影响差异显著(p<0.05),同对照相比,1-42处理组显著增加了樟子松的根长、地上部鲜质量、地下部鲜质量、地下部干质量,分别增加了66.33%、86.73%、76.57%、64.46%,3-13处理组显著增加樟子松的根长,增加了52.51%;1-11处理组显著增加了樟子松的根长、地下部鲜质量,分别增加了70.81%、81.95%;2-6处理组显著增加了樟子松的根长、地上部鲜质量,分别增加了26.62%、11.50%;6-13处理组显著增加了樟子松的根长,增加了42.66%(表2)。综合分析,PGPR处理组对樟子松1年生苗根长的影响最为显著,平均增加了46.67%,且PGPR菌株1-42对樟子松苗生物量指标影响最为显著,说明接种PGPR可通过促进苗木根系生长,从而影响苗木生长。

图1 樟子松根际PGPR菌株16SrRNA基因系统进化树

表2 接种PGPR的樟子松1年生苗生物量
2.4 PGPR接种对樟子松苗养分指标的影响
不同接种处理对樟子松苗养分指标的影响差异显著(P<0.05),同对照(CK)相比,不同接种处理的樟子松苗在全氮、全磷、有机质、全钾水平均有显著增加,其中1-11处理组显著增加了樟子松苗根、叶全氮质量分数,分别增加了33.63%、60.38%,2-6处理组显著增加了樟子松苗茎的全氮质量分数,增加了44.53%,不同接种处理樟子松苗的根、茎、叶全氮质量分数平均增加1.62%、16.58%、30.19%;不同接种处理对樟子松苗的全磷影响最为显著,根、茎、叶全磷质量分数平均增加89.26%、206.23%、178.67%;6-13处理组显著增加了樟子松苗根、茎、叶的有机质质量分数,分别增加了30.64%、35.77%、48.11%;不同接种处理对樟子松苗根和茎的全钾质量分数平均增加了41.03%、16.44%,但樟子松苗叶的全钾质量分数不增反降。
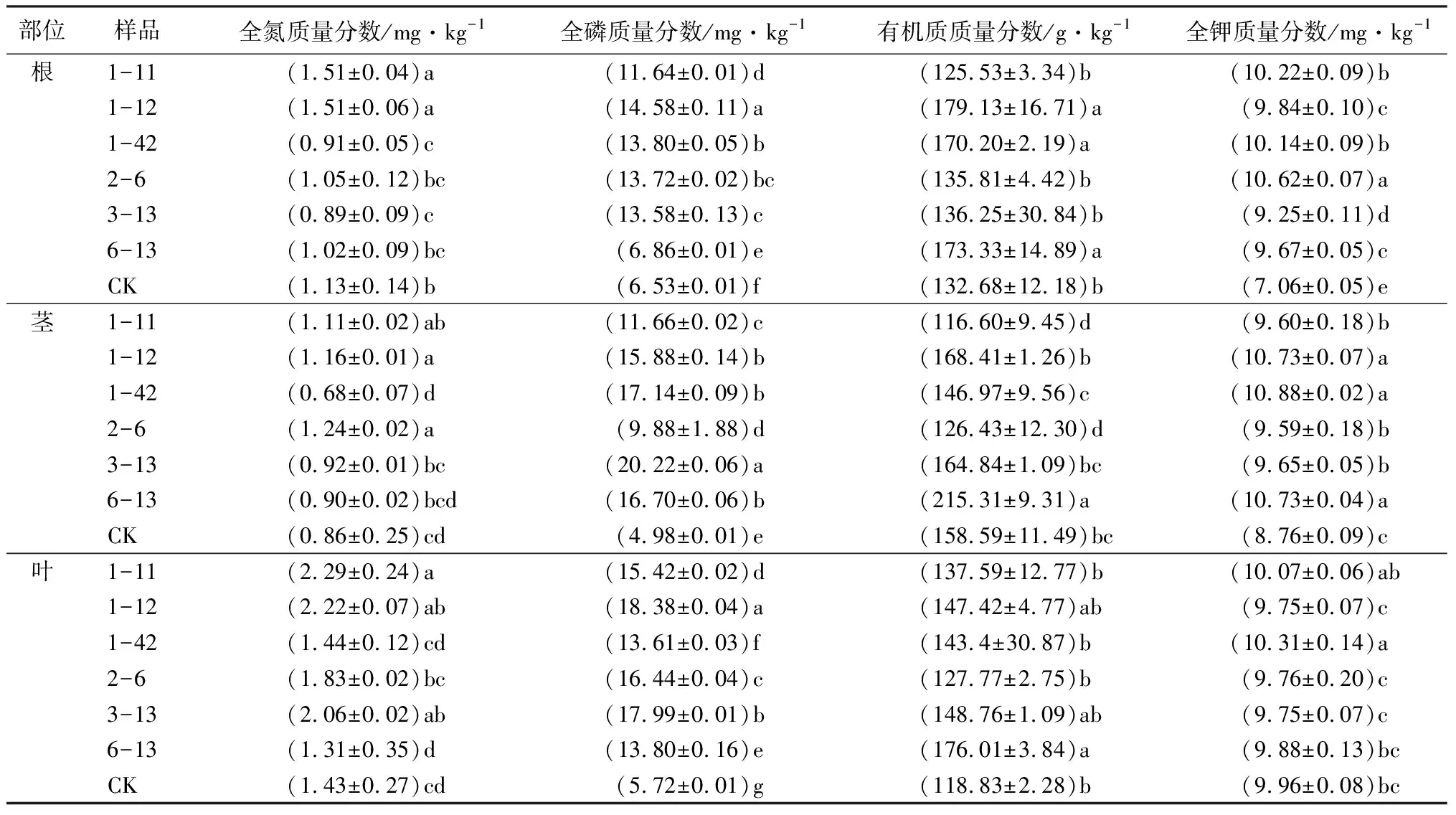
表3 接种PGPR的樟子松1年生苗养分
2.5 PGPR接种对樟子松苗根际土壤养分和酶活性的影响
不同处理组对樟子松苗根际土壤速效氮、全磷、速效磷、有机质质量分数以及磷酸酶活性、过氧化氢酶活性、蔗糖酶活性、脲酶活性的影响差异显著(P<0.05),但在全磷和速效磷水平上没有显著差异性(P>0.05),PGPR处理组土壤全氮、速效钾质量分数与对照(CK)相比均出现降低的情况;其中3-13处理组对土壤中全磷、速效磷、有机质质量分数及蔗糖酶活性、脲酶活性的量有显著影响,分别增加了38.30%、29.14%、36.19%、10.36%、43.96%;1-11处理组对土壤速效磷、全钾质量分数及蔗糖酶活性、脲酶活性有显著影响,分别增加了6.04%、3.47%、11.96%、32.09%;1-12处理组对速效氮、速效磷质量分数以及过氧化氢酶活性有显著影响,分别增加了30.77%、49.63%、4.05%;2-6、6-13处理组对蔗糖酶活性、脲酶活性有显著影响,2-6处理组分别增加了24.17%、31.16%,6-13处理组分别增加22.44%、46.92%;综合分析,PGPR处理组对脲酶活性影响最显著,增长率均达到20.03%以上。

表4 不同样品接种PGPR的樟子松根际土壤养分及酶活性

样品速效钾质量分数/mg·kg-1磷酸酶/U·g-1过氧化氢酶/U·g-1蔗糖酶/U·g-1脲酶/U·g-11-11(87.43±0.21)c (962.96±44.1)d (414.12±36.4)cd(184.73±9.4)abc(1069.75±111.0)ab1-12(91.02±0.15)b(1213.80±44.0)c(526.70±37.5)a(200.20±12.9)ab(972.11±147.0)ab1-42(87.50±0.37)c(1538.72±73.6)a(453.24±18.4)bc(183.31±1.0)bc(1015.67±140.3)ab2-6(86.72±0.42)cd(1314.81±76.5)bc(434.63±7.3)cd(204.88±7.8)a(1062.24±46.1)ab3-13(86.51±0.42)de(1320.71±41.2)bc(384.07±11.8)d(182.09±9.0)bc(1165.88±95.9)a6-13(85.88±0.54)e(1186.87±145.3)c(458.96±41.0)bc(202.03±11.3)ab(1189.91±286.5)aCK(98.07±0.10)a(1519.36±144.4)ab(506.19±26.3)ab(165.00±5.6)c(809.89±76.8)b
2.6 土壤理化性质与樟子松苗生物量的相关性
由表2—4可知,土壤中的全氮质量分数对幼苗地径和地下干质量有显著影响;速效氮、速效钾质量分数对幼苗地下鲜质量有显著影响;有机质质量分数对地下干质量有显著影响;土壤中磷酸酶活性对幼苗地上鲜质量和干质量有显著影响;过氧化氢酶和蔗糖酶活性对幼苗地下鲜质量有显著影响;土壤全磷、速效磷质量分数和脲酶活性与幼苗生物量相关性不太。

表5 土壤理化性质与生物量的相关性
3 结论与讨论
通过筛选樟子松根际分泌IAA细菌、解磷细菌、产铁载体细菌菌株得到6株复合PGPR菌株,经16SrRNA基因测序分析鉴定,分别为1-11菌株(PseudomonasfluorescensMK880640)、1-12菌株(RalstoniapickettiiMK880641)、1-42菌株(P.fluorescensMK880644)、2-6菌株(HerbaspirillumchlorophenolicumMK880645)、3-13菌株(StaphylococcuscapitisMK880646)、6-13菌株(P.liniMK880647)。这与徐秀倩等人研究发现林木根际细菌JYZ-SD5具有固氮、解有机磷和解钾的能力,具有较高的产IAA能力,不加色氨酸前体下产IAA量为6.818 6 μg/mL的结论一致[14]。同时Yasmi等发现具有固氮、解磷和产IAA能力的两种细菌Exiguobacteriumsp.和Stenotrophomonassp.对卡琪花蒂玛(Labisiapumila)有促生作用[15]。
接种PGPR对樟子松1年生具有促生作用,可提高根际土壤养分和土壤酶活性。本实验PGPR菌株1-42和3-13对樟子松生物量指标的影响最为显著;接种PGPR后樟子松苗根长同对照相比,平均增加了46.67%。有实验证明NaCl胁迫下,接种PGPR的燕麦的株高、根长、茎干质量、根干质量、相对含水量等生物参数明显高于未接种的植株[16];牛旭光[17]等人发现耐旱荧光假单胞菌(P.fluorescens)可刺激干旱胁迫下的种子萌发和幼苗生长。同时耿士均等研究发现,土壤中施加1.0%~2.5%的微生物菌肥可以使辣椒株高、干质量分别增加3.0%~44.9%、16.7%~67.8%;番茄株高、干质量分别增加6.2%~69.9%、3.8%~275.0%[18]。童辉[19]等研究表明,微生物菌肥施用量为2.0%时辣椒株高、生物量分别较对照增加15.8%、80.5%。
接种PGPR可显著提高樟子松1年生苗全氮、全磷、有机质、全钾质量分数,其中PGPR接种对樟子松1年生苗全磷质量分数影响最为显著。PGPR菌株1-11对根、叶的全氮质量分数有显著影响;菌株2-6对茎的全氮质量分数、根的全钾质量分数有显著影响;菌株1-12对根、叶的全磷质量分数有显著影响;菌株1-42对茎的全磷质量分数,茎、叶的全钾质量分数有显著影响;菌株6-13在根、茎、叶对有机质质量分数有显著影响。菌根菌主要作用为提升植物摄取土壤内磷元素能力,摄取机制为借助菌丝将养分空间扩大,并将土壤内部有机质活化[20]。植物与土壤微生物间产生密切的关联,其植物有机质为微生物提供赖以生存的环境,而微生物通过分解有机质、释放矿化元素促进植物更好地生长[21]。
微生物在土壤内存在,可将其中难溶矿物质加以分解,成为易溶解化合物,其中以磷、钾等细菌为主,其可释放无效的磷、钾等物质,加速植物发育、成长等[22]。本实验证明接种PGPR可显著提高樟子松1年生苗土壤速效氮、全磷、速效磷、有机质质量分数以及磷酸酶活性、过氧化氢酶活性、蔗糖酶活性、脲酶活性,但在全磷和速效磷水平上没有显著差异性,且接种PGPR的樟子松1年生苗土壤全氮、速效钾质量分数与对照(CK)相比均出现降低的情况;这与吕俊[23]等人在植物根际促生菌对大蒜的促生、抗病作用的研究中发现,8 g处理组的发芽率、株高、叶绿素质量分数以及铵态氮、有效钾和速效磷等土壤养分含量的测量都出现了降低的情况相同,可能是在较高浓度功能菌的情况下会出现促进作用下降的情况,也可能与植物根际促生菌本身或者其代谢产物过多有关。李静[24]等的研究通过对各处理土壤的分析,得出固氮菌+解磷菌+解钾菌组合的综合应用有利于多功能菌增加土壤养分含量。
本实验证明土壤中的全氮质量分数、速效氮质量分数、速效钾质量分数、有机质质量分数、磷酸酶活性、过氧化氢酶活性和蔗糖酶活性与幼苗生物量显著相关。土壤全磷质量分数、速效磷质量分数和脲酶活性与幼苗生物量相关性不太。这与陈有军等人[25]在研究植物养分含量和根际土壤微生物量的动态变化一致,植物氮的单位含量和根际土壤的微生物量氮有相关性,但是只是植物地下部分单位氮含量和根际土壤微生物量碳、氮、磷呈正相关,且极显著。
