GGR-6对米槁插穗生根过程中生理动态的影响1)
2021-12-03刘欢刘济明骆畅唐子燕梁格林代丽李如琪
刘欢 刘济明 骆畅 唐子燕 梁格林 代丽 李如琪
(贵州大学,贵阳,550025)
米槁(CinnamomummigaoH. W. Li)是樟科樟属的1种高大乔木,成年株高可达25 m,是我国西南部少数民族地区的特有植物种,也是贵州省苗族的代表性药用植物,具有重要的生态、经济、科学研究价值[1]。随着以米槁药材为原料的贵州民族药品的开发、应用,米槁资源的需求量不断增大[2]。目前,种子繁殖是米槁良种生产繁育最主要的方法,但野生米槁种子的保存完好率、萌发率较低[3],种子育苗不能满足市场需求,故急需开拓新的繁殖技术,填补米槁资源紧缺的空白。近年来,对米槁的研究多集中在药林间作[4]、自然更新[5]、果实挥发油[6]等方面,鲜少有对米槁无性繁殖的研究。基于此,本研究选取最适合米槁扦插生根的生长调节剂GGR-6及其最适质量分数,以米槁1年生嫩枝穗条为试验材料,通过对比分析GGR-6处理插穗生根过程的生理动态变化,探究其扦插繁殖的生根机制,为提高米槁繁殖率、加速苗木繁育提供参考。
1 材料与方法
1.1 试验材料
试验材料为贵州省种源米槁,所用扦插穗条取自贵州省罗甸县逢亭镇逢亭村米槁育苗基地2年生米槁实生苗。选取生长健壮、无病虫害的米槁1年生枝条,用穗条的中部制穗,每插穗留1~2片1/2叶。试验扦插基质为珍珠岩。于2016年6月—10月在贵州大学林学院苗圃进行米槁扦插试验。
1.2 试验处理
对扦插基质进行消毒,插前插穗用30 mg·L-1的GGR-6生长调节剂浸泡4 h,同时以清水浸泡插穗作为对照(CK)。采用随机区组设计,每个处理重复3次,每个重复30根插穗。从开始扦插后每隔10 d每个重复随机抽取足量插穗,直至插后60 d,共采集7次。采集样品需小心地从基质内拔出插穗,蒸馏水冲干净后擦干迅速带回,将各重复的插穗基部韧皮部剥下并经过液氮处理后磨碎装入离心管,于冰箱-20 ℃保存[7]。
1.3 扦插后管理
扦插后使用遮阴网将光强控制在自然光照的60%左右,扦插温度控制在25~30 ℃,空气湿度控制在80%以上。每隔10 d喷洒1 000 mg·L-1的多菌灵溶液进行灭菌,并对扦插苗进行常规管理。
1.4 米槁生根过程相关生理指标的测定
对试验样品进行营养物质、酶活性、内源激素的测定。采用蒽酮比色法测定可溶性糖、淀粉质量分数,采用考马斯亮蓝G-250法测定可溶性蛋白质量分数[8]。参照蔡楚恒[9]的方法测定过氧化物酶(POD)、多酚氧化酶(PPO)、吲哚乙酸氧化酶(IAAO)的活性。采用酶联免疫吸附法(ELISA)进行内源激素的测定。测定前将保存于-20 ℃冰箱中的样品取出0.5 g,用液氮磨碎,装入10 mL离心管中,再加入2 mL提取液分次将研钵冲洗干净,全部转入离心管中,在4 ℃条件下10 000 r·min-1离心10 min,取上清液转入10 mL离心管,用干冰及泡沫箱送至成都百奥诺维生物科技有限公司进行内源激素质量分数的测定。用插穗中吲哚乙酸(IAA)、脱落酸(ABA)、赤霉素(GA)、玉米素核苷(ZR)的质量分数及IAA与ABA质量分数比值、IAA与ZR质量分数比值评定米槁插穗的生根能力。
1.5 数据分析
试验数据均采用平均值±标准误(n=3)表示,使用Excel2013、Origin2018进行数据统计及图表绘制,利用SPSS 20.0软件进行显著性分析,采用单因素方差分析(one-way ANOVA)法进行LSD检验(P<0.05)。
2 结果与分析
2.1 米槁插穗生根过程中营养物质动态
2.1.1 可溶性糖质量分数变化
从图1可以看出,在米槁插穗生根过程中,不同处理的可溶性糖质量分数变化趋势基本一致,呈V字型。以扦插20 d为临界点,插穗体内新陈代谢的加快使扦插的前20 d,2组不同处理的插穗可溶性糖质量分数持续下降,说明不定根形成时期需要消耗大量的可溶性糖为其提供能量。扦插20 d后,处理组的可溶性糖质量分数开始持续升高,对照组则在扦插30 d后呈现上升-下降-上升的变化。在扦插后的0~30 d,GGR-6处理的插穗体内可溶性糖质量分数始终低于清水对照组。扦插30 d后,不定根的形成使可溶性糖质量分数回升,但清水处理的插穗愈伤组织发育、生根速率低于对照组,因此又出现1次可溶性糖质量分数的下降,最终可溶性糖累积量低于对照组。
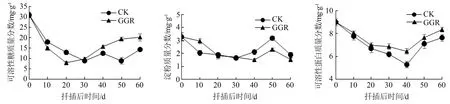
图1 扦插过程中营养物质质量分数的变化
2.1.2 淀粉质量分数变化
米槁扦插后淀粉质量分数随生根进程的变化而发生改变。在扦插的前30 d,由于愈伤组织形成及根原基发育需要淀粉分解形成可溶性糖提供能量,导致插穗体内的淀粉质量分数逐渐减少。在扦插后的0~20 d,GGR-6处理的插穗体内淀粉质量分数高于对照组。在扦插后20~30 d,2种处理的插穗体内淀粉质量分数相近。扦插后的30~50 d,不定根形成使插穗体内的淀粉质量分数开始回升。扦插50 d后,不定根的增多、伸长、生长使插穗体内的淀粉被消耗。在这期间,处理组的淀粉质量分数始终低于对照组,并在40 d时到达最低值,说明GGR-6处理促进了插穗根原基的发生及不定根的生长。
2.1.3 可溶性蛋白质量分数变化
米槁插穗生根过程中,插穗体内可溶性蛋白质量分数呈现下降-上升的规律,与可溶性糖质量分数的变化趋势一致,为V字型。在扦插的前40 d,愈伤组织与根原基的形成过程消耗了大量的营养物质,导致可溶性蛋白质量分数持续下降。扦插40 d后,插穗体内可溶性蛋白质量分数开始逐渐上升。在扦插后的40~50 d,可溶性蛋白大量积累,为不定根的生长提供了物质基础。扦插50 d后,不定根数量的增多及其增粗生长使可溶性蛋白被分解,导致插穗中的可溶性蛋白质量分数上升变缓。在整个扦插期间,清水对照组插穗体内的可溶性蛋白质量分数明显低于处理组,说明GGR-6处理对插穗体内可溶性蛋白的合成有促进作用,加速了不定根的发生及生长。
2.2 米槁插穗生根过程中相关氧化酶的活性动态
2.2.1 POD活性变化
米槁插穗生根过程中,POD的活性随扦插天数的不同呈规律性变化。GGR-6处理的插穗体内POD活性呈现上升-下降-上升的变化趋势,在30 d时达到最低值。扦插初期,由于扦插环境的改变,插穗脱离母体后受到一定的损伤,导致POD活性升高;扦插中期,插穗逐渐适应扦插环境,POD活性开始下降。在之后的生根进程中,GGR-6处理组插穗的POD活性急剧上升,高于清水处理组,说明高活性的POD有利于不定根的形成。受插穗体内外源生长调节剂的影响,清水处理组的插穗POD活性小于GGR-6处理组。
2.2.2 PPO活性变化
从图2可以看出,GGR-6处理组插穗体内的PPO活性在持续上升,清水处理组插穗体内的PPO活性变化曲线为上升-下降-上升的双峰曲线,在扦插20 d时到达第1个峰值,随后在经历短暂时期的下降后又开始回升。可见,PPO活性随插穗生根的进程呈现规律性变化。在扦插初期,插穗伤口导致PPO活性升高从而促进伤口愈合,清水处理组插穗的伤口对环境的应激反应更加剧烈,因此清水处理组插穗的PPO活性高于GGR-6处理组。在扦插30 d后,GGR-6处理组的PPO活性持续升高,利于插穗形成吲哚乙酸-酚酸复合物;清水处理组的PPO活性下降,导致生根较晚。在扦插40 d后,2个不同处理的插穗PPO活性均在升高,说明高活性的PPO有利于不定根的生长。
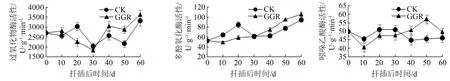
图2 扦插过程中氧化酶活性的变化
2.2.3 IAAO活性变化
在扦插后的0~10 d内,插穗体内的IAAO活性降低,即分解IAA的能力降低,有利于插穗切口的愈合。在扦插后的10~30 d,2个不同处理的插穗体内IAAO活性逐渐升高后趋于平缓,这一时期清水处理组的IAAO活性高于GGR-6处理组。在扦插30 d后,GGR-6处理的插穗体内IAAO活性高于清水处理的,并在50 d时达到最大值。清水处理组插穗的IAAO活性在30 d时下降并维持在该水平直到试验结束,这一阶段是不定根形成、生长的关键时期,IAAO的活性越高,分解的IAA越多,从而诱导了根原基的形成。清水处理组插穗的IAAO活性低于处理,生长素质量分数过高,抑制了不定根的产生,即IAA对植物表现出低质量分数促进、高质量分数抑制。由此说明,IAAO活性大小能影响插穗不定根的发生。
2.3 米槁插穗生根过程中内源激素质量分数及其比值变化
2.3.1 IAA质量分数变化
IAA的质量分数变化曲线与IAAO活性变化曲线相似。GGR-6处理、清水处理2种不同处理的插穗体内IAA质量分数变化相反。GGR-6处理的插穗体内IAA质量分数呈上升-下降-上升趋势,在扦插后20 d时达到最大值,此时愈伤组织开始出现;扦插后20~50 d,插穗体内的IAA质量分数开始持续下降,说明诱导根原基形成不定根的过程需要消耗大量的IAA。清水处理组插穗体内的IAA质量分数变化幅度较小。在扦插后0~30 d内,IAA质量分数缓慢下降;在扦插30 d时到达最低值,随后又开始缓慢上升。插穗扦插成活后(50 d后),2组处理的插穗体内IAA质量分数都快速上升。
2.3.2 ABA质量分数变化
在扦插初期,GGR-6处理的插穗体内ABA的质量分数下降,在扦插10 d时ABA质量分数最低;扦插后10~20 d,植物对环境的应激反应使插穗体内的ABA质量分数增加,营养物质得以积累,利于扦插成活;在扦插20 d以后,GGR-6处理组插穗体内的ABA质量分数持续降低,较低质量分数的ABA有利于愈伤组织的形成及不定根的发生。清水处理组的插穗ABA质量分数呈现上升-下降的规律,在40 d时达到最大值。扦插前期,清水处理组的插穗为了增强抗逆性,导致ABA质量分数增高;扦插40 d后,ABA的质量分数开始下降,这时出现不定根。清水处理组的ABA质量分数在扦插各时期均高于GGR-6处理组,不定根出现的时间比GGR-6处理组晚,说明ABA能抑制不定根的形成。
2.3.3 GA质量分数变化
清水处理的插穗体内GA质量分数变化趋势与GGR-6处理的一致,但总体变化幅度小于GGR-6处理的。在扦插初期,插穗脱离了母体,植物细胞在新环境中生长缓慢,GA质量分数下降。扦插后0~10 d,清水处理组的GA质量分数下降幅度大于GGR-6处理组,并在扦插10 d时到达最低值。扦插后的10~30 d内,2种不同处理的插穗体内GA质量分数出现上升,在30 d时,达到了1个小高峰,这时愈伤组织开始出现。经历短暂的上升后,GA质量分数再次下降,说明少量的GA有利于不定根的发生。在扦插40 d后,GA质量分数同IAA一样,开始回升。40 d后属于不定根的伸长期,说明这2种激素有促进不定根生长的作用。
2.3.4 ZR质量分数变化
插穗内的ZR质量分数呈现出下降-上升的动态变化。扦插初期,各处理插穗内的ZR质量分数均出现了下降,清水处理组降低的幅度大于GGR-6处理组。在扦插后10~20 d,GGR-6处理、清水处理2种不同处理的插穗体内ZR质量分数有一次短暂的上升。扦插30 d前,GGR-6处理组插穗内的ZR质量分数一直高于清水处理组,这一时期愈伤组织开始形成,在GGR-6生长调节剂的作用下,ZR的合成加强,促进了愈伤组织的形成。清水处理组插穗内的ZR质量分数从扦插30 d开始快速上升,GGR-6处理组的从40 d开始平缓升高但低于清水处理组,说明插穗体内ZR质量分数较高,对不定根的形成有抑制作用,从而导致清水处理组的插穗生根晚于处理组。
2.3.5 激素比值变化
从图3可以看出,扦插初期插穗对环境的抗逆反应使ABA质量分数上升,导致扦插后40 d内2组不同处理的插穗体内IAA与ABA质量分数比值均持续下降。GGR-6处理的插穗IAA与ABA质量分数比值在0~10 d有短暂的上升,说明外源植物生长调节剂有利于插穗体内IAA的积累,较高的IAA与ABA质量分数比值有利于愈伤组织的形成。插穗体内的IAA与ABA质量分数比值在扦插后的10~20 d,经历短暂下降后保持平稳。扦插40 d后,不同处理的插穗体内IAA与ABA质量分数比值逐渐上升。在扦插不同时期,GGR-6处理组插穗内的IAA与ABA质量分数比值均高于清水处理组,说明高IAA与ABA质量分数比有利于插穗生根。
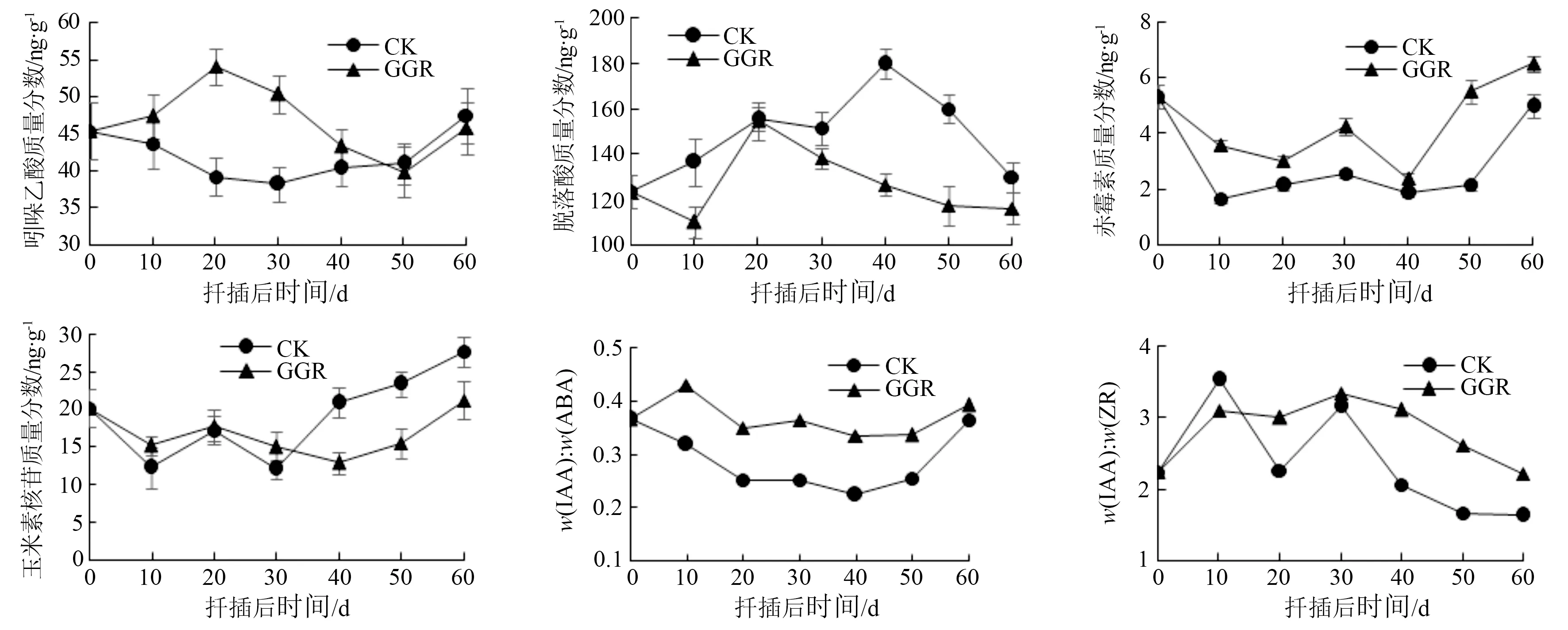
图3 扦插过程中内源激素质量分数及比值变化
在米槁插穗生根过程中,GGR-6处理组插穗的IAA与ZR质量分数比值与清水处理组的变化趋势一致,均呈现先上升后下降的波动变化,其中清水处理组插穗的IAA与ZR质量分数比值变化比较剧烈,出现2次高峰。在扦插20 d后,经GGR-6处理的插穗IAA与ZR质量分数比值高于清水处理组,同时GGR-6处理组插穗愈伤组织的形成早于清水处理组,说明IAA与ZR质量分数比值高有利于愈伤组织的形成。在扦插30 d后,插穗体内IAA与ZR质量分数比值开始下降并趋向于平稳变化,此阶段为不定根的伸长生长阶段。此阶段插穗体内ZR的质量分数升高,使IAA与ZR质量分数比值降低。总体来看,GGR-6处理组的IAA与ZR质量分数比值高于清水处理组,说明IAA与ZR质量分数比值高对扦插生根有促进作用。
3 结论与讨论
植物插穗内的营养物质是插穗生根前维持生命活动的重要能源,插穗内所储存的可溶性糖、淀粉、可溶性蛋白等营养物质对其生根具有重要影响[10]。愈伤组织的形成、根原基的发生、不定根的伸长及生长等生根过程需要消耗大量的营养物质。所以掌握扦插不同时期插穗体内营养物质的变化规律,有助于提高扦插生根效率[11]。本研究发现,在扦插初期(0~30 d),插穗内的营养物质质量分数有所下降,说明插穗在生根前无法从土壤中吸收营养,只能通过消耗营养物质来维持生根过程中的各种生理活动。在不定根的形成、生长阶段(40~50 d),由于插穗不定根形成后从基质中吸收一定养分,并且伴随新叶的产生,光合产物的增多,减少了体内营养物质的消耗,故插穗体内营养物质均有上升。插穗生根过程中可溶性淀粉质量分数在扦插50~60 d时下降,主要是由于不定根的伸长生长消耗了大量的营养、能量。总体来看,GGR-6处理组的插穗体内营养物质质量分数高于清水对照组,说明GGR-6预处理能加快米槁插穗的生根进程。因此,外源植物生长调节剂通过调节插穗的生理生化基础促进插穗的愈伤组织形成及不定根生长进程,这与郑巧巧等[12]的研究结果一致。
植物扦插过程中,酶类在生长、发育、不定根形成及其他新陈代谢中发挥着重要的作用,其中吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶的作用尤为显著[13]。吲哚乙酸氧化酶通过分解吲哚乙酸、调节插穗体内吲哚乙酸质量分数影响插穗的生根进程。多酚氧化酶能够催化酚类物质与吲哚乙酸快速缩合,形成1种吲哚乙酸-酚酸复合物,该复合物是1种生根辅助因子,对不定根的形成有显著的促进作用[14]。多酚氧化酶通过氧化吲哚乙酸间接影响不定根的生长、伸长[15]。本研究发现,在扦插前期(0~30 d),由于插穗的伤呼吸及对新环境的抗逆反应,且插穗具有低活性的吲哚乙酸氧化酶更利于愈伤组织的形成及生根[16],从而导致了除了GGR-6处理组插穗的过氧化物酶活性在短暂的时间段高于清水处理组外,清水处理组插穗的氧化酶活性均高于GGR-6处理组。扦插30 d时是不定根形成的关键时期,GGR-6处理组插穗的3种氧化酶活性普遍高于清水处理组,说明经过外源生长素的处理,插穗酶活性的变化更利于生根[17]。
植物内源激素对难生根树种的扦插生根起着重要作用,可以调节插穗内抗氧化酶和养分的动态变化,促进根原基的形成[18]。本研究测定了米槁插穗生根过程中的内源激素变化,研究结果显示,米槁扦插生根过程中,吲哚乙酸质量分数呈现上升-下降-上升的变化规律。在扦插初期,外源生长素的作用使插穗基部生长素积累,吲哚乙酸质量分数上升,且插穗内高质量分数的吲哚乙酸能够促进愈伤组织的形成。在愈伤组织形成时期,GGR-6处理的插穗吲哚乙酸、赤霉素质量分数均高于清水处理组,因此,GGR-6处理组插穗的生根早于清水处理组。插穗体内较低质量分数的脱落酸有利于愈伤组织形成及诱导根原基形成不定根,同时促进插穗内的淀粉水解为糖,为不定根的生长提供能量[19]。GGR-6处理组插穗在扦插初期的脱落酸质量分数下降,在根原基的形成、不定根发生进程中,脱落酸质量分数持续下降并趋于平稳。在扦插40 d后,不定根形成过程中,清水处理组的插穗体内脱落酸质量分数开始剧烈下降。玉米素核苷在生根前期一直波动变化,且有下降的趋势,说明不定根的形成需要消耗玉米素核苷。插穗的不定根形成后,新根重新合成细胞分裂素[20],导致玉米素核苷质量分数上升,以满足插穗生根需要。在扦插生根过程中,插穗内源激素作用的发挥不是单一的,而是相互协同参与插穗生根的整个过程,不同激素质量分数比值的动态变化更能反映插穗的生根能力。本研究发现,高质量分数比的IAA与ABA与生根呈正相关,这与卢楠等[21]的研究结果一致。因此,许多研究用IAA与ABA质量分数比值衡量插穗的生根情况。然而,在扦插生根过程中,IAA与ZR质量分数比值也有着重要的调节功能,吲哚乙酸和玉米素核苷的协同作用,促进了愈伤组织的形成,不定根的产生、伸长、生长[22]。上述研究表明,插穗的内源激素通过动态联合来调控不定根的发生过程,生长调节剂则通过调节内源激素的质量分数来间接影响不定根形成和发育[23-24]。
研究通过对比分析2种不同处理的插穗在扦插生根过程中生理机理的动态变化,证明了营养物质质量分数、内源激素质量分数、氧化酶活性与米槁的扦插生根有关,且GGR-6加速了这些物质的代谢进程,促进了米槁的扦插生根。但米槁扦插生根的机制较为复杂,需要进一步对其生根机制进行深入解析。
