三重real-time PCR检测副溶血弧菌主要毒力基因
2021-12-03雷舒文上官文丹钟青萍
陈 松,雷舒文,上官文丹,刘 丹,钟青萍
(华南农业大学食品学院,广东省食品质量与安全重点实验室,广东 广州 510642)
副溶血弧菌(Vibrio parahaemolyticus)是嗜盐性的革兰氏阴性菌,广泛存在于近海岸水域中。海产品中如鱼、虾、贝类等常携带副溶血弧菌[1-2]。食用被致病性副溶血弧菌污染的食品会导致急性肠胃炎,出现腹泻、恶心、呕吐、发热和腹部痉挛等症状[3-4]。据我国食品安全风险评估中心统计,由副溶血弧菌引起的食物中毒人数每年可达到495万 人[5]。此外,副溶血弧菌引起的食物中毒事件在美国、日本、韩国、西班牙等地也常有报道,是一种全世界范围内的主要食源性致病菌[6-8]。
尽管副溶血弧菌对食品安全造成了巨大威胁,但并不是所有的菌株都有致病性,仅有部分副溶血弧菌会引起食源性疾病的爆发[9]。因此,建立一种快速、灵敏、准确,并能区分致病性及非致病性副溶血弧菌的检测方法具有重要意义。研究发现,致病性及非致病性副溶血弧菌都携带有编码不耐热溶血毒素(thermolabile hemolysin,TLH)的基因(tlh),只有携带编码耐热直接溶血毒素(thermostable direct hemolysin,TDH)的基因(tdh)和/或编码耐热相关溶血素(thermostable related hemolysin,TRH)的基因(trh)的菌株具有强致病力,而trh的2 个亚型(trh1和trh2)在序列上存在一定的差异[10]。位于trh上游编码尿素酶的ureR基因高度保守,且与trh具有连锁关系,因此以ureR代替trh作为检测靶标可以有效规避序列差异的问题[11]。
目前,传统培养方法仍是检测副溶血弧菌的公认且可靠的方法,其优点是结果较为准确,但该方法操作比较繁琐,耗时较长,整个检测流程一般需要4~7 d,不能满足快速检测的要求[12]。聚合酶链式反应(polymerase chain reaction,PCR)由于其反应时间短、结果准确、灵敏度高等优点已广泛应用于食源性致病微生物的检测中[13]。常规PCR每次反应只能针对一个靶标,且不能进行定量分析,而多重实时PCR(real-time PCR)不仅能在一次反应中检测多个靶标,且弥补了传统PCR不能定量的缺点[14-15]。本研究针对副溶血弧菌的特异性基因tlh,毒力基因tdh和ureR设计引物及探针,建立一种快速定量检测副溶血弧菌毒力因子的三重real-time PCR方法,该方法能准确区分致病性及非致病性的副溶血弧菌,为副溶血弧菌风险监测及食品安全评估提供了参考依据。
1 材料与方法
1.1 材料与试剂
副溶血弧菌ATCC 17802购于广东省微生物研究所微生物菌种保藏中心;副溶血弧菌标准菌株J5421由中国军事医学科学院微生物流行病研究所赠送,其余8 株副溶血弧菌分离菌株和22 株非副溶血弧菌(表1),由华南农业大学微生物检测实验室保存,所有菌株均于-80 ℃保存。

表1 实验菌株Table 1 Bacterial strains used in this study
硫代硫酸盐柠檬酸盐胆盐蔗糖(thiosulfate citrate bile salts sucrose,TCBS)琼脂培养基、胰蛋白胨大豆肉汤(trypticase soy broth,TSB) 广东环凯微生物科技有限公司;细菌基因组DNA提取试剂盒 北京索莱宝科技有限公司;牛血清蛋白(bovine serum albumin,BSA)、TaqDNA聚合酶、Mg2+、dNTP 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
SW-CJ-1B超净工作台 苏州净化设备有限公司;Forma Class II A2生物安全柜 美国Thermo公司;X3FR高速冷冻离心机、NanoDrop 2000c超微量分光光度计赛默飞世尔科技(中国)有限公司;CFX96 TouchTM荧光定量PCR仪 伯乐生命医学产品(上海)有限公司。
1.3 方法
1.3.1 菌株的培养
副溶血弧菌在无菌条件划线于TCBS琼脂培养基上,37 ℃培养12 h,挑取蓝绿色单菌落于含3% NaCl的TSB液体培养基中37 ℃、150 r/min培养16 h;非副溶血弧菌划线于LB琼脂培养基中,37 ℃培养12 h,形成清晰单菌落后挑取单菌落于LB液体培养基中37 ℃、150 r/min培养16 h。
1.3.2 模板DNA的制备
利用细菌基因组DNA提取试剂盒制备模板DNA,具体步骤按照试剂盒说明书进行。提取后的DNA以超微量分光光度计测定其浓度,并保存于-20 ℃。
1.3.3 引物及探针的设计与合成
以副溶血弧菌tlh、tdh、ureR基因为靶基因,利用Primer Premier 5.0软件进行引物探针设计并由生工生物工程(上海)股份有限公司合成。引物和探针序列及扩增产物见表2。
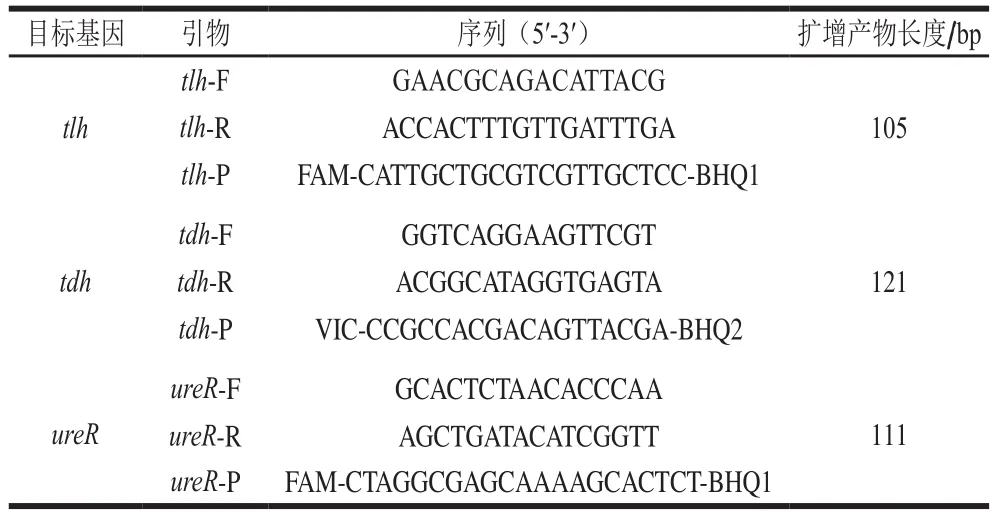
表2 引物和探针序列Table 2 Sequences of the primers and probes used in this study
1.3.4 引物及探针的特异性验证
以10 株副溶血弧菌菌株和22 株非副溶血弧菌的DNA为模板进行real-time PCR。反应体系(20 μL)为:Mix1(K+20 mmol/L,NH4+10 mmol/L,dNTP 120 μmol/L,Mg2+2.5 mmol/L,BSA 0.04 mg/mL,Tris-HCl 50 mmol/L,TaqDNA聚合酶0.1 U/mL,甘油2.50%)10 μL,引物0.80 µmol/L,探针0.50 µmol/L,模板2 μL,补充无菌蒸馏水至20 µL。反应条件:95 ℃预变性10 min;95 ℃变性15 s;53.9 ℃退火15 s;62.4 ℃延伸45 s;每个循环结束后采集荧光信号,共45 个循环。
1.3.5 三重real-time PCR方法的建立及条件优化
优化前三重real-time PCR体系(20 µL)为:Mix2(K+10 mmol/L,NH4+20 mmol/L,dNTP 180 μmol/L,Mg2+3 mmol/L,BSA 0.04 mg/mL,Tris-HCl 50 mmol/L,TaqDNA聚合酶0.1 U/mL,甘油2.50%)10 µL,tlh、tdh和ureR引物各0.50 µmol/L,tlh、tdh和ureR探针各0.50 µmol/L,模板2 µL,补无菌蒸馏水至20 µL。反应条件同1.3.4节。
1.3.5.1 引物浓度的优化
通常,多重PCR引物分配不当会导致目标DNA扩增不均匀,所以在反应中必需改变不同引物的比例,目的是增强“弱”位点的扩增和减弱“强”位点的扩增,使得各个目的基因扩增均匀。引物浓度的优化分为2 组,第1组为tdh0.15 µmol/L、tlh0.15 µmol/L、ureR分别为0.20、0.40、0.60、0.80、1.00 µmol/L;第2组为tdh0.25 µmol/L、tlh0.25 µmol/L、ureR分别为0.20、0.40、0.60、0.80、1.00 µmol/L。除引物浓度外,其他条件保持不变,根据优化前的反应体系及反应条件进行real-time PCR优化实验。
1.3.5.2 探针浓度的优化
探针的浓度分别设置为0.50、0.75、1.00、1.25 µmol/L,除探针浓度外,其他条件不变,根据优化前的反应体系及反应条件进行real-time PCR优化实验,探究探针浓度的影响,选择合适的探针浓度。
1.3.6 三重real-time PCR灵敏度的评价
将已知浓度的10 倍梯度稀释的副溶血弧菌及大肠杆菌菌悬液按照试剂盒方法分别提取DNA,并且分为2 组进行实验,对照组模板为副溶血弧菌(1.8×102~1.8×107拷贝/mL),实验组模板为副溶血弧菌(1.8×102~1.8×107拷贝/mL)和背景细菌(浓度为106拷贝/mL的大肠杆菌)的混合物,分别进行real-time PCR。根据优化后的体系进行real-time PCR,反应程序同1.3.4节。以real-time PCR结果为纵坐标,平板计数的结果为横坐标,绘制标准曲线。
1.3.7 以完整菌细胞的悬液和gDNA为模板的检测
为了确定以完整菌细胞的悬液作为模板对real-time PCR扩增产生的影响,分别将完整菌细胞的悬液和gDNA进行real-time PCR扩增。以gDNA为模板时反应程序按照1.3.4节进行。以完整菌细胞的悬液为模板时,将1 μL菌细胞悬液代替gDNA进行反应,预变性时间分别设置为10、20、30 min,进入循环95 ℃变性15 s;53.9 ℃退火15 s;62.4 ℃延伸45 s;每个循环结束后采集荧光信号,共45 个循环。
1.4 数据处理
每次实验设置3 个平行复孔,并进行2 次重复实验。实验数据应用Graphpad Prism 8软件进行平均值和标准偏差的计算。
2 结果与分析
2.1 引物及探针的特异性验证
以10 株副溶血弧菌和22 株非副溶血弧菌对设计的3 对引物进行特异性验证,结果如表3所示。结果表明:所有的副溶血弧菌均为tlh阳性,分别具有tdh或ureR基因的菌株仅对tdh或ureR荧光探针显示阳性信号。所有非目标菌株的结果均呈阴性,因此该方法具有很高的特异性。

表3 引物及探针特异性结果Table 3 Specificity of the primers and probes
2.2 三重real-time PCR方法的建立及条件优化
2.2.1 引物浓度的优化
ureR由HEX标记,tdh和tlh由FAM标记。如图1a所示,当FAM通道引物浓度不变,HEX通道引物浓度上升时,FAM通道Ct值上升,HEX通道Ct值下降,即FAM通道引物的扩增效率降低,HEX通道引物的扩增效率升高,当ureR浓度为0.80 µmol/L时,此时三者的扩增效率得到平衡。如图1b所示,随着HEX通道引物浓度升高,FAM和HEX通道的变化趋势与图1a一致,当ureR浓度为0.80 µmol/L时,三者的扩增效率相对平衡。对比图1a、b可知,当FAM通道引物浓度的升高,HEX通道的引物浓度不变时,FAM通道Ct值降低,HEX通道的Ct值升高,但FAM通道引物浓度的增加,没有改善扩增效率,表明在三重real-time PCR中,引物间相互影响,引物tdh0.15 µmol/L、tlh0.15 µmol/L、ureR0.8 µmol/L为最优组合。
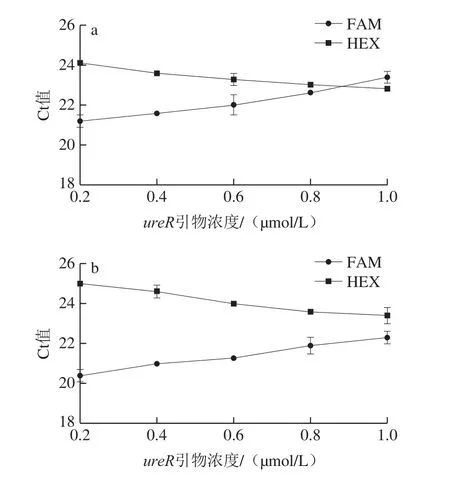
图1 引物浓度对三重real-time PCR扩增的影响Fig.1 Effects of primer concentration on Ct value of triplex real-time PCR
2.2.2 探针浓度的优化
如图2可知,在三重real-time PCR中,探针浓度对FAM和HEX通道的扩增影响一致,随着探针浓度的增加,Ct值均增大,在探针浓度为0.50 µmol/L时最优。
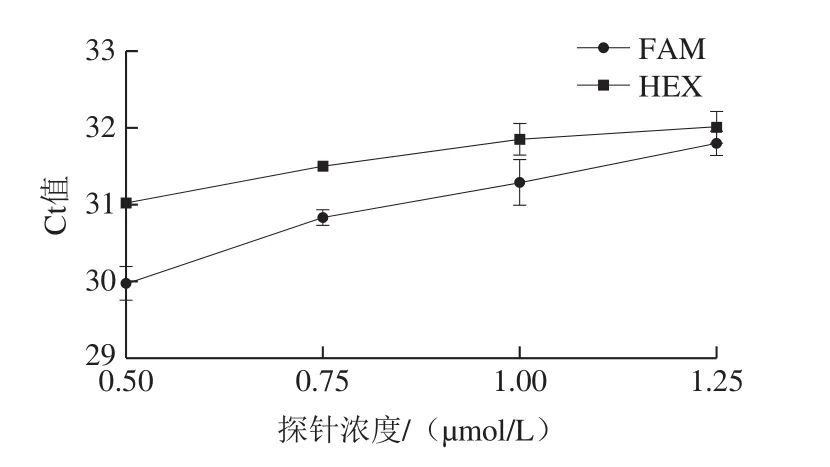
图2 探针浓度对三重real-time PCR扩增的影响Fig.2 Effect of probe concentration on Ct value of triplex real-time PCR
2.3 三重real-time PCR灵敏度
不同浓度(1.8×102~1.8×107拷贝/mL)副溶血弧菌模板的三重real-time PCR扩增曲线如图3所示。以DNA浓度对数值(x)与Ct值(y)绘制标准曲线,在无背景细菌存在下,FAM和HEX通道的线性方程分别为y=-3.564 3x+45.367和y=-3.456 3x+45.77,R2分别为0.998 5和0.997 5,扩增效率分别为91%和95%;在浓度为106拷贝/mL的大肠杆菌为背景下,FAM和HEX通道的线性方程分别为y=-3.484 2x+45.226和y=-3.317 1x+44.923,R2分别为0.997 4和0.999 5,扩增效率分别为94%和100%。DNA浓度对数值与Ct值均呈良好的线性关系,与背景细菌的存在无关,检出限为1.8×102拷贝/mL。
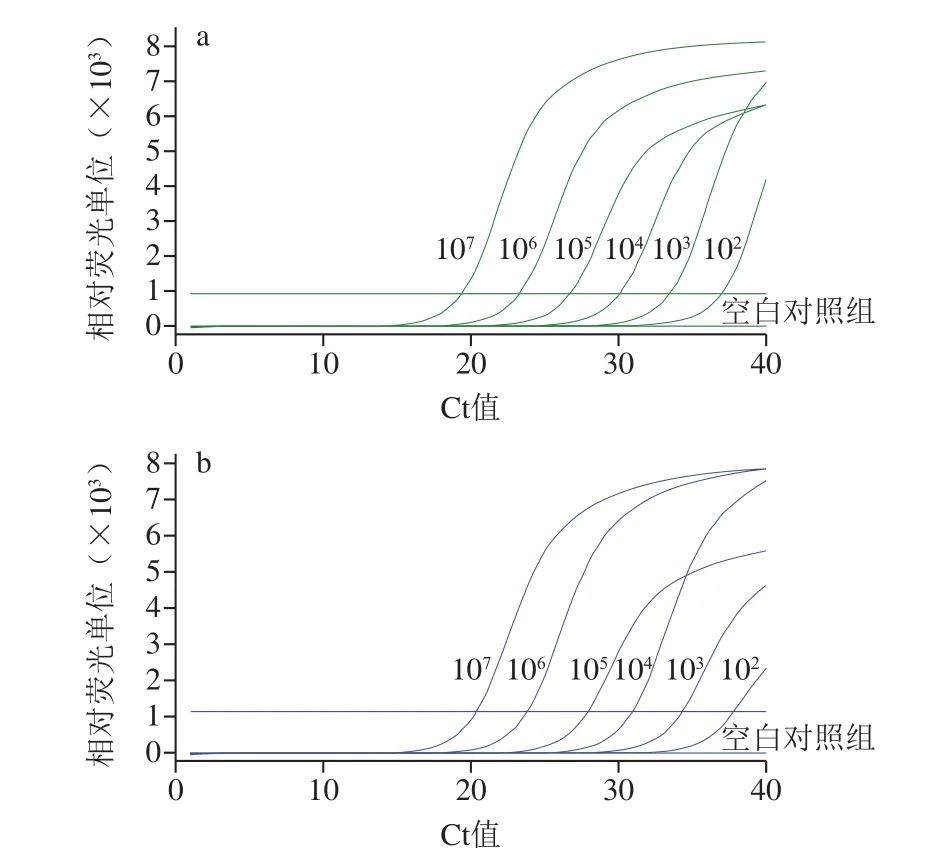
图3 real-time PCR的FAM通道(a)、HEX通道(b)灵敏度Fig.3 FAM channel (a) and HEX channel (b) sensitivity of real-time PCR
2.4 以完整菌细胞的悬液和gDNA为模板的检测
如图4a所示,以完整菌细胞的悬液为模板,当样品的预处理时间延长时,Ct值降低,增加到30 min时,扩增检测效果与以gDNA为模板相比(图4b),Ct值相差较小(ΔCt<1)。这表明使用完整菌细胞的悬液作为模板与使用gDNA作为模板检测效果相当,具有准确性和可行性,而且节省了提取制备模板的时间。
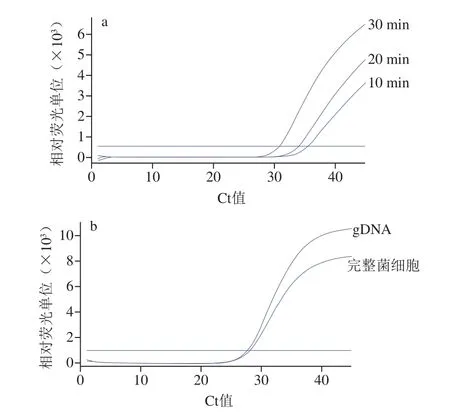
图4 以完整菌细胞的悬液和gDNA为模板对real-time PCR的影响Fig.4 Influence of intact bacterial cell suspension versus gDNA as template on real-time PCR performance
3 讨 论
副溶血弧菌作为一种世界范围内重要的食源性致病菌,具有高度的遗传多样性[16]。据统计,近年我国由副溶血弧菌引起的食物中毒人数已超过沙门氏菌,跃居首位[17]。因此,建立一种针对副溶血弧菌的准确、快速、灵敏的检测方法非常必要。本研究中的靶基因tlh具有种的特异性,常被用作副溶血弧菌快速检测的靶标[18-19];tdh虽然具有5 个不同的亚型(tdh1、tdh2、tdh3、tdh4、tdh5),但其相似度高达97%,具有很高的同源性;而trh1和trh22 个亚型在基因序列上具有一定的差异,同源性仅为84%,使用trh作为检测靶标可能会在一定程度上导致分类错误[20-21]。Okuda等[22]将副溶血弧菌尿素酶阳性(Ure+)分离菌株和阴性(Ure-)分离菌株作为样本,检测其携带trh基因的概率,结果发现:在60 株Ure+分离株中,高达98.3%(59/60)菌株携带trh基因;而在25 株Ure-分离株中,无trh阳性株,表明trh基因与ure基因呈正相关。Iida等[23]利用长而准确的PCR检测发现,trh与ure的间距不超过8.5 kb,表明其在副溶血弧菌上有连锁关系,进一步证实了两者的相关性。使用高度保守的ureR基因代替trh基因为检测靶标,可有效规避因trh基因缺少序列同一性导致分类错误的问题。本研究建立的三重realtime PCR方法根据tlh可区分副溶血弧菌菌株及非副溶血弧菌菌株,以tdh和ureR判断副溶血弧菌对强致病性菌株的从属性,结果表明建立的方法具有良好的特异性。
随着副溶血弧菌大流行菌株的出现,对副溶血弧菌的关注度越来越高,同时对副溶血弧菌的检测方法进行了大量的研究。冼钰茵等[24]针对副溶血弧菌常见的11 种毒力基因(toxR、Collagenase、toxS、trh、tdh、tlh、ureR、flaA、ompW、aspA、fur)建立了2 套六重PCR检测体系,均具有良好的特异性,但其不能进行定量分析,且检出限较高(分别为103、104CFU/mL),而本研究建立的方法能进行准确定量,检出限低至1.8×102拷贝/mL。Zhong Qingping等[25]建立了叠氮溴化丙锭结合实时荧光环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)对副溶血弧菌进行检测,该方法能有效检测处于活的不可培养态的副溶血弧菌,在纯培养液中检出限低至6.8 拷贝/mL,在海产品中检出限为14 拷贝/g,其优点为有效区分死活细胞,检测时间短,但LAMP对引物要求较高,设计较为复杂。高世光等[26]建立了基于Taqman探针检测副溶血弧菌tlh、trh毒力基因的双重real-time PCR方法,该方法特异性好,检出限低至20 CFU/mL,而本研究建立的方法能在一次反应中检测出tlh、tdh、ureR3 个毒力基因,与该方法相比,本研究建立的方法可对副溶血弧菌菌株进行更精准的分类,进一步评估菌株的致病力。万莹等[27]针对副溶血弧菌的toxR、trh、tdh建立了三重real-time PCR的检测方法,toxR作为副溶血弧菌的检测靶标,与tlh具有相当的灵敏度及特异性[28-29],而本研究使用ureR而非trh更能避免分类错误的问题。此外,本研究直接以完整菌细胞的悬液作为模板可缩短检测时间而不影响Ct值,方便快捷。随着微滴数字PCR(droplet digital PCR,ddPCR)的出现,对副溶血弧菌的检测方法的研究也得到了巨大突破。Lei Shuwen等[30]建立了ddPCR检测副溶血弧菌tlh、trh、ureR及orf8的四重检测方法,该方法能够对副溶血弧菌浓度范围在3.9×101~3.9×107CFU/mL的实际食品样品进行准确测定,并能准确鉴定携带不同毒力基因的副溶血弧菌,但高价仪器一定程度上限制了该方法的广泛应用。
4 结 论
本研究建立的三重real-time PCR方法能在一次反应中准确、快速、灵敏地定量检测副溶血弧菌,并能区分致病性和非致病性副溶血弧菌;在高浓度的背景细菌存在下,该方法仍具有良好的特异性,其检测的线性范围为1.8×102~1.8×107拷贝/mL,检出限为1.8×102拷贝/mL;此外,该方法可以直接将菌液作为模板进行扩增,样品预变性时间为30 min时,其Ct值与使用DNA为模板的Ct值相近。本研究建立的方法为食源性致病菌检测提供了参考依据,具有较好的推广应用价值。
