非生物储存因素互作对储藏土耳其带壳榛子呼吸、干物质损失和黄曲霉毒素B1污染的影响
2021-12-03KalliopiMylonaAngelMedinaNareshMagan
Kalliopi Mylona, Angel Medina, Naresh Magan✉
(英国克兰菲尔德大学,环境和农业食品领域学院,应用真菌学团队,英国 克兰菲尔德,MK43 0AL)
榛子(Corylus avelannaL.)是一种受欢迎的树生坚果,主要种植在土耳其和南欧。土耳其是最大的榛子生产国,约占世界产量的 75%[1]。榛子是重要的营养来源,尤其是脂质,包括单不饱和脂肪酸、生育酚和植物酚以及酚类化合物,所有这些成分都有益于健康[2-3]。
收获的带壳榛子具有良好的屏障,可以防止真菌污染和潜在的真菌毒素污染,尤其是黄曲霉毒素(AFs)。然而,榛子的干燥缓慢,尤其是自然晒干可能需要数周时间,为真菌定殖和AFs污染提供有利条件。若遇较差的储存条件会加剧AFs的污染[1]。因此,包括欧盟在内的许多国家对此类坚果的最大黄曲霉毒素 B1(AFB1,1a类致癌物)和总 AFs有严格的法定限制,AFB1和总 AFs分别为 5 和 10 µg/kg[4]。
榛子与其他可食用种实一样,具有生命,并在安全储存和水分条件下(水分活度,aw;<0.70 aw= 7.5%~8% 水分含量(m.c.))通常进行非常低水平的呼吸。在这些条件下,虽然真菌污染物存在,但它们无法引发腐败或毒素污染[5-6]。然而,榛子采收时非常潮湿>25% m.c.,在干燥过程中m.c. 减少到安全水平。但是,缓慢或低效的干燥和随后的储存可能污染上真菌,特别是黄曲霉类群(例如,黄曲霉)能在坚果上定殖,导致AFs,尤其是AFB1的污染增加。这些物种喜干(嗜旱)并且由于它们能够产生相关的水解酶,能在中等湿度条件下迅速定殖富含脂质的底物[7]。这就会导致干物质损失(dry matter losses,DML)、异味和营养质量恶化[8]。
呼吸作用已被有效地用于测量储存商品的代谢活动,尤其是谷物[9-14]。呼吸作用是碳水化合物的有氧氧化,由以下方程表示[15]:

这包括商品(谷物、坚果)和伴随微生物的呼吸作用。多年来,人们一直关注微生物和商品呼吸对总呼吸的相关贡献。Seitz等[16-17]报道,在储存过程中,真菌对 DML的贡献增加的速度取决于主要的 m.c.、温度、籽粒损坏程度和污染商品的叶际表面真菌群落。
最近的研究表明,在一系列商品(谷物、花生)储存期间CO2产生量的变化,可以有效地用作 DML的指标,这可能与潜在的真菌毒素污染有关[11-12,18-20]。这些研究利用碳水化合物/脂质的氧化会产生 CO2,在温度×aw相互作用条件下的有氧呼吸速率来计算质量损失及 DML比例。使用气相色谱法测定的呼吸率(R)及其相关的DML可建立“储存风险指数”,以预测储存的谷物和坚果中的整体质量变化和真菌毒素污染情况[8,21]。
已发现0.04%~2%之间的DML能影响种实质量和与欧盟法定最大限值相关的真菌毒素污染风险[11-14,17-20]。最近对储存在不同m.c.s和温度下的带壳花生进行的研究量化了呼吸率和 DMLs,并将其与 AFB1污染相关联[20]。这被用来评估不同储存条件的相对风险,这些条件会影响超过欧盟法定限制的 AFB1污染水平。尽管榛子是一种重要的食用商品,被广泛用于烘焙食品、巧克力零食和冰淇淋的各种加工食品链,但目前还没有对榛子进行类似的研究。
本研究的目的是(a)量化呼吸速率,(b)干物质损失,(c)AFB1污染包括自然污染的榛子以及储存之前附加接种黄曲霉毒素的榛子,并首次建立了DMLs与AFB1污染之间的关系。
1 材料与方法
1.1 仪器与设备
露点/水活度计AQUALAB 4TE系列:美国华盛顿,Decagon Instruments;伽马辐照:12 kGy,英国斯温登 Syngergy Health;40 mL 透明玻璃挥发性有机物分析(VOA)小瓶:Supelco 23188;免疫亲和柱:奥地利图伦,Romer。
1.2 榛子和水分吸附曲线
生榛子:土耳其马尔马拉研究中心TUBITAK MAM。将已知体积的无菌水(0~2 mL)加入到40 mL玻璃通用瓶中的5 g自然污染带壳榛子样品中。将其密封、剧烈摇晃并在4 ℃下储存过夜以平衡水分。然后在室温(T)下平衡样品,使用露点/水活度计 AQUALAB 4TE系列测量每个子样品的aw值。通过添加水量(mL)与测量的aw值作图确定水吸附曲线。曲线用于确定每组实验达到目标 aw水平所需的确切水量。之后,通过在105 ℃的烘箱中干燥16 h来测定样品的m.c。
对于黄曲霉接种实验,成批榛子(500 g× 4)最初经过伽马辐照以杀死所有微生物,并储存在4 ℃的密封袋中直至使用。在此辐射剂量下,坚果保留了萌发能力,但没有真菌污染[21]。还为辐照过的生榛子制作了水分吸附曲线。
1.3 自然污染的带壳榛子的储存方式对干物质损失的影响
将自然污染的带壳榛子样品(160 g)置于500 mL Duran烧瓶中表面消毒。参照吸湿曲线,添加无菌水以获得0.70(对照)、0.85、0.90和0.95(=5%、10%、12.5%和18% m.c.湿重基)的目标aw值,4 ℃下储存 24 h。每种处理四个重复(10 g),置于40 mL透明玻璃挥发性有机物分析(VOA)小瓶中,小瓶具可密封PTFE盖,内置硅胶隔垫,以便于稍后从顶空气体采样。将相同aw水平的榛子样品与 2 × 500 mL 甘油/水溶液的烧杯一起放在12-L聚丙烯环境室中培育,保持与每个aw处理值相对应的大气目标平衡相对湿度(ERH)。榛子样品培育 5 d。
本研究中使用的储存处理温度范围为 15~30 ℃,aw范围为 0.70~0.95。每 24 h 测量一次二氧化碳(CO2)产量。采样方法涉及使用气相色谱测量顶部空间中积累的 CO2,如 Mylona &Magan(2011)所述[11]。CO2百分比浓度用于计算(a)以mg CO2(kg/h)为单位的呼吸(R)速率,(b)储存 5 d后 CO2的总累积量和(c)总DML[11]。
1.4 测量接种黄曲霉榛子储存期间的呼吸活动、干物质损失和黄曲霉毒素B1污染
从榛子中分离出已知产黄曲霉毒素的黄曲霉菌株1217,由土耳其TUBITAK MAM友情提供。该菌株在MEA培养基25 ℃培养5~7 d。黄曲霉孢子悬浮液用作储存实验的接种物。用无菌环接种,将分生孢子置于 10 mL含有 0.01% Tween 80的无菌水中。剧烈摇动获得孢子悬浮液。通过使用血细胞计数器用无菌水稀释调节浓度至 5×107个孢子/mL。
参照水吸附曲线,用无菌水将消毒过罐中的榛子(每批100 g)调节至0.85、0.90和0.95 aw(=10%、12.5%和18% m.c.)。实际添加的水量略少以便添加接种体。在 4 ℃平衡过夜,处理组25 ℃平衡。然后将 0.2 mL等分的黄曲霉接种体加入榛子处理样品中,并充分混合。将每个aw处理的四个重复放置在40 mL玻璃瓶中,并再次放入之前所述的环境室中培育。每个aw水平的处理和重复分别在15、20、25和30 ℃下培育。
每24 h,将用于不同处理和重复的玻璃瓶用含有硅胶隔膜(Supelco 23188)的PTFE盖密封1 h,然后用顶空注射器采集气体样品。气样注入GC进行 CO2定量。取样后,取下盖子,样品返回到每温度和aw水平各自的环境室。每天重复该程序。
1.5 干物质损失计算
使用前面详述的碳水化合物/脂质的有氧氧化方程。通过消耗的氧气与产生的二氧化碳的比率计算呼吸商,来确定干物质损失(DML)。依方程式,每公斤谷物中 14.7 g CO2相当于 1%的DML。计算了自然污染的榛子和附加接种黄曲霉孢子的榛子的不同储存处理的DML。
通过整合呼吸率与时间数据,确定DML百分比(%)与时间曲线关系。储存周期时间分24 h,每个周期的CO2量通过呼吸率计算。每个周期的CO2总量为储存期间产生的 CO2总量,用于计算DML。
1.6 黄曲霉毒素B1定量
在每个实验结束时,榛子处理组/重复组在60 ℃下干燥48 h,研磨并在4 ℃下储存,等待进一步分析。将5 g子样品与10 mL 70%乙醇混合,置于振荡器上1 h。使用含有10 mL去离子水的注射器过滤,并将总共 5 mL的滤液加到免疫亲和柱上,滤液以3 mL /min的流速通过柱子。用20 mL去离子水以5 mL/min的流速洗涤柱子,空气通过注射器至少3次。结合到柱子上的黄曲霉毒素用1 mL甲醇以0.5 mL/min的流速洗脱。将黄曲霉毒素收集到Eppendorf小瓶(2.5 mL)中并转移到琥珀色玻璃液相小瓶中。
HPLC分析∶流动相由水∶甲醇∶乙腈(6∶3∶2)组成;每升加入 350 mL 4 M 硝酸和 0.120 g溴化钾。流速为1 mL/min,柱温为22 ℃。一式三份进样 100 mL的样品。荧光检测激发波长为360 nm,发射波长为 430 nm。使用 PTFE 管(30 cm)用电化学产生的溴进行柱后衍生,以增强黄曲霉毒素的荧光强度。为此,在色谱柱和荧光检测器之间放置了一个提供100 mA电流的电化学池。
1.7 统计分析
所有实验三个生物学重复,进行两次实验。使用Microsoft Office Excel 2007和软件包STATISTICA 9分析数据。平均值的标准误差已在所有试验中计算,并在图中用竖线表示或包含在三维图例中。
DML和毒素分析数据的统计分析:Shapiro-Wilk,W正态性检验用于评估总DML和毒素数据的正态性,而数据内方差的同质性通过Levene检验评估。对非正态分布的数据进行对数变换,以稳定方差由Shapiro-Wilk W检验重新评估的及其正态性。通过单因素和双因素方差分析(ANOVA)分析正态分布的数据,以确定各因素(aw和温度)及其相互作用(aw×T)对变量影响的显著性。通过Kruskal-Wallis秩和检验等级分析对数转换仍非正态分布的数据。
DML和毒素产生数据之间的相关性:制作了DML数据与黄曲霉毒素 B1的散点图。Spearman秩和检验用于确定每种情况下两个变量之间相关性的显著性。
2 结果与分析
2.1 自然污染的榛子
表1显示了一系列水分活度(aw)条件对经25和30 ℃下培养 120 h后的自然污染榛子平均呼吸率和总 DML的影响。研究表明,在这两个温度下,呼吸速率和 DML都随着可用水的增加而增加。值得注意的是,在相对安全的储存条件(0.70 aw)下,即使在两个温度下与非常低的相关 DML培育 120 h后,呼吸也很少发生。在0.85 aw,呼吸速率和 DML都开始增加,并在两温度下最湿的0.95 aw处理中观察到最高值。值得注意的是,在最大可用水处理中,温度增加到30 ℃时,呼吸速率是25 ℃时的两倍多。

表1 在(a) 25和(b) 30 ℃培养120 h后,水分活度和储存温度对自然污染榛子的累积呼吸速率和平均总干物质损失(DML ± SE)的影响Table 1 Effect of water activity and temperature of storage on accumulated respiration rates and mean total dry matter losses(DML ±SE) of naturally contaminated hazelnuts after 120 h incubation at (a) 25 and (b) 30 ℃.(a)
2.2 接种黄曲霉的榛子
在不同水分活度×温度条件下储存对呼吸、干物质损失和黄曲霉毒素 B1污染的影响。图1显示了25 ℃下 aw对接种了黄曲霉的储存榛子的平均呼吸率的短时影响。在0.95 aw时黄曲霉定殖最为迅速。在15~30 ℃下的数据用于计算接种了额外黄曲霉的榛子的DMLs。图2显示了在aw×温度的相互作用条件下,黄曲霉定殖对储存榛子DMLs的影响。无论储存温度如何,15~20 ℃时的呼吸率都非常低。仅在25和30 ℃以及≥0.90 aw时才有显著的DMLs。

图1 接种黄曲霉在25 ℃和三种不同水分活度下储存的榛子呼吸时间变化(SEmax = 80.41)Fig.1 Temporal changes in respiration of stored hazelnuts inoculated with A. flavus and stored at 25 ℃ and three different water activities (SEmax = 80.41)
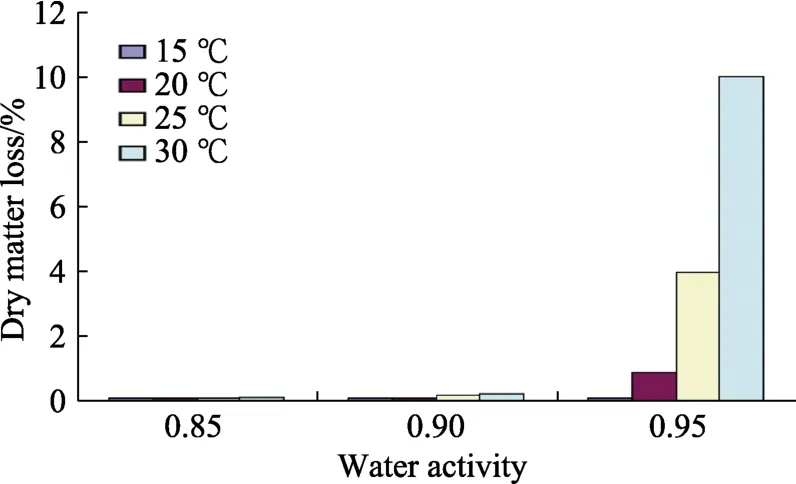
图2 与储存温度×水分活度相关的接种黄曲霉的储存榛子的干物质损失(SEmax = 0.9)Fig.2 Dry matter losses of stored hazelnuts inoculated with A. flavus in relation to storage temperature ×water activity (SEmax = 0.9)
图3显示了在15~30 ℃下不同aw水平的接种黄曲霉对榛子 AFB1污染水平的影响。图中清楚地表明,在 20~30 ℃ 0.90 aw下产生了大量的AFB1,在 0.85 aw时毒素污染显著减少。在15~20 ℃时,在 0.80 和 0.85 aw下没有 AFB1产生。在产生 AFB1的地方,其含量均高于欧盟立法限制 5 µg/kg。
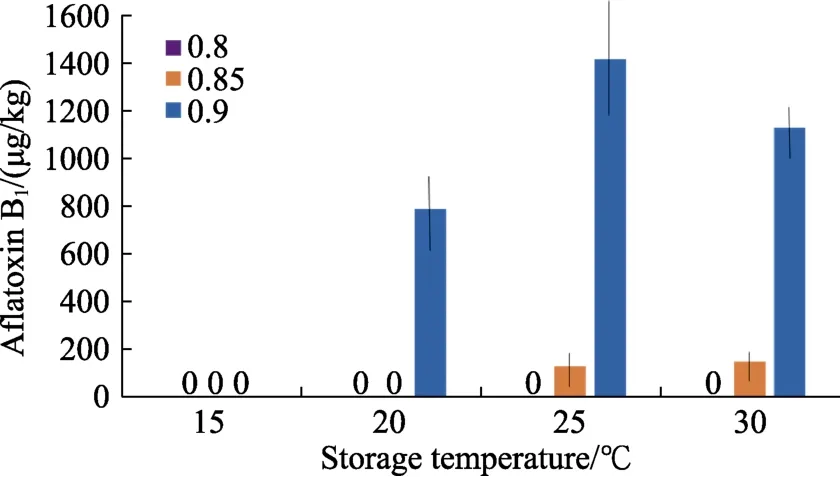
图3 储存温度和水分活度对接种黄曲霉榛子10天后污染的影响Fig.3 Effect of storage temperature and water activity on contamination of hazelnuts inoculated with A. flavus after 10 days
图4采用了依据 DMLs和 AFB1污染的榛子处理方面的所有数据,并检验了这些数据与欧盟立法限制标准的相关性,表明 AFB1和 DMLs之间存在显着的正相关。红色虚线表示置信限。在大约 0.8%~1.0% DML时,存在超过欧盟法定限制的重大风险,即坚果中AFB1的最大污染。

图4 黄曲霉毒素B1和干物质损失(%)之间的相关性Fig.4 Correlation between aflatoxin B1 and Dry Matter Losses (%)
3 讨论与结论
这项研究表明,在不同温度和可用水条件下储存的自然污染的土耳其带壳榛子显著影响了相对呼吸速率和产生的CO2总量。CO2产生水平(约775 和 2 600 mg CO2/kg/h)在 25 和 30 ℃的 0.95 aw(=18% m.c.)情况下明显更高。此前,Garcia-Cela等[20]的研究表明,带壳花生的最佳呼吸活动发生在 30~35 ℃时,30 ℃的总累积 CO2水平约为2 080 mg CO2/kg/h,这些坚果的脂质和坚果的呼吸作用都很高,相关的自然菌群可能会影响整体呼吸活动。在其他谷物商品中,也发现水稻、糙米和玉米的总呼吸活性在≥0.95 aW时最佳,尤其是在30~35 ℃接种黄曲霉时表现明显[14,19]
总累积CO2用于量化不同储存条件下的相对DMLs。在 0.95 aw时大约 10%发生在 25~30 ℃。Garcia-Cela等[20]的研究发现,在 30~35 ℃和0.95 aw时,壳花生中的 DMLs约为 14%~15%。在玉米上的研究表明,在这些条件下,DML发生高达17%。相比之下,水稻和糙米接种黄曲霉时,DMLs分别为3.5%和20%[19]。未加工的水稻可受到外部保护层的保护,与加工过的糙米相比,减少了真菌的潜在侵入。
在本研究中,在0.95 aw和20~30 ℃下,附加接种黄曲霉能导致最大的呼吸活性和 DMLs。这相当于在30 ℃和0.95 aw下质量损失约为10%。附加接种并没有导致贮藏榛子中的 DML显著升高。这与小麦、玉米或带壳花生形成鲜明对比,他们在接种产毒真菌时DMLs要高得多[12,14]。
在 20~30 ℃中,AFB1的产量在 0.90 aw时明显高于 0.85 或 0.80 aw。这表明,在<0.85 aw时,产生这种致癌真菌毒素的风险显著降低,尤其是在 15~20 ℃时,更是如此。依据 DMLs和 AFB1在不同 aw×温度条件下产生的所有数据绘制的图,提供了有关毒素污染超过法定限制的相对风险的有用信息。图中清楚地表明,在 0.6%~1%DML下,榛子的污染将超过推荐的最大污染水平。这说明干物质的微小损失会导致 AFB1污染超过法定限制,从而可能导致此类批次可能被拒。
这也表明,储存的土耳其带壳榛子由真菌腐败造成损失的耐受较低,尤其在无效的干燥方式更是如此。榛子富含脂质,从而吸湿性很强。因此,它们通常可以在采后储存期间干燥后重新吸收环境中的水分,从而导致产毒素腐败真菌的定殖。此前对谷物的研究发现,A型和B型单端孢霉烯、玉米赤霉烯酮(小麦)和伏马毒素水平(玉米)引起的约1%的霉菌毒素污染就超过了欧盟立法限制[11-14,22]。对于花生等富含脂肪酸的坚果,AFB1超过法定限制的污染水平为 0.56%[20]。因此,坚果的耐受性可能比谷物低得多。如果榛子被有效干燥到安全的水分含量,它可能会更好,保护坚果肉不被真菌毒素定殖和污染。然而,需要注意的是,坚果和外壳之间的内部空间有时可以为嗜干真菌如黄曲霉的生长提供微环境,这种情况特别容易在外壳因害虫或在收获和干燥阶段受损时发生[23]。巴西坚果中就发现这种情况,从而导致壳坚果中的 AFB1污染增加[24]。这些研究信息可以被有效地从风险管理的角度加以利用,为人类消费或动物饲料使用,制定出低、中和高风险的不同分类类别[13]。
备注:本文的彩色图表可从本刊官网(http:// lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。
