贝莱斯芽孢杆菌YB-145 对小麦纹枯病的防治效果及促生作用
2021-12-03夏明聪邓晓旭齐红志孙润红潘娅梅杨丽荣
夏明聪,邓晓旭,齐红志,谢 夏,徐 文,张 洁,孙润红,潘娅梅,武 超,杨丽荣
(1. 河南省农业科学院植物保护研究所/河南省生物农药工程研究中心,河南郑州 450002;2. 河南省农业科学院农业经济与信息研究所,河南郑州 450002)
小麦(Triticum aestivumL.)是世界范围内人类和牲畜的主要食物[1],其产量和质量受到多种真菌病害的影响[2]。其中,由禾谷丝核菌(Rhizoctonia cerealis)等引起的小麦纹枯病是制约我国小麦高产、稳产的因素之一。禾谷丝核菌会破坏小麦的茎秆等组织部位,影响营养物质和水分的运输,导致出现枯白穗,降低小麦的产量和品质,最终造成小麦大幅度减产甚至绝收[3‑4]。目前,小麦病害的防治主要是化学防治[5‑7],但长期大量施用化学农药易使小麦致病菌产生抗药性,且对生态环境和人畜健康造成巨大威胁[8‑10]。
生物防治在改善作物生长、提高作物产量及品质的同时对生态环境也具有安全性,被认为是保障我国农业绿色、安全、可持续发展的病害防治手段。目前,国内外利用内生芽孢杆菌防治小麦纹枯病的研究取得了较大的进展。PENG 等[11]将Bacillus subtilisNJ-18和化学药剂复配显著降低了小麦纹枯病的发病指数;WEN 等[12]分离的内生Bacillus subtilisEBS05 能有效防控由R. cerealis引起的小麦纹枯病,防控效果达到80%以上;JI 等[13]分离的4 株芽孢杆菌可以有效抑制R.cerealis菌丝的生长并促进小麦幼苗的生长。另外,从小麦根际分离出来的芽孢杆菌对小麦生长具有促进作用[14‑16]。总之,小麦内生芽孢类杆菌对小麦纹枯病的生物防治及对小麦促生具有相当大的潜力。虽然前人对小麦纹枯病的生物防治做了较多研究,但不同生防菌株的生物学特性、抑菌能力以及促生能力及田间应用效果存在较大差异。河南省农业科学院植物保护研究所分子微生物研究室2018 年分离筛选得到一株抑菌效果较好的生防菌株(命名为YB-145),在此基础上,本研究进一步系统阐明了菌株YB-145 的生物学特性及其对小麦纹枯病的防病效果和对小麦的促生作用,旨在为该菌株的开发应用以及小麦纹枯病的防治提供理论依据。
1 材料和方法
1.1 供试菌株、供试植物病原菌和小麦品种
供试菌株YB-145于2018年采自河南省洛阳市宜阳县柳泉镇小麦田,从感染纹枯病的小麦根部分离得到;供试6 种植物病原菌分别为禾谷丝核菌(Rhizoctonia cerealis)、西瓜枯萎病菌(Fusarium oxysporumf.sp.niveum)、小麦根腐病菌(Bipolaris sorokinana)、芹菜早疫病菌(Alternaria solani)、花生果腐病菌(Fusarium moniliforme)、禾谷镰刀菌(Fusarium graminearumPH-1),均由河南省农业科学院植物保护研究所分离、保存;供试小麦品种为郑麦366。
1.2 菌株YB-145的抑菌谱测定
PDA 培养基:马铃薯200 g、琼脂20 g、葡萄糖20 g,加无菌水定容到1 000 mL,121 ℃、20 min 高温高压灭菌。在含PDA 培养基的培养皿中心分别接种直径0.5 cm 的6 种植物病原菌菌饼,在距离病原菌3 cm 处对称点接菌株YB-145,并将未接内生菌的平皿设置为对照组,28 ℃恒温培养5 d。
1.3 菌株YB-145的鉴定
对菌株YB-145 进行形态特征、生理生化特性、革兰氏染色等试验,具体参照东秀珠等[17]的方法。
按照TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0 试剂盒说明书提取菌株YB-145 的基因组DNA,并以提取到的基因组DNA 为模板 ,采 用 细 菌 通 用 引 物 27-F (5′-AGAGTTTGATCCTGGCTCAG-3′ )和1492-R(5′-GGTTACCTTGTTACGACTT-3′)扩增其16S rRNA 基因序列。PCR 产物由尚亚生物工程(上海)股份有限公司进行测序,将测序结果与NCBI 数据库进行比对。采用Mega 7.0软件中的MUSCLE软件将测序得到的YB-145 16S rRNA 序列与从NCBI 数据库下载到的已知菌种的16S rRNA序列进行比对,然后采用NJ 法构建菌株YB-145 的系统发育树,抽样次数为1 000[18]。
1.4 菌株YB-145的促生特性测定
1.4.1 产IAA(吲哚乙酸)能力 将菌株YB-145 接种于含2.5 mmol/L L-色氨酸的NB 培养基中,37 ℃、180 r/min 摇床振荡培养48 h 后,12 000 ×g离心10~15 min,取1 mL 上清液与2 mL Salkowski 试剂(浓硫酸150 mL、双蒸馏水250 mL、0.5 mol/L 氯化铁7.5 mL)混匀后于黑暗处室温显色30 min,溶液变为粉红色,即表明该菌株具有产IAA的能力。
1.4.2 产铁载体能力 采用CAS 平板法对菌株YB-145 的产铁载体能力进行测定。将培养好的菌株YB-145 用灭菌牙签接种在CAS 固体平板上,37 ℃培养2 d,重复3 次,观察菌落周围培养基颜色是否发生变化,由蓝色变成浅黄色时即可判断该菌株产生铁载体[19]。
1.5 菌株YB-145的生防特性测定
1.5.1 β-1,3 葡聚糖酶活性 挑取单个菌落,接种于β-1,3 葡聚糖酶检测培养基(葡萄糖0.05 g、酵母提取物0.5 g、蛋白胨1 g、氯化钠0.5 g、刚果红0.01 g、琼脂15 g、1 L 双蒸水,pH 值为7.0,121 ℃灭菌20 min)上,28 ℃培养10 d,若培养皿内出现无色水解区,则表明该菌株具有β-1,3-葡聚糖酶活性。1.5.2 蛋白酶活性 用牙签挑取培养好的单菌落于蛋白酶检测培养基(脱脂奶粉10 g、蛋白胨10 g、氯化钠5 g、氯化钙0.1 g、蒸馏水1 L、琼脂18 g,pH值7.2~7.4,121 ℃灭菌20 min)上。于30 ℃培养2d,菌落周围产生清亮透明圈即认为该菌株能产生蛋白酶。
1.6 菌株YB-145的皿内促生试验
挑选饱满的小麦籽粒,用无菌水冲洗,然后用75%乙醇消毒30 s,再用无菌水冲洗3 遍,摆放于铺有滤纸片(用无菌水润湿)的培养皿中,25 ℃保湿培养24 h 至小麦籽粒发芽露白,然后分别用5 mL 1×107、1×108、1×109cfu/mL YB-145 菌悬液浸种2 h,以无菌水浸种作为对照。每个处理重复3次。将浸种后的小麦籽粒摆放在直径为9 cm 铺有滤纸片(用无菌水润湿)的培养皿中,每皿20 粒种子。放置于25 ℃、12 h/12 h 光暗交替条件下保湿培养10 d 后,取样测定小麦幼苗的鲜质量和高度。小麦幼苗的促生指标统计方法如下:将皿中的幼苗根部完整从滤纸上分离下来,无菌水冲洗干净并吸干水分。用无菌剪刀剪掉小麦籽粒下方的根部后称质量,测量。
1.7 菌株YB-145的盆栽防病试验
根据1.6 的结果,选取1×108cfu/mL YB-145 菌悬液按照1.6 的方法浸种,以无菌水浸种作为空白对照。将从麦田采集的土壤进行灭菌,然后把含有小麦纹枯病菌(禾谷丝核菌)的麦粒砂培养基与土按照1∶15 的比例混匀,装入口径10 cm、高10 cm 的花盆至盆高的2/3处,每盆播种20粒大小一致、健康的小麦籽粒,每个处理重复3次。于25 ℃、12 h/12 h光暗交替条件温室培养20 d 后,调查小麦纹枯病的发病情况。病情分级标准:0级(不发病)、1级(叶鞘发病但茎秆不发病)、3 级(叶鞘发病,并侵入茎,但茎秆病斑环茎不足1/2)、5 级(茎秆病斑环茎超过1/2,但不倒伏或折断)、7 级(枯死、倒伏、枯白穗)。病情指数=∑(各病情级别×该病级的发病株数)/(分级标准中最高级别数×调查总株数)×100;防治效果=(对照组病情指数-处理组病情指数)/对照组病情指数×100%。
1.8 菌株YB-145对小麦纹枯病的田间防治效果
在河南省邓州市夏集镇苏营村对菌株YB-145进行田间防治效果验证试验,试验地块常年种植小麦且纹枯病发生严重,病原菌鉴定为禾谷丝核菌(Rhizoctonia cerealis)。将菌株YB-145 接种在LB 培养液中37 ℃、180 r/min 振荡培养至OD600值为0.8。试验共设置3 个处理:(1)30 mL YB-145 菌液加170 mL 无菌水对10 kg 小麦进行拌种;(2)5 mL 6%戊唑醇加无菌水195 mL 对10 kg 小麦进行拌种(药剂对照);(3)200 mL 无菌水对10 kg 小麦进行拌种(空白对照)。播种前1 d 在室内进行拌种包衣,晾干后备用。每处理重复3 个小区,每小区宽3 m、长10 m,随机排列。播种时间为2019年10月25日,播种量为225 kg/hm2,小麦生长周期田间管理措施一致,收获日期为2020 年6 月5 日。分别于拔节期(2020 年3 月5 日)和抽穗期(2020 年5 月7 日)调查2次,记录发病率及枯白穗率。调查方法为:每小区随机5 点取样,每点调查100 株。病情分级标准同1.7。病情指数=∑(各病级对应病穗数×相对级数值)/(调查总穗数×最高级数值)×100;防治效果=(空白对照区病情指数-处理区病情指数)/空白对照区病情指数×100%;增产率=(处理组产量-对照组产量)/对照组产量×100%。
1.9 数据统计分析
采用SPSS 21.0软件对数据进行统计学分析。
2 结果与分析
2.1 菌株YB-145的抑菌谱
由图1 可见,菌株YB-145 对禾谷丝核菌、西瓜枯萎病菌、小麦根腐病菌、芹菜早疫病菌、花生果腐病菌、禾谷镰刀菌的生长均有明显的抑制作用,其中对禾谷丝核菌菌丝生长的抑制作用最为明显。
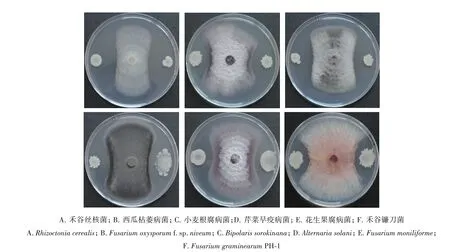
图1 菌株YB-145的抑菌谱Fig.1 Inhibition spectrum of strain YB-145
2.2 菌株YB-145的鉴定
将YB-145 菌株在LA 固体培养基上划线,于37 ℃培养过夜,观察其菌落形态及颜色。菌株YB-145 在LA 培养基上生长状态良好,菌落乳白不透明、表面粗糙、边缘不规则,挑取时呈黏稠状(图2A)。菌体杆状有芽孢,为革兰氏阳性菌(图2B)。
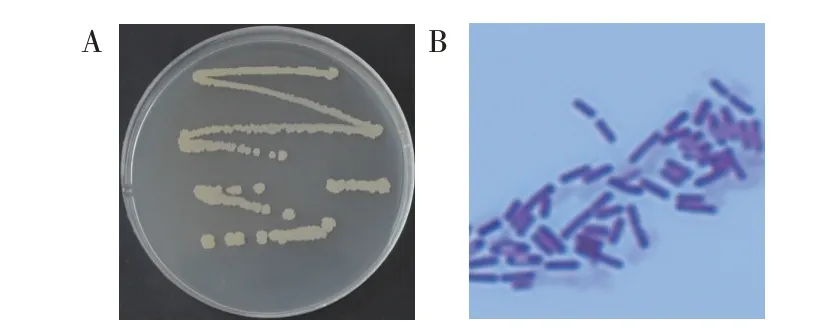
图2 菌株YB-145的菌落形态(A)和菌体显微形态(B)Fig.2 Colonial(A)and microscopic morphology(B)of strain YB-145
生理生化鉴定结果见表1,菌株YB-145 V-P、10%NaCl、淀粉水解酶、明胶水解酶、脲酶试验等均呈阳性,甲基红、柠檬酸盐利用试验等均呈阴性。结合细胞形态特征和生理生化特性试验结果,根据《伯杰氏细菌鉴定手册》[20],初步鉴定YB-145 为芽孢杆菌属(Bacillus)。
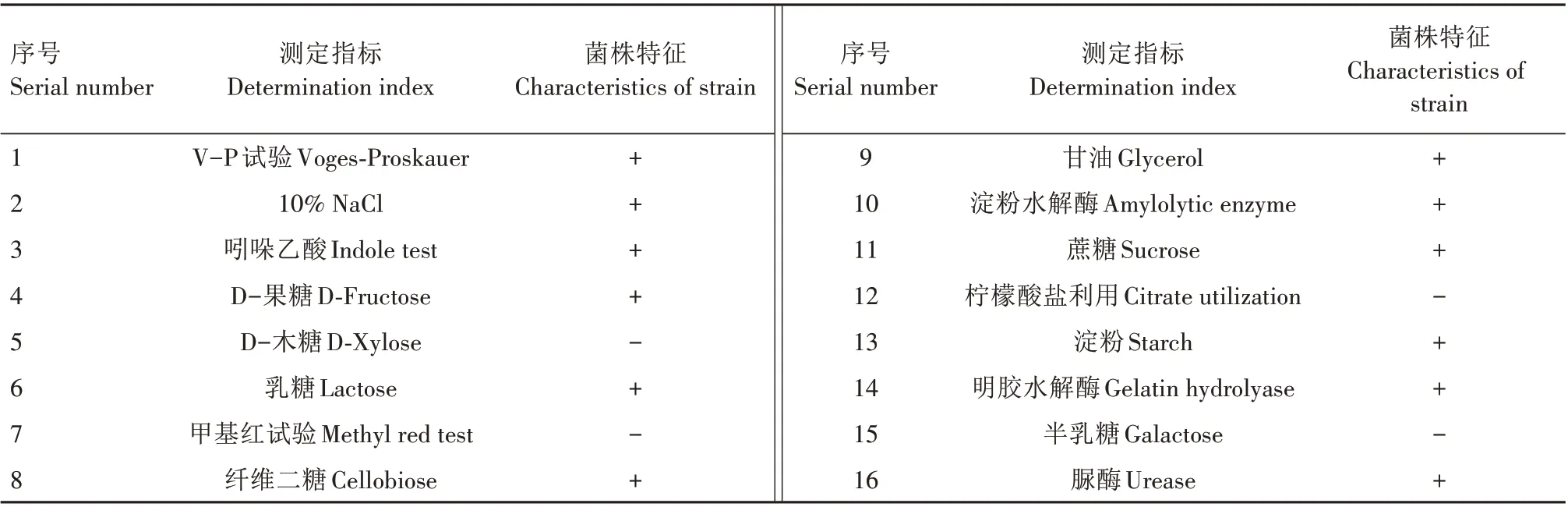
表1 菌株YB-145的生理生化特征Tab.1 Physiological and biochemical characteristics of strain YB-145
以菌株YB-145 基因组DNA 为模板扩增得到16S rRNA 基因,将测序结果与GenBank 中的序列进行比对,结果显示,YB-145 与贝莱斯芽孢杆菌(Bacillus velezensis)的相似度为100%。构建的系统进化树(图3)表明,YB-145 与贝莱斯芽孢杆菌处于进化树的同一分支。因此,将YB-145 菌株鉴定为贝莱斯芽孢杆菌。
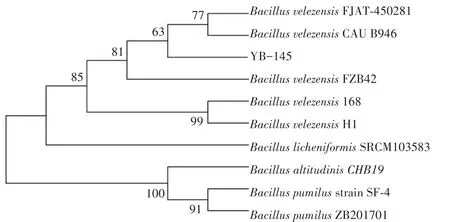
图3 菌株YB-145的系统进化树Fig.3 The phylogenetic tree of strain YB-145
2.3 菌株YB-145的促生作用及生防特性
经过Salkowski 比色法测定,YB-145 菌株具有产生IAA 的能力(图4A);YB-145 菌株在CAS 培养基上生长,菌落周围产生黄色的透明圈,说明其具有产生铁载体的能力(图4B);其在β-1,3-葡聚糖酶培养基和脱脂奶粉培养基上产生透明圈,说明YB-145 菌株具有β-1,3-葡聚糖酶和蛋白酶活性(图4C,D)。

图4 菌株YB-145的促生及生防特性Fig.4 Antifungal and growth-promoting traits of strain YB-145
2.4 菌株YB-145对小麦幼苗的促生作用
室内培养皿中促生试验表明,1×107、1×108cfu/mL YB-145 菌悬液浸种对小麦幼苗生长具有明显促进作用,1×109cfu/mL YB-145 菌悬液浸种对小麦幼苗生长具有明显抑制作用(图5)。由表2 可见,107、108cfu/mL YB-145 菌悬液浸种可使小麦幼苗根部鲜质量分别提高30.95%、34.52%,使地上部分鲜质量分别提高31.97%、46.72%,使幼苗地上部分高度分别提高34.09%、16.89%。
2.5 菌株YB-145对小麦幼苗纹枯病的盆栽防控效果
室内盆栽防病试验的调查结果(表3)表明,经过1×108cfu/mL YB-145菌悬液浸种的小麦幼苗对小麦纹枯病有较好的防控效果,菌株YB-145能够有效降低小麦纹枯病的发病率和病情指数,防效达到73.31%。

表3 菌株YB-145对小麦纹枯病的盆栽防治效果Tab.3 Pot control effect of strain YB-145 on wheat sharp eyespot
2.6 菌株YB-145对小麦纹枯病的田间防治效果
表4 显示,2020 年3 月5 日、5 月7 日2 个时间YB-145 菌液拌种处理病情指数分别为6.51、8.87,防治效果分别达到65.25%、63.37%;6%戊唑醇拌种后,2 个时间小麦病情指数为5.79、7.72,防治效果达到70.27%、73.65%。结果表明,YB-145 菌液拌种能有效防治小麦纹枯病,其防治效果接近化学农药6%戊唑醇悬浮种衣剂。产量结果显示,空白对照产量为8 372.17 kg/hm2,YB-145 菌液拌种后小麦产量达到9 057.45 kg/hm2,增产达8.2%;6%戊唑醇悬浮剂拌种后,小麦产量为8 854.73 kg/hm2,增产5.8%。可见,YB-145 菌液拌种具有良好的防治纹枯病的效果,且对小麦具有一定的促生增产效果。
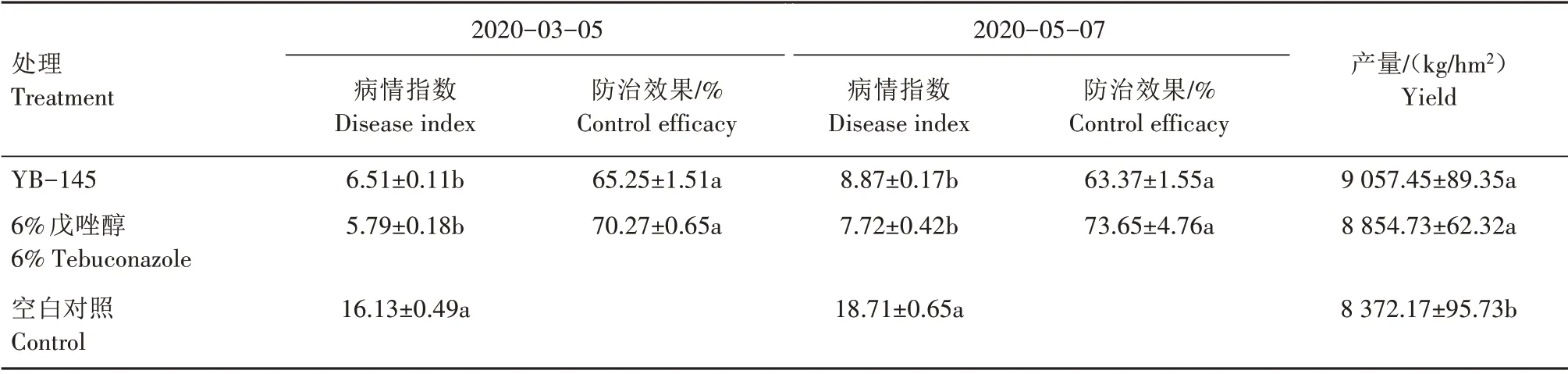
表4 菌株YB-145对小麦纹枯病的田间防治效果Tab.4 Field control efficiency of strain YB-145 against wheat sharp eyespot
3 结论与讨论
寻找防治作物病害的绿色生态环保方法是当今保障我国农业健康、可持续发展面临的巨大挑战之一。生物防治不仅能有效控制作物病害、保证农作物产量和品质,更重要的是能减少对生态环境的破坏,降低化学有害药剂的残留量,进而保障整个生物圈物种多样性和人畜健康安全,为农业的可持续发展助力[21‑22]。
施加适量的菌肥可以改善土壤环境,增加土壤微生物种群的多样性,优化植物根部微生物种群[23]。菌肥中的有益菌群可以通过产生吲哚乙酸等激素类物质促进作物根部养分的吸收,提高植物的抗逆性;也可通过改良土壤微生物环境、抑制病原菌生长等方式间接促进植物的生长发育[24];还可以影响农田的生态功能,有效克服连作的障碍。现阶段市面上的菌肥数量有限,开发优质生防菌肥的任务迫在眉睫,而筛选获得新的高效的生防菌株是菌肥开发的重要前提。
本研究对前期分离筛选得到的菌株YB-145 进行鉴定,发现其属于贝莱斯芽孢杆菌,通过菌株生理生化指标的检测,证明该菌株具有产生IAA 和铁离子载体、分泌蛋白酶和β-1,3-葡聚糖酶的能力。研究表明,贝莱斯芽孢杆菌具有抗菌谱广、生长快、易培养、抗逆性强和生物安全性高等优点[25‑26]。贝莱斯芽孢杆菌可以通过分泌植物激素和铁离子载体等代谢物来可改善土壤微环境,促进植物生长[27‑28],同时也可以分泌抗生素和水解酶等抑制其他微生物生长繁殖,增强植物抗病害的能力。因此,贝莱斯芽孢杆菌YB-145 具有促进小麦生长和防治小麦纹枯病的能力。
本试验同时对贝莱斯芽孢杆菌YB-145 的促生特性、生防特性和促生防病效果等进行验证,结果表明,贝莱斯芽孢杆菌YB-145对6种植物病原菌具有拮抗作用,具有广谱抑菌性;温室盆栽和大田试验结果都显示,菌株YB-145 对小麦幼苗生长具有促生作用,并且对小麦纹枯病具有较好的防控效果。
综上所述,贝莱斯芽孢杆菌YB-145 具有广谱抑菌性,且对小麦的生长具有促进作用,极具开发成为高效生防菌剂的潜力。
