剪切波弹性成像异质性分析校正乳腺病灶BI-RADS分类的价值
2021-12-03贺红霞刘晓芳陈耀东任志翔
贺红霞 刘晓芳 陈耀东 任志翔 陈 武
剪切波弹性成像(shear wave elastography,SWE)技术可获得组织硬度定性及定量信息,重复性好,在乳腺良恶性病灶鉴别诊断中的价值已得到认可[1]。目前较常用的SWE参数有最大弹性值(Emax)、平均弹性值(Emean),但是其仅能反映乳腺病灶硬度大小,无法评估病灶内部硬度分布特征。弹性异质性是指病灶内部不同区域硬度差异分布特征[2]。研究[3]发现乳腺病灶弹性异质性与其良恶性相关。弹性值标准差(Esd)可通过评估病灶内不同区域弹性模量离散程度反映肿瘤病灶的弹性异质性,但其诊断价值及最佳诊断界值方面尚未达成共识[4-5]。本研究使用新指标刚度梯度(SG)定量评估乳腺病灶弹性异质性,旨在探讨其在乳腺影像报告与数据系统(BI-RADS)分类再调整中的应用价值,以期指导临床决策。
资料与方法
一、研究对象
选取2019年8月至2020年10月在山西医科大学第一医院经手术或穿刺活检病理证实的乳腺病灶患者132例,均为女性,年龄17~81岁,平均(44.73±14.37)岁。共135个病灶,其中恶性60个,包括浸润性癌32个,浸润性导管癌(IDC)16个,导管原位癌(DCIS)7个,髓样癌、黏液癌各2个,浸润性小叶癌1个;良性75个,包括纤维腺瘤42个,乳腺增生20个,乳腺炎性病变7个,导管内乳头状瘤5个,腺病1个。纳入标准:有明确的病理结果,均行常规超声及SWE检查。排除标准:乳腺既往手术史、假体植入史、有新辅助化疗、放疗病史,以及妊娠期或哺乳期患者。本研究经医院医学伦理委员会批准,所有患者均签署知情同意书。
二、仪器与方法
1.超声检查:使用法国声科Aixplorer彩色多普勒超声诊断仪,线阵探头,频率4~15 MHz;配备SWE功能。患者取仰卧位,充分暴露双侧乳腺和腋窝,先行常规超声检查观察病灶形态、回声、边缘、血流等声像图特征,进行BI-RADS分类;于病灶最大径切面切换至SWE模式,测量量程0~180 kPa,中心频率默认标准模式,当病灶位置太深或其他原因导致彩色信号充填不佳时,调整至穿透模式。取样区域包括病变本身及周边正常组织,不包括皮肤和胸壁,尽量轻持探头不施压,静置约3~5 s后进行图像采集,每个病灶存取3帧独立的SWE图像。采用Q-Box Trace方式选定感兴趣区(ROI),使ROI尽可能包括病灶弹性图像显示的硬度边缘,自动测得病灶的Emax、Emean、Esd,计算SG,具体公式[5]:SG=(Emax-Emean)+Emax。所有参数均重复测量3次取其平均值。
2.评价标准:参考2013版BI-RADS分类标准[6]对乳腺病灶进行评估,BI-RADS 3类及4a类病灶判定为良性,BI-RADS 4b类及以上病灶判定为恶性;通过受试者工作特征(ROC)曲线确定最佳SWE诊断参数及其截断值,当病灶SWE参数值大于截断值时判定为恶性,小于等于截断值时判定为良性;SWE参数校正BI-RADS分类方法[4,7]:将大于SWE参数截断值病灶行BI-RADS分类升高一级,小于等于截断值者行BI-RADS分类降低一级,BI-RADS 5类者不升级,BI-RADS 3类者不降级。
三、统计学处理
应用SPSS 21.0及Med Calc 18.2.1统计软件,计量资料以±s表示,两组比较行t检验。计数资料以频数或率表示,组间比较采用Fisher确切概率法或χ2检验。以病理结果为金标准,绘制ROC曲线评估SWE各参数、BI-RADS分类对乳腺良恶性病灶的鉴别诊断效能,曲线下面积(AUC)比较行Z检验。P<0.05为差异有统计学意义。
结果
一、乳腺良恶性病灶SWE参数比较
SWE各弹性模量参数中,乳腺恶性病灶SG、Esd、Emax、Emean均高于良性病灶,差异均有统计学意义(均P<0.001)。见表1。
表1 乳腺良恶性病灶SWE参数比较(±s) kPa

表1 乳腺良恶性病灶SWE参数比较(±s) kPa
SG:刚度梯度;Esd:弹性值标准差;Emax:最大弹性值;Emean:平均弹性值
病理结果良性恶性t值P值Emean 18.38±7.2838.83±19.24-8.48<0.001 SG 63.89±31.06227.64±119.68-11.39<0.001 Esd 7.49±4.0825.33±13.38-10.94<0.001 Emax 41.06±17.78133.22±68.05-11.26<0.001
二、SWE各参数鉴别乳腺良恶性病灶的诊断效能比较
ROC曲线分析显示,SG、Esd、Emax、Emean预测乳腺恶性病灶的AUC及诊断截断值分别为0.925、120.2 kPa,0.903、12.4 kPa,0.923、68.8 kPa,0.837、27.0 kPa,其中SG的AUC值最高,以120.2 kPa为截断值,其诊断的敏感性、特异性、准确率分别为88.3%、96.0%、92.6%。见图1。

图1 SWE各参数鉴别诊断乳腺良恶性病灶的ROC曲线图
三、校正前、后BI-RADS分类与病理结果对照
135个乳腺病灶中,校正前BI-RADS 3类30个,4a类39个,4b类23个,4c类34个,5类9个,准确诊断115个,误判20个,其中13个良性病灶高判,7个恶性病灶低判。SG校正后BI-RADS 3、5类分别增加了33个、30个,4a、4b、4c类分别减少了27个、13个、23个,校正后BI-RADS分类中被误判病灶降为12个(占8.9%,12/135)。见表2和图2,3。

图2 乳腺良性病灶的常规超声及SWE图

表2 校正前、后乳腺良恶性病灶BI-RADS分类个
四、校正前、后BI-RADS分类鉴别乳腺良恶性病灶的诊断效能比较
SG校正后BI-RADS分类鉴别乳腺良恶性病灶的AUC及特异性均高于校正前,差异均有统计学意义(均P<0.05);敏感性和准确率与校正前比较差异均无统计学意义。校正前后BI-RADS分类建议行穿刺活检的乳腺良性病灶由61.3%(46/75)降为18.7%(14/75),两者比较差异有统计学意义(P<0.001)。见表3和图4。

图3 乳腺恶性病灶的常规超声及SWE图
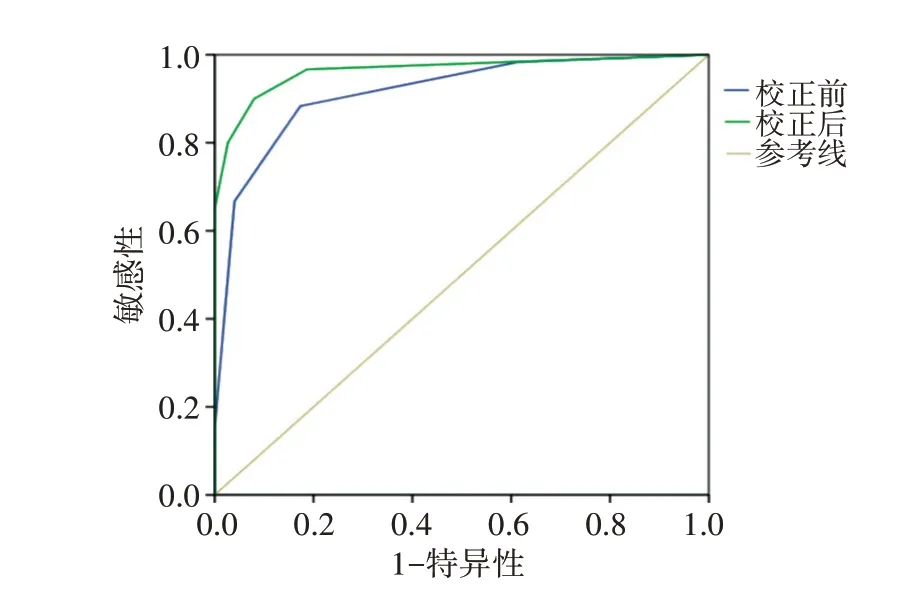
图4 校正前、后BI-RADS分类鉴别诊断乳腺良恶性病灶的ROC曲线图

表3 校正前、后BI-RADS分类鉴别乳腺良恶性病灶的诊断效能比较
讨论
近年来,高频超声已被广泛应用于乳腺癌的筛查。超声BI-RADS分类系统可规范乳腺超声诊断及报告,其评级标准已成为乳腺病灶临床风险分层管理的重要依据[6]。然而,乳腺良恶性病灶常规超声征象存在重叠,给诊断带来难度,因此纳入可靠指标提高BI-RADS分类诊断准确性是目前研究重点。肿瘤异质性作为乳腺癌的特征之一,体现在瘤灶内部不同区域肿瘤细胞亚群及结缔组织、血管等成分的区别,被认为可导致肿瘤病灶内部不同区域力学性质的差异[8-9],故仅依据硬度大小判定乳腺病灶弹性信息,得出的结论不完全客观。针对上述情况,有学者[10-11]提出定性指标(四种颜色模式和Ehomo模式)及SWE弹性图像分型法,用以评估病灶的弹性异质性,然而定性分析存在一定主观性,对医师要求较高,缺乏定量依据。为此,本研究通过SG、Esd对病灶的弹性异质性程度进行量化评估,为评价异质性病变提供了一种非侵入性的检查手段。本研究中SG的诊断效能优于内置参数Esd,以SG 120.2 kPa为截断值,显示出较高的诊断敏感性及特异性(88.3%、96.0%),优于Shang等[12]研究结果(85.56%、88.89%),分析造成差异的可能原因有:①本研究采用Q-Box Trace方式选定ROI,避免了环形ROI无法对不规则病灶“适形”取样的弊端[4];②本研究SG值计算的是整个病灶的弹性异质性,能更全面、客观地量化肿瘤弹性异质性特征,而Shang等[12]研究分析的是病灶最硬2 mm处的SG值。
本研究结果发现,常规超声BI-RADS分类鉴别乳腺良恶性病灶的敏感性相对较高(88.3%),而特异性偏低,为82.7%,与以往研究[13]一致,导致低风险病灶被高判,施行了不必要的穿刺活检。经SG校正后在保证较高诊断敏感性的同时,诊断特异性由82.7%提高到92.0%(P<0.05),且校正后BI-RADS分类预测乳腺恶性病灶的AUC值高于校正前(P<0.05),提示结合SG有助于提高BI-RADS分类总体诊断效能。以BIRADS 4b类为诊断截断值,校正前BI-RADS分类中有20个乳腺病灶被误判(恶性病灶中6个4a类,1个3类;良性病灶中10个4b类,3个4c类),经SG值校正后,纠正了13个病灶的分类,包括5个4a类和8个4b类病灶,并使3个4c类病灶降级至4b类。本研究校正前后BI-RADS 4类病灶由96个减少至33个,其中30个升级为5类,33个降级为3类,一定程度上可弥补BIRADS 4类病灶恶性概率跨度大的不足,使BI-RADS分类诊断更准确;同时,84.6%(33/39)的4a类病灶被降级为3类,其中32个经病理证实为良性,避免了该部分4a类病例过度诊疗,由定期随访替代穿刺活检。此外,校正后BI-RADS分类活检阳性率由校正前56.2%(59/105)提高到80.6%(58/72)。
本研究还发现,SG在校正BI-RADS分类中亦存在一些假阳性和假阴性结果。有2个IDC和2个DCIS的BI-RADS分类诊断为恶性,校正后误判为良性;2个DCIS的BI-RADS分类校正前后均被误判为良性。被低判的2个IDC均为Ⅰ级IDC,其中1个最大径仅0.87 cm。研究[14]表明,SWE极易漏诊DCIS、小病灶(<1 cm)和低级别浸润性癌,由此分析,假阴性原因可能与病灶体积较小及组织学分级低有关。DCIS因未突破乳腺导管基底膜,间质组织未受侵犯,尚无明显纤维组织增生反应,病灶异质性特征不显著,检测SG值偏低。本研究1个乳腺炎性病变BI-RADS分类诊断为良性,SG校正后误判为恶性;2个纤维腺瘤BI-RADS分类误诊为恶性而未被校正。分析其假阳性原因:炎性反应伴随着血供增加、水肿、脂肪坏死及肉芽肿的形成时,病灶局部区域硬度相对增加,均可能导致弹性模量分布不均匀,SG值偏高[3,15]。另外,病灶的大小也会影响弹性测值的准确性,本研究中被高判的2个纤维腺瘤体积均较大,病变包膜被拉伸及邻近正常组织受到压迫,病灶周边张力增大,与内部低弹性区形成对比;其次,较大的病变可能会导致探头不均匀地应用于肿块上方的皮肤,从而产生伪像,影响测定结果。
本研究局限性:①样本量偏少,未能对病灶的大小、深度进行分组研究;②仅分析了病灶最大径切面的弹性图像,并未分析其正交切面;③所纳入的病例多数为准备接受穿刺或治疗的阳性患者,可能存在选择偏倚。
综上所述,SWE异质性分析在鉴别诊断乳腺良恶性病变方面具有重要价值。SG校正后的BI-RADS分类提高了诊断效能,有助于减少临床上不必要的穿刺活检或手术,有一定的临床应用价值。
