基于纵向时间影像预测乳腺癌新辅助化疗疗效
2021-12-03厉力华
陈 杭,范 明,厉力华
(杭州电子科技大学生物医学工程与仪器研究所,浙江 杭州 310018)
0 引 言
在全球女性癌症患者中,乳腺癌所占的比例最高,不仅发病率和死亡率最高,对应的患者群也逐渐趋于年轻化[1-3]。随着新辅助化疗技术在临床治疗中的广泛应用,这种技术已成为乳腺癌综合治疗的重要组成部分。新辅助化疗后反应良好的患者,生存率明显提高[4]。但是,新辅助化疗技术依然存在一些问题,比如部分乳腺癌患者在进行新辅助化疗后取得的化疗效果并不理想[5],为减少这部分化疗无效患者的痛苦,对疗效进行早期预测十分重要。乳腺癌新辅助化疗疗效评价主要有临床评价和病理组织学评价。其中临床评价主要通过临床触诊和影像学测量等方式进行,受施诊医师临床经验和个人主观因素影响较大,评价结果不够客观。相比之下,病理组织学评价被称为化疗后肿瘤反应的金标准,在疗效评价上的诊断结果更为准确[6]。临床中,病理组织学评价主要使用Miller & Payne (MP)分级系统,MP分级将化疗后反应分为5级[7]。为了准确评价新辅助化疗的疗效,本文研究中使用了病理组织学评价。
磁共振成像(Magnetic Resonance Imaging, MRI)技术对乳腺癌的诊断具有较高的灵敏度和特异性,无放射性损伤,提供的信息丰富,在乳腺癌诊疗中发挥着重要作用[8-9]。MRI具有多种参数成像方式,其中动态增强磁共振成像(Dynamic Contrast Enhancement MRI, DCE-MRI)不仅可以获得病变的形态学特征信息,还可以反映病变组织的生理性变化情况[10]。在乳腺癌诊疗中,仅依赖施诊医师的临床经验对影像进行分析,不能对乳腺癌的病理信息进行精准判断[11]。随着大数据技术与医学影像辅助诊断的有机融合,诞生了新的影像组学方法,通过从影像中提取各类特征,有效解决了肿瘤异质性难以定量评估的问题。将影像组学用于辅助临床诊断和治疗决策,可以有效提高治疗的准确性[12-13]。
因新辅助化疗过程持续数月,需进行6~8个疗程,所以对疗效进行早期预测十分必要。目前已有研究使用影像组学方法证明乳腺DCE-MRI影像可用于新辅助化疗疗效的预测[14-15],但暂无研究尝试将化疗前和化疗早期(化疗进行2个疗程后)影像进行对比研究。本文对化疗前和化疗早期DCE-MRI影像分别进行疗效预测研究,并对两者的预测结果进行综合评估比较。研究中,为避免不同化疗方案对结果产生影响,选择行PCH新辅助化疗方案(紫杉醇+卡铂+赫赛汀)对乳腺癌病例进行研究。
1 研究数据与训练方法
1.1 数据来源
本研究所使用病例来自复旦肿瘤医院,共计61例,均为女性,年龄范围为27~66岁,平均年龄约为49岁。采集对象为BI-RADS 3级及3级以上行PCH新辅助化疗方案的乳腺癌病例,在进行首次MRI检查之前,均未进行任何乳腺相关的化疗和手术,且新辅助化疗治疗过程和数次磁共振检查都在复旦肿瘤医院进行。研究过程中将化疗疗效MP分级为1级、2级、3级的病例划分为化疗无反应(Non-response),MP分级为4级、5级的病例划分为化疗有反应(Response),划分后数据集中共有40例化疗无反应,21例化疗有反应。探究病例基本信息与化疗疗效的关联,对绝经情况和家族史情况使用卡方检验,得到P值分别为0.963 6和0.005 7,表明绝经情况与化疗疗效的关联并不显著,但家族史情况与疗效具有显著关联;对年龄使用方差分析方法获得P值为0.340 5,说明年龄和化疗疗效之间的关联也不显著。病例基本信息的统计和分布如表1所示。
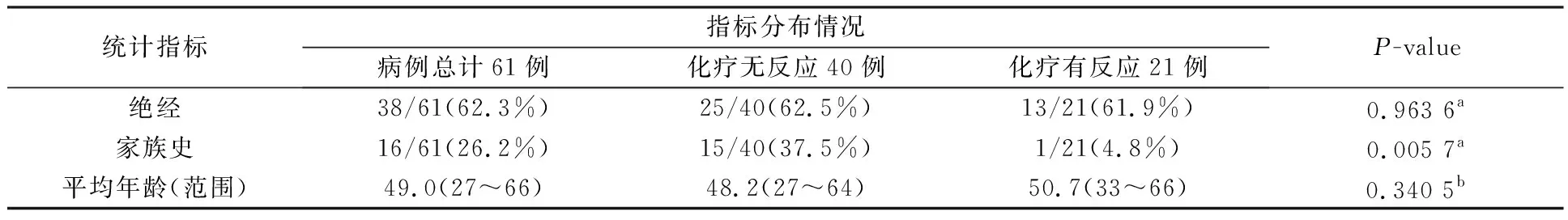
表1 病例信息统计
1.2 影像参数采集
本研究影像数据采自复旦肿瘤医院放射科,所使用的设备均为德国西门子公司3.0T超导型磁共振扫描设备。动态增强扫描的参数设置如下:重复时间(Time of Repetition, TR)为4.5 ms,回波时间(Time of Echo, TE)为1.56 ms,翻转角度(Flip Angle, FA)为10°,视野(Field of View, FOV)为360 mm×360 mm,采集矩阵(Acquisition Matrix, AM)为384×384,层厚(Slice Thickness, ST)为2.2 mm,空间分辨率为0.937 5 mm。在注射造影剂后约90 s开始拍摄增强序列,增强序列间隔约43 s,采集的增强前序列和增强后序列影像参数相同,每个序列均包含80张影像。
1.3 影像预处理与特征提取
从乳腺癌病例的多次MRI影像中取出距离新辅助化疗开始前最近的DCE-MRI影像作为化疗前影像;取出化疗2周期后的影像,作为化疗早期影像。对于2次DCE-MRI影像,先采用参数自适应的空间模糊C均值算法对病灶进行粗分割,再使用马尔科夫随机场方法对病灶进行细分割[16],分割示例见图1,分割完后得到2次影像的三维病灶区域。病灶区域特征提取过程主要基于开源的Pyradiomics[17]。对化疗前、化疗早期的2次DCE-MRI三维病灶区域进行影像学特征提取时使用了蒙片序列(增强前序列)和增强序列,每一序列都能提取得到102维特征:其中形态特征(Shape)有14维;一阶统计特征有18维;灰度共生矩阵24维;灰度游程长度矩阵16维;灰度大小区域矩阵16维;灰度依赖矩阵14维。
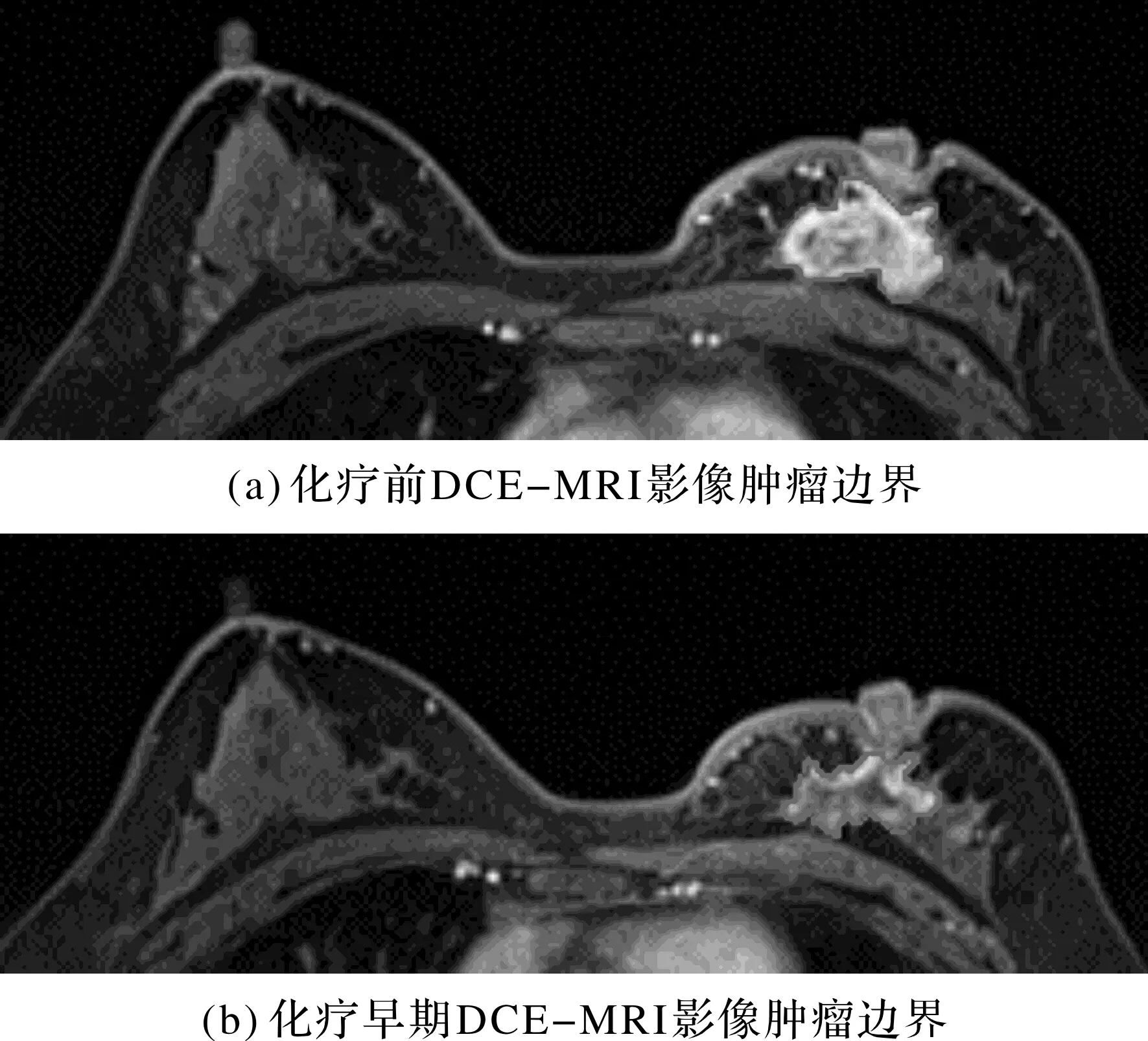
图1 同一患者在化疗前和化疗早期影像上的肿瘤边界分割示例
1.4 特征预测分析
在对化疗前、化疗早期DCE-MRI影像特征分别进行新辅助化疗疗效预测分析时,先对2次影像提取得到的每一维特征进行单变量预测分析;再充分利用特征之间的互补信息,对2次影像的形态特征、统计特征、纹理特征以及全部特征进行多变量预测分析。
1.4.1 模型训练与评估
单变量和多变量预测分析都在留一法交叉验证(Leave-One-Out Cross-Validation,LOOCV)方法下使用支持向量机(Support Vector Machines,SVM)模型进行训练,即在样本量为k的数据集中,抽取1个样本作为测试集,剩下的k-1个样本作为训练集;使用训练集构建基于SVM的预测模型,再将测试集输入训练好的预测模型中获得预测结果的概率值;进行k次循环,循环结束后即可获得k个预测结果的概率值[18]。训练过程中,SVM模型的最优参数由优化后的网格搜索法(Grid Search Method,GSM)确定,网格搜索法是基于一定的空间范围按照给定的步长搜索所有的参数组合,而优化后的网格搜索法是先使用大步长粗略搜索可能的参数组合,再使用小步长精确搜索,采用十折交叉验证方法对数据集进行测试,最终确定最优的SVM参数。
对模型预测结果进行评估时,依据病例新辅助化疗疗效的实际标签值,绘制预测结果的受试者工作特征曲线(Receiver Operating Characteristic Curve,ROC),计算ROC曲线下对应的面积值(Area Under the ROC,AUC)。然后使用统计学方法进一步评估:通过约登指数(Youden Index, YI)选择ROC曲线的最佳阈值,得到对应混淆矩阵后,计算敏感性(sensitivity)、特异性(specificity)和F1分数(F1-score);通过Bootstrap自举法,计算最优特征子集AUC值的95%置信区间。
1.4.2 单变量预测分析
对化疗前、化疗早期DCE-MRI影像提取得到的每一维特征进行单变量预测分析,通过计算预测结果的AUC值,对各个特征预测化疗疗效的性能进行比较。同时,使用统计学方法探究每一维影像特征与化疗疗效之间的关联,当t检验得到的P<0.05时,认为该特征与化疗疗效具有显著的关联;而P值越小,则认为关联越显著。
1.4.3 多变量预测分析
在多变量预测分析之前,为减少影像特征之间的冗余情况,对化疗前、化疗早期的2次影像特征集使用皮尔逊相关系数法进行特征初步筛选,即计算两两特征之间的Pearson相关系数,以相关系数为指标,剔除相关系数大于0.9的冗余特征集,具体过程如下:计算两两特征间相关系数,当有2个特征之间的相关系数大于0.9时,分别计算这2个特征与其他全部特征的相关系数并求和,然后挑选总和较大的特征进行剔除。进行特征初步筛选后,对2次影像的形态特征、统计特征、纹理特征以及全部特征分别进行多变量预测分析。
进行多变量预测分析时,先对特征进行排序,根据排序结果,构建不同的多维特征组合;然后对不同特征组合分别建立多变量预测模型;比较各个模型预测结果的AUC值从而获得最优特征子集;最后使用统计学方法对最优特征子集建立的预测模型进行综合评估。在实际训练中,采用支持向量机递归特征消除算法(SVM-Recursive Feature Elimination,SVM-RFE),按照重要性对特征进行排序;随后根据排序结果,构建不同的多特征组合;比较不同多特征组合的训练结果,得到最优特征子集,再对最优特征子集预测模型进一步评估。
2 预测结果分析与讨论
2.1 单变量预测结果分析
在对化疗前、化疗早期DCE-MRI提取得到的影像特征分别进行单变量预测分析时,化疗前影像最优的单特征分别为形态特征中的肿瘤体积(Voxel Volume)特征和纹理特征中的大小区域不均匀标准化(Size Zone Non Uniformity Normalized)特征,2个特征预测结果的AUC值分别为0.749和0.743;而化疗早期影像最优的单特征分别为纹理特征中的大面积高灰度级增强(Large Area High Gray Level Emphasis)特征和形态特征中的最小轴长(Least Axis Length)特征,预测结果的AUC值分别为0.779和0.757。
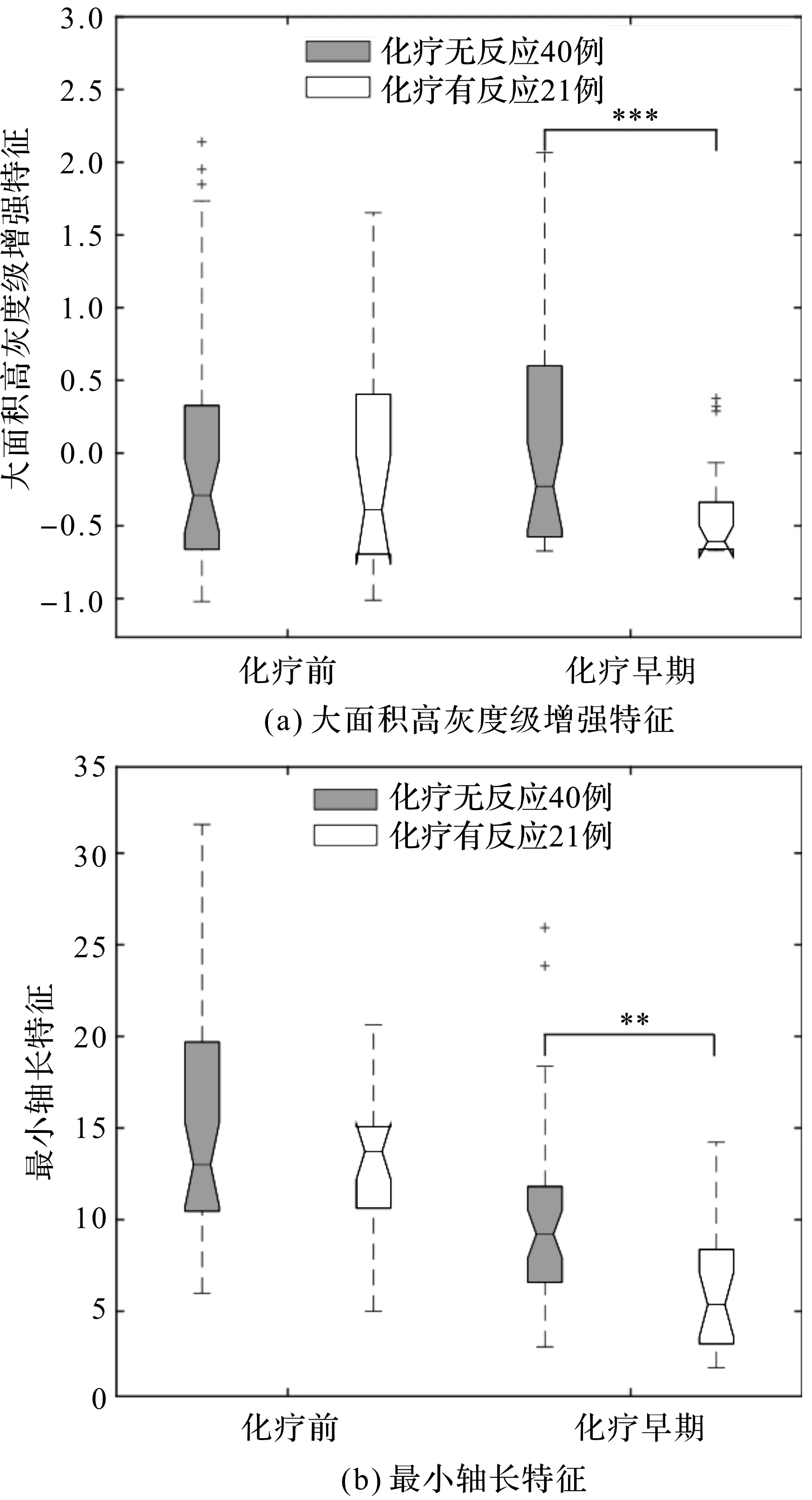
注:不标示表示P>0.05,“*”表示P<0.05,“**”表示P<0.01,“***”表示P<0.001。图2 化疗前后影像特征对比盒形图
分别绘制纹理特征中大面积高灰度级增强特征的盒形图以及形态特征中最小轴长特征的盒形图,如图2所示。
由图2(a)可知,在化疗前影像中,纹理特征大面积高灰度级增强特征的值在化疗无反应和有反应两组中的分布差异并不明显;但在化疗早期影像中,在化疗有反应的患者中的值明显小于化疗无反应患者中的值。使用t检验方法研究该特征与化疗疗效的关联,在化疗前影像中得到P=0.394,关联不显著;而在化疗早期影像中P<0.001,具有显著关联。同理,由图2(b)可知,在化疗早期影像中,形态特征最小轴长特征在化疗有反应患者中的值小于无反应患者中的值,其t检验P=0.002;但在化疗前影像中该特征分布差异并不显著(P=0.210)。
从最优单特征预测结果比较可知,化疗早期影像在单变量预测中的性能要优于化疗前影像;在使用统计学方法研究每一维特征与化疗疗效的关联时,化疗早期影像有多个特征的t检验P值小于0.05,与化疗前影像相比,与化疗疗效的关联更为显著。此外,化疗早期影像纹理特征中的大面积高灰度级增强特征不仅与化疗疗效具有显著关联,而且在单特征预测分析中也获得了最优的预测结果。
2.2 多变量预测结果分析
对化疗前影像、化疗早期影像各类特征分别进行多变量预测分析,计算各个预测模型的AUC值、95%置信区间、敏感性、特异性以及F1值,结果如表2所示。化疗前DCE-MRI影像全部特征的多变量预测结果AUC值为0.779,对应的95%置信区间为0.650~0.908,其敏感性、特异性、F1值分别为0.714,0.825,0.698。相比于化疗前影像,化疗早期影像在对全部特征进行多变量预测分析时取得了更好的预测结果,除了在特异性上与化疗前影像相同,在AUC值、敏感性以及F1值上都优于化疗前影像。化疗早期影像全部特征多变量预测结果AUC值为0.881,对应的95%置信区间为0.793~0.969,其敏感性、特异性、F1值分别为0.905,0.825,0.809。由表2可见,从全部特征中挑选出最优特征子集,其预测结果的AUC值都要优于从形态特征、统计特征和纹理特征各自挑选出的最优特征子集;推测是因为形态、统计和纹理特征与化疗疗效都存在一定关联,这3类特征存在互补信息,融合后的模型在新辅助化疗疗效预测中具有更好的准确性。

表2 化疗前后影像多变量预测结果
化疗前影像、化疗早期影像特征多变量预测结果AUC值(95%置信区间)的比较结果如图3所示。从图3可以看出,无论是化疗前影像还是化疗早期影像,统计特征的多变量预测结果AUC值都高于纹理特征和形态特征,而形态特征的AUC值最低。此外,与化疗前影像相比,在预测新辅助化疗疗效时,化疗早期影像不仅在全部特征的多变量预测结果中,而且在形态特征、统计特征和纹理特征各自的多变量预测结果中,均较有更好的预测性能。

图3 化疗前后影像各类特征预测结果 AUC(95%置信区间)
分别绘制形态特征、统计特征、纹理特征以及全部特征的ROC曲线对比如图4所示。在4张对比图中,化疗早期影像ROC曲线都较化疗前影像更偏向于坐标左上方,说明基于化疗早期影像训练得到的预测模型,在预测新辅助化疗疗效时具有更好的分类性能。
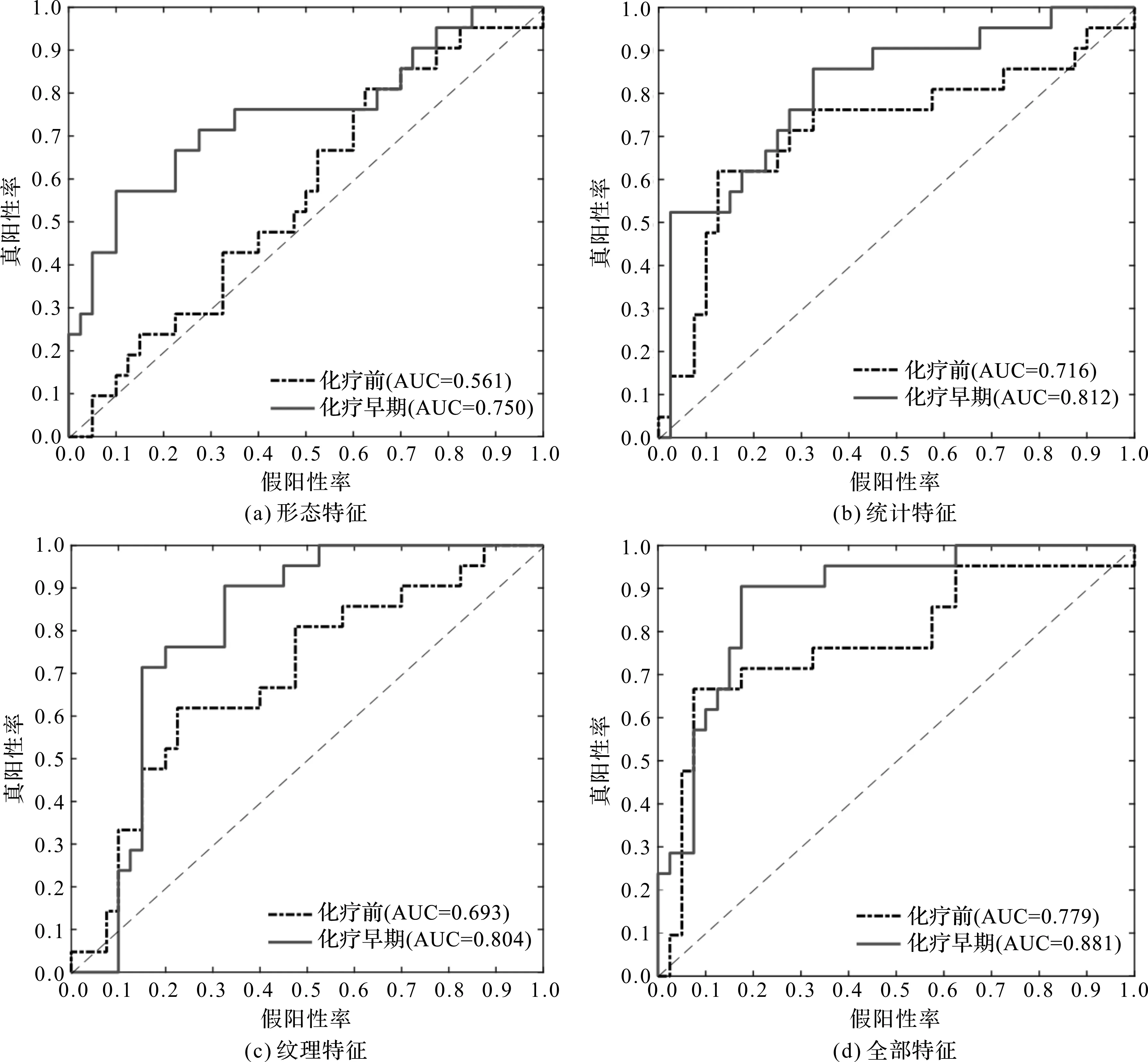
图4 化疗前后影像各类特征ROC曲线
3 结束语
关于乳腺癌新辅助化疗疗效预测的相关研究已取得一定进展,通过影像组学分析方法对化疗疗效进行预测研究表明,乳腺DCE-MRI影像与新辅助化疗疗效具有一定关联[19-22],但凭借化疗前影像对疗效进行预测,在本文数据集中无法取得理想的预测结果。本文分别对行PCH新辅助化疗方案的乳腺癌患者化疗前、化疗早期DCE-MRI影像展开疗效预测研究。研究结果表明,化疗前、化疗早期影像均与疗效存在一定关联,但化疗早期影像关联更为显著,在进行疗效预测时可获得更为准确的预测结果。但是,本文的研究存在一定的局限性,首先,乳腺DCE-MRI影像的病灶区域主要依赖放射科医生对肿瘤区域进行手动标注,使得病灶区域分割结果存在主观差异性;其次,研究过程中样本量规模较小,预测模型的鲁棒性需要有更多的数据进行验证。在后续研究中,计划将化疗前、化疗早期影像特征进行联合,利用互补信息进一步提升新辅助化疗疗效预测准确性。
