针刺对大鼠脑出血神经细胞凋亡变性的影响及机制探究*
2021-12-02万思琦殷岳杉赵永厚
李 丹,万思琦,殷岳杉,朱 曦,李 龙,赵永厚
(1.黑龙江神志医院,黑龙江 哈尔滨 150036;2.复旦大学,上海 200433;3.北京中医药大学第三附属医院,北京 100029;4.北京中医药大学东直门医院,北京 100700;5.北京中医药大学,北京 100029)
脑出血(Intracerebral hemorrhage,ICH)是指脑内非创伤性血管破裂,具有较高的死亡率和致残率[1-2],给社会和家庭都带来严重负担。因此,挖掘确切有效的治疗脑出血的方法对人类生命健康的保障具有重要意义。针灸是中医学的重要组成部分,头针治疗得到了学界的高度重视。在临床上,取穴“百会”透“曲鬓”治疗脑出血患者取得了良好的疗效[3-4]。ICH的继发性损伤通常包括炎性细胞浸润、神经细胞凋亡变性和血脑屏障破裂等,其中,神经细胞凋亡变性能够促使神经损伤进行性发展,从而被认为是主要继发性损伤的病理变化。目前研究已经表明,细胞凋亡机制参与脑出血后的组织损伤,并且与脑出血的预后密切相关[5]。阐明针刺“百会”透“曲鬓”治疗脑出血的作用机制,能够极大地拓展针灸治疗脑出血的辨证思路,提高脑出血的临床治疗有效率。本课题组预实验首次发现miR-34a-5p在ICH大鼠脑组织中的表达显著升高,推测针刺治疗脑出血机制与miR-34a-5p密切相关。本实验通过观察针刺干预大鼠脑出血后神经细胞形态结构、凋亡变性的动态变化,探讨针刺治疗大鼠脑出血后对miR-34a-5p的影响及作用机制。
1 材料与方法
1.1 实验仪器与试剂
石蜡切片机(德国Leica公司,RM2235型);电热恒温鼓风干燥箱(上海精宏公司,QH01-9030A型);超纯水系统(香港Heal Force公司,NW10LVF型);-70 ℃超低温冰箱(安徽中科美菱公司,DW HL-668型);超净工作台(苏州净化公司,VD-850型);电热恒温培养箱(天津泰斯特公司,DH36001B型);荧光显微镜(日本OLUMPUS公司,BX53);显微镜拍照系统(日本OLUMPUS公司,DP73);二甲苯(中国阿拉丁公司,1330-20-7);无水乙醇(中国国药公司,10009218);苏木精(Solarbio公司,H8070);曙红Y,醇溶(中国sangon公司,A600190);FLUORO-JADE B染色试剂盒(美国merckmillipore公司,AG310-30MG);NEUN(英国abcam公司,ab104224);Cy3标记山羊抗小鼠IgG(中国碧云天公司,A0521);In Situ Cell Death Detection Kit(瑞士罗氏公司,11684817910);山羊血清(中国Solarbio公司,SL2-10);DAPI(中国biosharp公司,C1002);抗荧光淬灭剂(中国Solarbio公司,C0296-3);Triton X-100(中国碧云天公司,ST795)。
1.2 实验动物与分组
本研究选用60只清洁级健康雄性SD大鼠,3月龄,体质量约250~300 g,分笼饲养,自由饮食。将健康雄性大鼠随机平均分为5组,即假手术组(sham)、模型组(ICH)、模型+针刺治疗组(ICH+Acupuncture)、模型+针刺治疗+阴性对照组(ICH+Acupuncture+agomir-NC)和模型+针刺治疗+miR-34a-5p激动剂干预组(ICH+Acupuncture+miR-34a-5p agomir),每组12只。每组再随机分为1 d、7 d两个亚组,每组6只。
1.3 干预方法
1.3.1 假手术组(sham) 开皮、钻孔、注射生理盐水和缝合,每天对大鼠进行1次与针刺组相同的捆绑,每次30 min。
1.3.2 模型组(ICH) 复制脑出血模型,建模12 h后每天对大鼠进行1次与针刺组相同的捆绑,每次30 min。
1.3.3 模型+针刺治疗组(ICH+Acupuncture) 脑出血造模后12 h给予针刺治疗,每24 h针刺1次。针刺部位选择参照《实验动物穴位图谱》,取大鼠百会穴(顶骨正中)、患侧曲鬓穴(眶外缘与外耳口连线的后2/3)。针刺方法:采取由百会向曲鬓穴透刺的方法,以0.35 mm×40 mm针灸针快速刺入,并向曲鬓穴透刺,进针深度27 mm,施以快速捻转手法,捻转速度为200 r/min,持续捻转5 min,后间隔5 min,反复操作,共留针30 min。针刺治疗后于脑出血造模后相应时间点分别取材。
1.3.4 模型+针刺治疗+阴性对照组(ICH+Acupuncture+agomir-NC) 将购买的miR-34a-5p agomir-NC稀释至终浓度为50 μM,取5 μL联合12.5 μL转染试剂于建模前3 d行侧脑室(前卤后0.8 mm,中缝右1.5 mm,头骨表面以下4.5 mm深)注射。复制脑出血模型,建模12 h后给予针刺治疗,每24 h针刺1次,具体操作方法同模型组保持一致。
1.3.5 模型+针刺治疗+miR-34a-5p激动剂干预组(ICH+Acupuncture+miR-34a-5p agomir) 将购买的miR-34a-5p agomir稀释至终浓度为50 μM,取5 μL联合12.5 μL转染试剂于建模前3 d行侧脑室(前卤后0.8 mm,中缝右1.5 mm,头骨表面以下4.5 mm深)注射。复制脑出血模型,建模12 h后给予针刺治疗,每24 h针刺1次,具体操作方法同模型组保持一致。
1.4 动物模型制备
选用清洁级健康雄性SD大鼠,3月龄,体质量约250~300 g,所有大鼠在22 ℃恒温环境中,12 h光/暗循环条件下饲养,自由获取食物和水。造模前禁食12 h,禁水6 h。大鼠腹腔注射60 mg/kg戊巴比妥钠麻醉,仰卧位固定于立体定位仪上,在整个手术过程中,使用与水浴循环系统相连的保温板,将直肠温度保持在37 ℃。取头皮正中,备皮消毒,切割头皮中线,暴露前卤点(Bregma)和冠状沟(coronal sulcus),取Bregma点右旁开3.5 mm、后0.2 mm定点,用牙科钻钻直径为1.0 mm的圆孔,深达硬脑膜表面。微量注射器尾静脉取血50 μL,沿钻孔进针约6 mm,将自体血液以20 μL/min速度推进尾壳核,留针5 min后缓慢出针。封闭颅骨伤口,然后缝合、包扎和消毒。假手术组在同一位置开孔,注射等体积生理盐水。
1.5 HE染色观察病理学变化
大鼠于相应时间点过量麻醉后,开颅取出脑组织,分离出血肿周围约2 mm厚的脑组织。将固定后的组织修好块后自来水流水冲洗4 h。然后从低浓度酒精逐渐递升到高浓度酒精,将组织块放入二甲苯中,直至标本透明为止,时间30 min,将组织块移置二甲苯+石蜡内,使石蜡完全透入组织,将溶解的石蜡倒入金属框内,然后将浸蜡组织埋于金属框中央,待冷却后即成坚硬的蜡块。将标本蜡块装在切片机上,切成5 μm的薄片,然后把切片放在温水皿中展开,将展开的组织切片移到载玻片上,放在60 ℃温箱中2 h,烘干。按照 HE染色液说明书进行 HE染色,脱水、透明和封片后,于显微镜下观察染色效果,并于200×镜下拍照(标尺长度100 μm)。
1.6 TUNEL和NeuN荧光双染观察神经细胞凋亡
上述各组大鼠血肿周围约2 mm厚的脑组织经包埋切片和脱蜡至水后,滴加0.1% Triton X-100(0.1%柠檬酸钠盐配置)50 μL透化,加入柠檬酸-柠檬酸钠修复液,高温低火修复10 min,配制并滴加TUNEL反应液。滴加山羊血清至完全覆盖组织,湿盒内室温30 min。一抗用PBS按1∶400稀释,滴加至完全覆盖组织,湿盒内4 ℃过夜。荧光二抗,用PBS按1∶200稀释,滴加至完全覆盖组织,室温孵育60 min。滴加DAPI至完全覆盖组织以复染核后抗荧光淬灭剂封片。于显微镜下观察染色效果并于400×镜下拍照(标尺长度50 μm)。
1.7 Fluoro-Jade B染色分析神经元变性坏死
上述各组大鼠血肿周围约2 mm厚的脑组织经包埋切片和脱蜡至水后,浸入含1% NaOH的80%乙醇溶液中5 min,取出切片,将切片移入70%乙醇中2 min,取出切片后,浸泡在蒸馏水2 min×2次。移入0.06%的高锰酸钾溶液中10 min,放在摇床上摇动,以确保所有玻片的染色背景一致。蒸馏水洗2 min后取出切片,去除多余水分,加染色液后室温放置20 min。蒸馏水洗1 min×3次。去掉组织表面多余水分,将切片放于约50 ℃恒温箱中干燥5 min。放入二甲苯中3 min,中性树胶封片,荧光下镜检并于400×镜下拍照(标尺长度50 μm)。
1.8 统计学处理
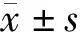
2 结果
2.1 各组实验大鼠脑出血组织HE染色结果
Sham组大鼠大脑脑组织细胞形态结构完整,排列整齐,未发生水肿也无炎性细胞浸润。ICH组大鼠脑组织细胞出现明显肿胀,同时细胞间隙变大,部分神经细胞出现坏死、消失,可见明显水肿及大量炎细胞浸润。ICH+Acupuncture组大鼠和ICH+Acupuncture+agomir-NC组大鼠与ICH组大鼠相比较,脑组织水肿范围小、程度轻,炎症细胞的浸润轻,细胞周围间隙小。ICH+Acupuncture+miR-34a-5p agomir组大鼠脑组织水肿范围、程度较ICH组轻,但较ICH+Acupuncture组大鼠和ICH+Acupuncture+agomir-NC组重,炎症细胞的浸润较ICH组轻,较ICH+Acupuncture组大鼠和ICH+Acupuncture+agomir-NC组重。第7天与第1天比脑组织水肿范围变小、程度减轻,炎症细胞的浸润减轻,细胞周围间隙变小。见图1~2。

注:A为Sham组,B为ICH组,C为ICH+Acupuncture组,D为ICH+Acupuncture+agomir-NC组,E为ICH+Acupuncture+miR-34a-5p agomir组。
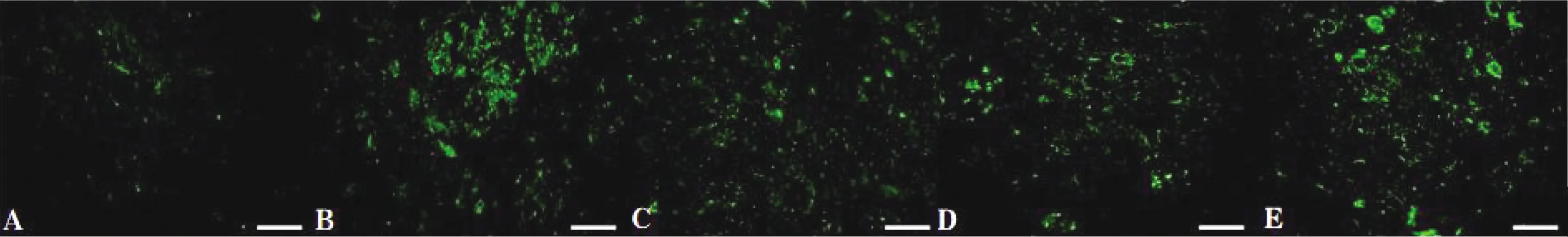
2.2 各组实验大鼠脑出血组织TUNEL和NeuN荧光双染结果
与Sham组比较,其余各组1 d后脑出血组织神经细胞凋亡的数目明显增多(P<0.05),说明造模成功。与ICH组比较,ICH+Acupuncture组、ICH+Acupuncture+agomir-NC组和ICH+Acupuncture+miR-34a-5p agomir组神经细胞凋亡的数目少且差异具有统计学意义(P<0.05),说明针刺可以缓解脑出血大鼠脑组织病变。与 ICH+Acupuncture组相比,ICH+Acupuncture+agomir-NC细胞凋亡数差异无统计学意义(P>0.05)。与ICH+Acupuncture组相比ICH+Acupuncture+miR-34a-5p agomir组组织神经细胞凋亡的数目显著增多(P<0.05)。见图3~4、表1。

注:A为Sham组,B为ICH组,C为ICH+Acupuncture组,D为ICH+Acupuncture+agomir-NC组,E为ICH+Acupuncture+miR-34a-5p agomir组。

注:A为Sham组,B为ICH组,C为ICH+Acupuncture组,D为ICH+Acupuncture+agomir-NC组,E为ICH+Acupuncture+miR-34a-5p agomir组。

注:A为Sham组,B为ICH组,C为ICH+Acupuncture组,D为ICH+Acupuncture+agomir-NC组,E为ICH+Acupuncture+miR-34a-5p agomir组。
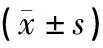
表1 各组大鼠神经细胞凋亡TUNEL-IF荧光双染检测结果
2.3 各组实验大鼠脑出血组织Fluoro-Jade B染色结果
Fluoro-Jade B染色用于评估脑出血后大鼠脑组织神经细胞凋亡情况,大量散在被染成黄绿色荧光的FJB阳性细胞。阳性染色的细胞呈亮黄绿色, 存在淡淡的暗绿色背底。神经细胞的胞体阳性染色强, 而细胞突起染色较浅。在单位面积内对FJB染色阳性神经元计数。
与Sham组比较,其余各组1 d后脑出血组织神经细胞凋亡的数目明显增多(P<0.05),说明造模成功。与ICH组比较,ICH+Acupuncture组、ICH+Acupuncture+agomir-NC组和ICH+Acupuncture+miR-34a-5p agomir组神经细胞凋亡的数目少且差异具有统计学意义(P<0.05),说明针刺可以缓解脑出血大鼠脑组织病变。与 ICH+Acupuncture组相比,ICH+Acupuncture+agomir-NC细胞凋亡数差异无统计学意义(P>0.05)。与ICH+Acupuncture组相比ICH+Acupuncture+miR-34a-5p agomir组织神经细胞凋亡的数目显著增多(P<0.05)。见表2、图5~6。
注:A为Sham组,B为ICH组,C为ICH+Acupuncture组,D为ICH+Acupuncture+agomir-NC组,E为ICH+Acupuncture+miR-34a-5p agomir组。

注:A为Sham组,B为ICH组,C为ICH+Acupuncture组,D为ICH+Acupuncture+agomir-NC组,E为ICH+Acupuncture+miR-34a-5p agomir组。
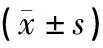
表2 各组大鼠神经细胞变性坏死FJB染色检测结果
3 讨论
脑出血是影响经济社会发展的重大公共卫生问题和社会问题,特别是脑出血继发性损害严重影响患者预后。研究表明细胞凋亡是脑出血后脑损伤的关键因素,神经元凋亡参与脑出血损伤病理过程,脑出血后发生的炎症反应也在脑出血后神经细胞损伤中起到重要作用[6],抑制神经元的凋亡变性,增加神经元活性,能够促进机体功能恢复,有利于降低脑出血的致残率和病死率[7]。
针灸作为中医学的重要组成部分,疗效确切,治疗ICH可以改善神经功能障碍、降低患者致残率,且具有无药物毒副作用的独特优势。本研究采用针刺“百会”透“曲鬓”穴位是以“腧穴-中枢(脑和脊髓)-脏腑”相关联的经络内联脑为理论指导,能够起到一经带多经、一穴带多穴的作用[8]。该疗法涉及足少阳胆经、足太阳膀胱经和督脉3条阳经,从头至足,贯穿全身,可醒脑开窍,统调阳气,有利于改善神经功能[9]。针刺“百会”透“曲鬓”穴位疗法临床疗效广泛,除了治疗ICH外,在治疗急慢性脑梗死患者的辅助治疗中也取得了不错的疗效[10-11],值得在临床广泛推广。针刺治疗脑出血的病理进程中,其作用主要体现在控制脑血管炎性反应[12]。在HE染色观察脑组织病理学变化实验中显示针刺干预大鼠脑出血可减少脑组织水肿范围、减轻脑组织水肿程度、减小细胞周围间隙和减轻炎症细胞的浸润,这与刘昊等[13-14]的研究结果相一致。
ICH 后,由于血肿周围脑组织的水肿造成神经细胞的坏死和凋亡,并引起一系列临床症状。细胞凋亡是内部或外部信号诱导的程序性细胞死亡。随着对miRNAs研究的日益深入,越来越多的microRNA的生物学功能被发现,证明其对细胞凋亡调控基因有靶向作用[15-16]。对于miRNAs的更深层次的认识及其调控靶点的研究,将有助于对ICH的治疗提供新方法和新靶点[17]。miR-34a-5p可以通过调控多种靶基因,在多种细胞中发挥不同的作用。miR-34a-5p的相关研究在多种疾病中均有报道,主要集中在肿瘤耐药和癌症方面。文献报道miR-34a-5p参与调控骨肉瘤恶性进展[18]。董洁等[19]研究发现,长链非编码RNA XIST能够发挥miRNAs分子海绵的功能,靶向结合miR-34a-5p,促进鼻咽癌的增殖。刘敏娟等[20]发现miR-34a-5p靶向AKT1基因促进ESCs的增殖、迁移及侵袭能力,降低其凋亡及自噬能力,可能在子宫内膜异位症的发病过程中发挥作用。Ying Gao等[21]报道miR-34a-5p可以抑制细胞发育,并通过靶向HPV感染的角质形成细胞中的JAG1表达来调节Notch1途径的活性。但miR-34a-5p在脑出血方面的研究较少。本研究旨在探讨针刺治疗大鼠脑出血后对miR-34a-5p的影响及作用机制,以期为脑出血的治疗提供理论依据参考。
在TUNEL-NeuN荧光双染实验和Fluoro-Jade B染色实验中与ICH组相比,ICH+Acupuncture组、ICH+Acupuncture+agomir-NC组和ICH+Acupuncture+miR-34a-5p agomir组神经细胞凋亡和变性坏死的数目明显减少(P<0.05),说明针刺可以缓解脑出血大鼠脑组织病变。在给予针刺治疗7 d后,TUNEL-NeuN荧光双染实验和Fluoro-Jade B染色实验中阳性细胞数显著减少(P<0.05),提示针刺可以有效改善因急性脑出血导致的神经功能损伤。在1 d和7 d的结果中,与ICH+Acupuncture组相比,ICH+Acupuncture+agomir-NC细胞凋亡数差异无统计学意义(P>0.05),与ICH+Acupuncture组相比ICH+Acupuncture+miR-34a-5p agomir组组织神经细胞凋亡变性的数目显著增多(P<0.05),提示上调miR-34a-5p会加重神经元细胞凋亡,抑制脑出血的治疗作用。
综上,笔者初步明确了miR-34a-5p参与针刺治疗脑出血的过程,推测针刺“百会”透“曲鬓”对脑出血的治疗可能通过下调miR-34a-5p,减轻神经炎症,最终抑制脑出血大鼠神经元凋亡和神经退行性病变,体现神经保护作用。通过targetscan、microrna生物信息学网站分析发现,KLF4 3′-UTR区可以同miR-34a-5p结合,而KLF4沉默会上调E-selectin、MCP-1及IL-6的表达,增强氧糖剥夺诱导的脑微血管内皮细胞(b.End3)凋亡[22]。未来笔者将进一步探索miR-34a-5p对KLF4的靶向调节关系,揭示miR-34a-5p介导小胶质细胞极化在头穴针刺治疗ICH损伤中的作用机制,为临床防治工作提供实验依据,进一步推动针灸的临床应用。
