纳木错夏季酵母菌多样性及其影响因素
2021-12-01王艳红郭小芳
王艳红,郝 兆,郭小芳,德 吉
纳木错夏季酵母菌多样性及其影响因素
王艳红,郝 兆,郭小芳*,德 吉**
(西藏大学理学院,拉萨 850000)
以纳木错湖水为研究对象,采用膜过滤平置培养法分离纯化酵母菌,并结合ITS区域序列分析与经典分类法对酵母菌菌株进行鉴定,运用生物信息学和统计学方法分析水体可培养酵母菌的多样性及其与理化因子之间的相关关系.结果显示,从纳木错水体中分离出1067株酵母菌,分属于27个属45个种及2个潜在新分类单元,优势种为和.NMDS分析显示,纳木错不同区域水体可培养酵母菌群落β多样性差异明显.Pearson相关性分析结果表明,酵母菌总丰度与pH值、电导率、总溶解固体量、盐度呈极显著负相关(<0.01),与总氮、氨氮呈显著正相关(<0.05);物种数、Shannon-Wiener多样性指数、Simpson多样性指数均与总磷呈显著负相关(<0.05).冗余分析显示,pH值是影响纳木错水体酵母菌种群分布的主要理化因子.综上,纳木错水体酵母菌资源比较丰富且存在明显的空间异质性,水体理化因子对纳木错水体可培养酵母菌的分布有较大的影响.
高原湖泊;纳木错;酵母菌;多样性;理化因子
湖泊作为地球表层系统各圈层的联结点,对维持生态平衡及社会经济发展具有重要价值[1-3].微生物作为湖泊生态系统中的重要成员,广泛参与其能量流动及化学元素循环,且极易受物理及化学因素的影响,尤其是表层水体微生物,其群落结构及多样性能够对环境变化做出快速的响应[4-7].酵母菌作为微生物的重要组成部分,其群落结构组成被认为是衡量湖泊生态系统稳定性的重要指标[8-10].酵母菌的群落结构与其生境和生境污染状况相关,其群落结构的变化是对生境条件变化的响应[11-12].酵母菌对有机污染反应迅速,可以作为评价水生环境富营养化水平的指标[11,13],部分酵母菌的存在与否及其丰度水平还可用于指示粪便污染而参与水质评价[11,13-15].近年来,国内外学者逐步开展了许多关于湖泊水体酵母菌种群结构及其影响因素的研究,如:李治莹等[16]从云南程海湖冬季湖水样品中分离获得171株酵母菌,鉴定为14个属22个种及2个潜在新分类单元;郭小芳等[17]研究发现抚仙湖酵母菌种群结构与总有机碳浓度显著相关;Medeiros等[9]以巴西4个湖泊为研究对象分离纯化酵母菌,并分析了酵母菌多样性与水体理化因子的相关性;Russo等[18]、Brandão等[19]及Libkind等[20]分别对阿根廷不同湖泊可培养酵母菌多样性进行了研究,但因其研究湖泊不同得到的结果不尽相同.
青藏高原气候条件独特,地理环境复杂,湖泊面积超过50900km2,大于全国湖泊总面积的一半,且以盐碱湖为主,素有“亚洲水塔”之称[21-23].纳木错位于青藏高原中南部,是我国第二大咸水湖,也是世界上海拔最高的咸水湖[24],因为其特殊的地理位置,受人类活动影响较少,基本保持生态原貌,是科学研究的天然实验场所[21,25],近年来,伴随着全球气温上升,纳木错东南侧念青唐古拉山冰川大面积消融,纳木错湖面扩张,水体理化性质发生着缓慢改变[26].目前关于纳木错生物多样性的研究主要侧重于古生物学及水体细菌等方面[24,27-28],缺少对水体酵母菌较全面的详细研究,本文以纳木错水体酵母菌为研究对象,探究环纳木错不同生境水体中酵母菌多样性及其影响因素,期望能够为纳木错湖泊生态环境保护以及青藏高原微生物多样性研究提供理论依据,并为极端环境下的酵母菌资源的开发和利用奠定基础.
1 材料与分析
1.1 研究地概况及水样采集

图1 纳木错水样采集样点分布
纳木错(30°30′N~30°55′N,90°15′E~91°04′E)位于念青唐古拉山北部、藏北高原东南部、西藏自治区拉萨市当雄县和那曲地区班戈县境内[1,25].湖面平均海拔4720m,湖面面积2021km2,湖泊最深处大于90m,是世界上海拔最高的大型湖泊[1].纳木错处于高原亚寒带季风半干旱和半湿润气候区过渡带,湖水补给主要为地表径流、冰川融水和降水,年平均降水量387.36mm,主要集中在6~10月份,河流入水口主要分布于纳木错南侧和西侧,南侧入湖河流主要为念青唐古拉山冰川融水,流程短且密集,西侧以昂曲和侧曲两河为主[25-26,29-31].
2020年8月根据湖水分布情况及地理条件,采用系统抽样法,在纳木错选取20个样点采集水样(图1).使用无菌水样采集器在距岸边15m处采集深度为50cm的水样.每个样点共采集3份水样,共7.5L,避光保存.1份立即送往西藏博源环境检测有限公司进行水体理化因子的测定,其余带回实验室立即进行酵母菌的分离.
1.2 酵母菌菌株的分离及纯化
采用砂芯过滤器分50mL和100mL两个梯度对湖水进行抽滤.滤膜为孔径0.45μm,直径50mm的醋酸纤维滤膜.为尽可能多的分离出水体中的酵母菌,本实验采用3种培养基对纳木错水体酵母菌进行分离,将抽滤后的滤膜分别正置于酸性PDA、酸性YM以及RBCH固体培养基平板上进行培养,培养基组成成分等参照文献[32],每个处理设置3个重复.培养3~5d后进行酵母菌菌落形态观察和菌落计数,计数后挑取单菌落接种于YM斜面进行恒温培养(28℃).采用平板划线法两轮纯化后于20%甘油管中冷冻保藏(-20℃).
1.3 酵母菌菌株的分子鉴定
采用ITS区域序列法进行酵母菌菌株的分析鉴定.
1.3.1 DNA提取及扩增 DNA的提取采用CTAB法[33],引物采用ITS1(5¢-TCCGTAGGTGAACCTGC GG-3¢),ITS4(5¢-TCCTCCGCTTATTGATATGC-3¢)[34]. PCR反应条件为: 95℃ 5min;95℃ 30s,55℃ 30s, 72℃ 60s,35个循环;72℃ 7min.1%琼脂糖凝胶检测扩增目标产物后送往生工生物工程(上海)股份有限公司测序.
1.3.2 序列分析 供试菌株ITS区测序结果经人工校对,去除引物及双峰序列后在GenBank核酸序列数据库中进行同源序列搜索,与已知酵母菌序列相似度为99%以上的,确定为同一种[35].供试菌株的序列号上传至NCBI的GenBank核酸序列库,登录号为:MW784731~MW784822.系统发育树的构建使用MEGE 7软件进行,挑选与潜在新种序列最相似的8~9条ITS序列构建,方法为邻接法(neighbor- joining, NJ),进行1000次Bootstrap检验[8].
1.4 纳木错水体理化因子测定
pH值、电导率(EC)、总溶解固体量(TDS)及盐度(Salt)采用多功能参数仪(Multi-Parameter PCSTestrTM35)原位测定,每个参数重复测定3次.总氮(TN)、总磷(TP)、氨氮(NH3-N)以及化学需氧量(COD)送往西藏博源环境检测有限公司进行测定,其中氨氮(NH3-N)、总磷(TP)采用722S可见分光光度计测定,方法分别为纳氏试剂分光光度法(HJ 535-2009)和钼酸铵分光光度法(GB 11893- 89),总氮(TN)采用752紫外可见分光光度计测定,方法为碱性过硫酸钾消解紫外分光光度法(HJ 636-2012),化学需氧量(COD)采用重铬酸盐法进行测定.
1.5 数据处理与分析
采用Excel 2019、R 4.0.1、SPSS 20.0及CANOCO 5等软件进行数据的处理与分析,绘图使用R 4.0.1ggplot 2包、pheatmap包以及Origin 2019进行.酵母菌总丰度(CFU/L)=(每皿酵母菌菌落数平均值/每皿抽滤水体毫升数)×1L.相对丰度=某种酵母菌分离菌株数/分离得到的酵母菌总株数×100%.有色酵母丰度=分离得到的有色酵母菌株数/分离得到的酵母菌总株数×100%.非度量多维标度(Non-metric Multidimensional Scaling,NMDS)分析及相似性分析(ANOSIM)使用R 4.0.1vegan包进行计算[36-37].Shannon-Wiener多样性指数、Simpson多样性指数、Pielou均匀度指数采用R 4.0.1中的vegan包进行计算[36],差异性分析使用SPSS 20.0软件中的Duncan检验法进行.运用SPSS 20.0Kolmogorov- Smirnov检验对理化因子及多样性指数进行正态检验,结果显示值均大于0.05,各参数符合正态分布,故采用Pearson相关系数进行多样性指数与理化因子的相关性分析. Pearson相关系数采用R 4.0.1中的psych包进行计算[37].冗余分析(RDA)使用CANOCO 5进行.
2 结果与讨论
2.1 纳木错夏季各样点水体可培养酵母菌群落组成特征
2.1.1 纳木错夏季各样点水体可培养酵母菌分布状况 如图2所示,从纳木错20份水样中共分离得到1067株酵母菌,采用ITS区域序列分析,以序列相似度99%为分类界限,结合显微形态进行鉴定,结果显示,分离得到的酵母分属于27属45种,其中sp.和sp.与已知序列的相似度低于97%,可能为2种潜在新分类单元,具体分类学地位见图3.及属种数最多,均分离到5个种,其次为属,分离到4个种,属分离到3个种,其余属分离到的种数则相对较少.
由酵母菌分布状况可知(图2),.在纳木错水体中广泛分布,在18个样点中被分离..和.分布也较为广泛,分别在17个和16个样点中被分离到.相较而言,.、.等17个种分布范围较窄,均仅在1个样点中被分离.相对丰度结果显示,相对丰度最高(23.24%),其次为(14.43%),而、等13个种相对丰度较低,均仅在1个样点中被分离到1株.综上所述,及为纳木错水体可培养酵母菌优势种.
为进一步探究纳木错酵母菌多样性,对水体中分离得到的有色酵母菌丰度及比例进行分析,结果表明,纳木错有色酵母菌资源丰富,从20个样点中共分离出有色酵母菌772株(72.35%),其中丰度最高(248株),占总有色酵母菌数量的32.12%.
纳木错水体酵母菌资源较为丰富,有色酵母菌数量和分布均占有明显的优势,该结果不同于云南抚仙湖、程海湖、星云湖、杞麓湖及阳宗海湖等高原湖泊可培养酵母菌优势种的研究结果,但与西藏羊卓雍错水体可培养酵母菌优势种相同(表1);青藏高原强紫外辐射环境对水生微生物具有抑制作用[40],张瑞蕊等[41]研究结果显示,为天山一号冰川表面冰尘和底部沉积层可培养酵母菌的优势种,且认为低温微生物色素沉着可以减少高强度紫外线辐射带来的伤害, Virginia等[42]研究表明,为阿根廷冰川可培养酵母菌优势种,有着极强的耐低温生存能力和定植能力.分布和数量也较多,该种酵母曾在南极土壤[43]、高原冻土[44]、冰川融水[45]等生境中被分离,Brandão等[46]对阿根廷Nahuel Huapi湖酵母菌多样性的研究发现,在5°C和20°C时表现出多种胞外酶活性,对寒冷生境具有较强的适应能力.由此推测,强辐射和较低的年均温是和在纳木错水体中广泛存在的可能原因..在纳木错水体中分布也非常广泛,但目前关于该菌种的研究还较为缺乏,对该菌在纳木错广泛分布的原因有待进一步的研究.

图2 纳木错各样点水体在种水平上可培养酵母菌的分布
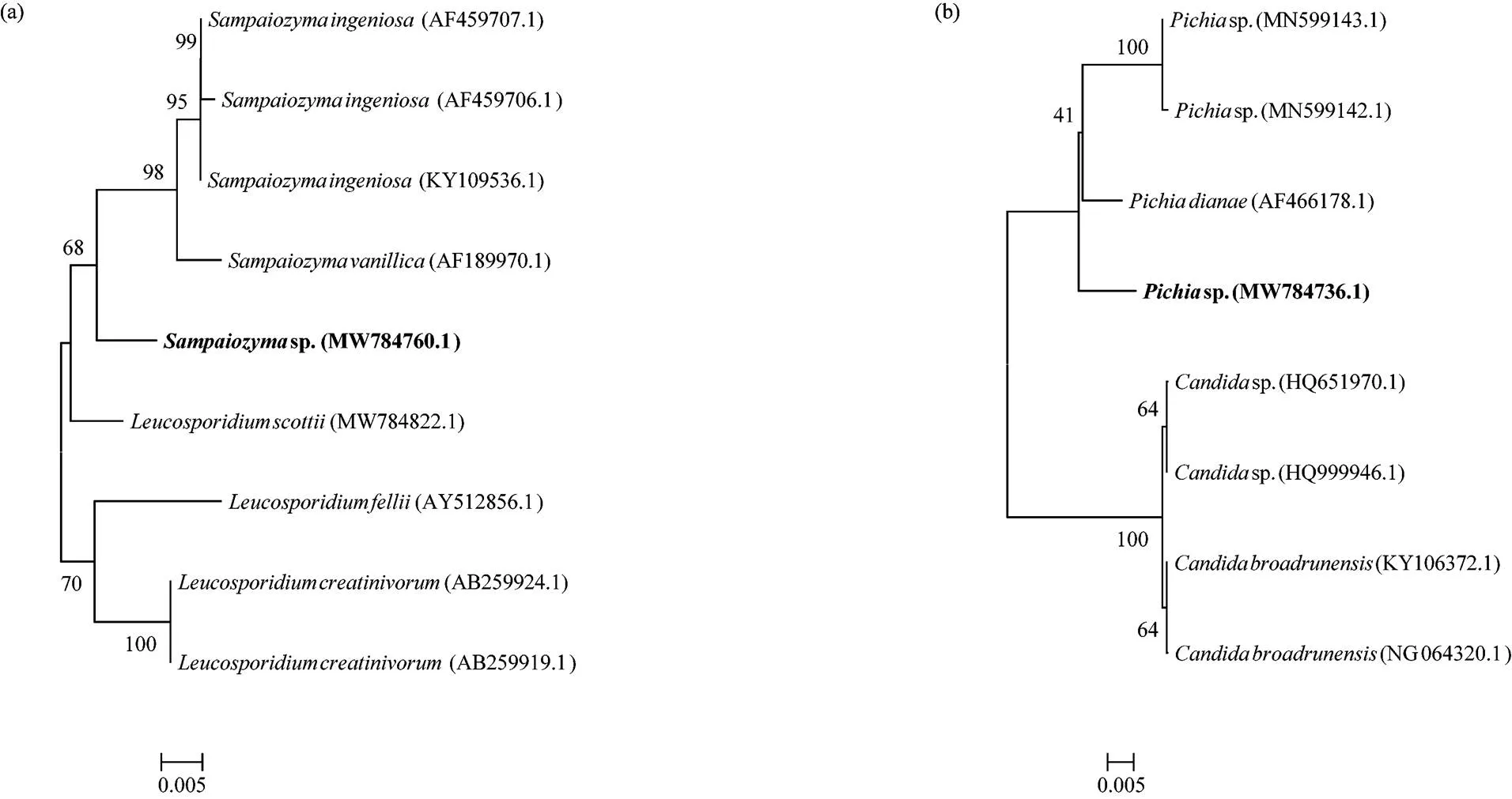
图3 基于ITS序列构建的Neighbor-Joining系列发育树
(a)sp. 系列发育树; (b)sp. 系列发育树; 黑色字体标注为本研究新获得序列,括号内为GenBank登录号,分支点数字代表1000次重复后自展值,标尺表示1000个序列中有5个被替换
通过比较纳木错与其他高原湖泊水体可培养酵母菌多样性(表1)可以看出,从纳木错分离出的酵母菌属数高于羊卓雍错、抚仙湖、程海湖等6个高原湖泊,酵母菌种数仅次于抚仙湖和阳宗海湖. Shannon- Wiener多样性指数显示,纳木错水体酵母菌多样性仅次于抚仙湖和星云湖;Simpson多样性指数显示,纳木错水体酵母菌多样性高于抚仙湖、羊卓雍错、程海湖以及星云湖;Pielou均匀度显示,纳木错水体酵母菌种群分布均匀度小于程海及羊卓雍错,但高于抚仙湖.综合各多样性指数可知,纳木错水体酵母菌多样性较高但均匀度较低,这可能是由于纳木错海拔更高,环境更为恶劣,恶劣且多变的环境使得更多种类的酵母菌能够共同生存,但适应性较强的物种占据着大部分生态位.纳木错水体酵母菌总丰度为622CFU/L,仅低于星云湖,这可能与取样季节和样点离岸距离以及湖泊所处地理位置等有关.纳木错与其他6个高原湖泊种群间的相似性系数为0.10~0.29,均处于不相似水平,其中纳木错与羊卓雍错均位于西藏自治区境内,具有相似的环境条件,且使用相同的分离方式,但纳木错与羊卓雍错水体酵母菌种群组成也未达到相似水平(0.29).综上所述,纳木错与其他6个湖泊虽都属于高原湖泊,但所分离到的酵母菌物种组成却存在较大差异,这与湖泊所处的地理位置、气候条件、环境特点以及水体理化的不同存在一定的关系.

表1 纳木错与其他高原湖泊酵母菌比较
2.1.2 纳木错夏季各样点间水体可培养酵母菌种类组成特征 多集合韦恩图显示(图4),各样点间共有酵母菌物种较少,为除10号和19号样点外其他样点的共有种,.和.分别为除1号、9号以及16号样点外的其他样点以及除1号、11号、15号以及20号样点外的其他样点的共有种.各样点中,1号和15号样点酵母菌物种数最少,9号样点酵母菌物种数最多,且有6种酵母菌为该样点特有种,5号、10号及16号样点各有2个特有种,4号、6号、8号、11号以及19号样点各有1个特有种. 9号样点位于湖边牧场,湖岸家畜活动频繁,且岸边有大量家畜排泄物,放牧活动造成的岸边有机质的富集是9号样点水体酵母菌物种数及特有种均较多的可能原因.
2.1.3 纳木错夏季各样点水体可培养酵母菌空间异质性 如图5a所示,采用基于Bray-Curtis距离的非度量多维尺度(NMDS,non-metric multidimensional scaling)分析显示,所有样点按不同地理位置分为4组,东南沿岸区(CSE,1~5号样点),西南沿岸区(CSW,6~10号样点),西北沿岸区(CNW,11~15号样点),东北沿岸区(CNE,16~20号样点).ANOSIM结果显示(图5b)组间差异显著大于组内差异(= 0.266,<0.01),即纳木错水体酵母菌群落结构在不同区域存在显著差异.就各区域而言,西南沿岸区10号样点与该区域其他样点水体酵母菌群落结构存在一定差异,西北沿岸区12号样点与该区域其他样点水体酵母菌群落结构存在一定差异,东北沿岸区20号样点与该区域其他样点水体酵母菌群落结构存在一定差异.分析以上三个样点所处位置可知,不同于6~9号样点,10号样点位于纳木错西岸,位置的不同导致10号样点附近入湖河流完全区别于6~9号样点,不同入湖河流流经区域的差别可能是10号样点β多样性区别于6~9号样点的原因.12号样点位于纳木错湖体的一个突出部,该处湖水与主湖以狭窄水道相连,特殊的位置使得12号样点水体与主湖水体交流较为困难,从而造成了该样点水体酵母菌β多样性与相邻样点的差异.20号样点位于纳木错东北角,样点附近设置有纳木错观景台,常年的西南风将湖面草木漂浮物富集于该样点[47],丰富的有机质含量及常年的旅游活动可能是造成20号样点β多样性区别于16~19号样点的可能原因.
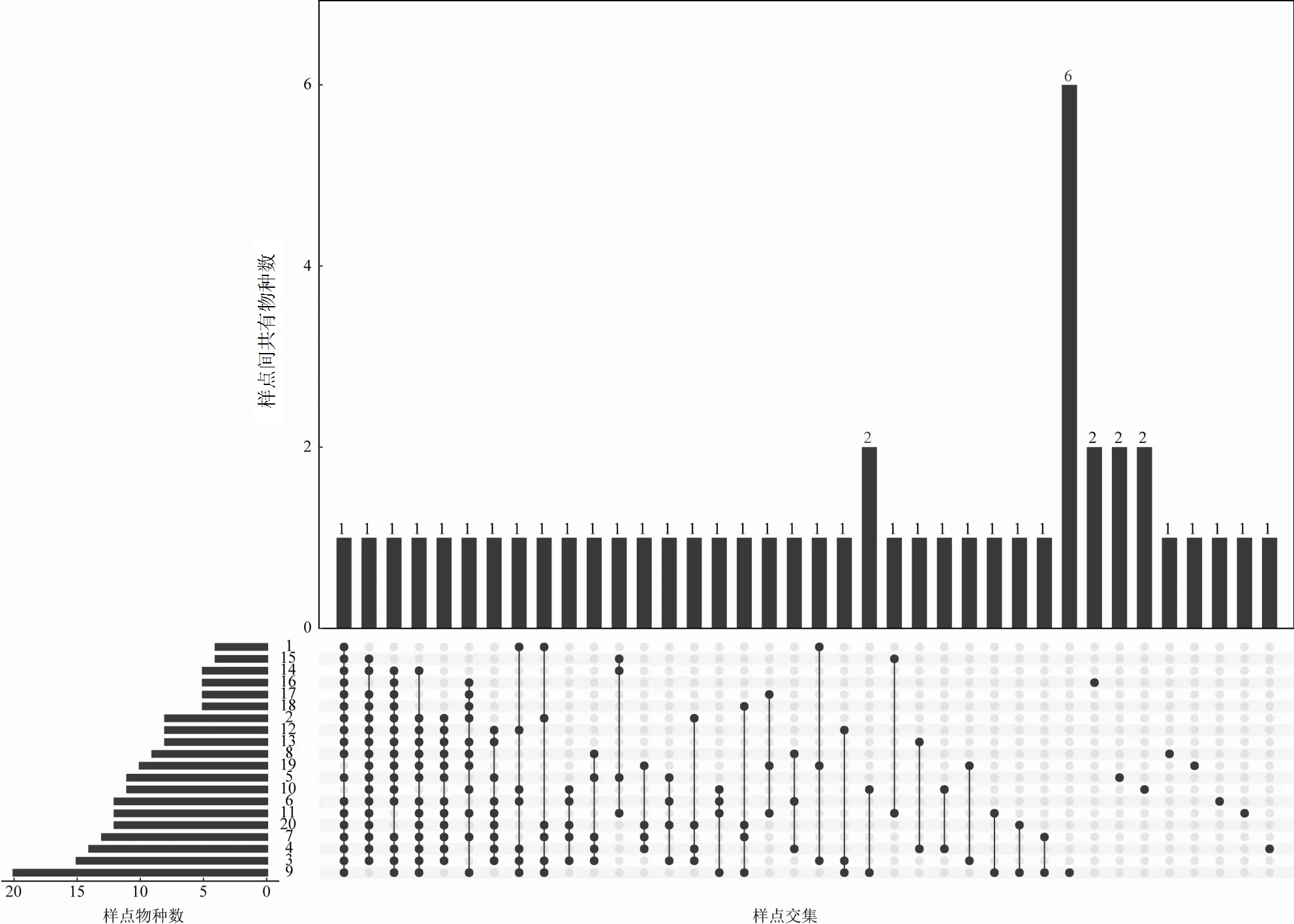
图4 纳木错样点间水体可培养酵母菌种类多集合维恩图
黑色点表示该位置有数据,点线图表示样点间存在交集,柱状图上的数字表示样点间的共有物种数,左边柱形图表示各样点的物种数

图5 纳木错水体可培养酵母菌群落组成的空间变异分析
2.1.4 纳木错夏季各样点水体可培养酵母菌多样性指数 纳木错各样点水体可培养酵母菌多样性指数显示,9号样点分离到的酵母菌属数及种数均最多,为17个属20个种,1号和15号样点分离到的酵母菌属数及种数最少,均为3个属4个种.
为进一步对纳木错可培养酵母菌多样性进行深入探究,利用SPSS 20.0软件中的Ducan检验法对不同样点酵母菌总丰度进行差异性分析,结果显示,6号样点酵母菌总丰度最高,且显著高于除1号样点外的其余样点(<0.05),15号样点酵母菌总丰度最低.Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数在20个样点间具有相同的变化趋势,19号样点三者均最低,分别为0.98、0.42及0.20;就Shannon-Wiener多样性指数而言,9号样点最高,为2.54,其次为3号样点;就Simpson多样性指数而言,3号样点最高,其次为9号样点;就Pielou均匀度指数而言,3号样点最高,其次为11号样点;综上所述,3号样点水体酵母菌多样性较丰富且分布均匀,19号样点水体酵母菌多样性较单一且分布不均匀.6号样点为入湖河水与湖水的交汇处,位于天然沙砾堤与湖岸之间,由于天然砂砾堤的阻隔,该样点水体理化性质区别于其他样点,与其他样点迥异的理化因子是导致6号样点酵母菌总丰度高于其他样点的主要原因.3号样点位于扎西半岛,样点处鱼类资源丰富且有大量游客投食,丰富的水生生物及频繁的人为活动可能是该样点酵母菌多样性较为丰富且均匀的可能原因.19号样点位于村庄旁,人为活动也较多,但不同于3号样点的旅游活动,19号样点多为畜牧活动,并且区别于9号样点,19号样点的畜牧活动会对牛粪进行回收,猜测岸边人为活动方式的不同可能是造成3号、9号以及19号样点酵母菌多样性差异的主要原因.
2.2 纳木错夏季各样点水体理化因子分析

图6 纳木错各样点水体理化因子与可培养酵母菌多样性指数Pearson相关性系数
*表示在0.05水平显著相关(双侧); **表示在0.01水平显著相关(双侧)
为探究酵母菌多样性与水体理化因子之间的关系,测定了纳木错水体的8个理化因子数据.差异性分析显示,在纳木错各样点水体间,8个理化因子存在不同程度的差异.20个样点pH值的变化范围为8.72~9.66,其中12号样点显著高于其他样点(< 0.05),6号样点显著低于其他样点(<0.05);20个样点电导率范围为290.67~1901.67μs/cm,其中16号样点显著高于其他样点(<0.05),6号样点显著低于其他样点(<0.05);20个样点总溶解固体量范围为206.67~1346.67mg/L,其中16号样点显著高于其他样点(<0.05),6号样点显著低于其他样点(<0.05); 20个样点盐度范围为130~950mg/L,其中16号样点显著高于其他样点(<0.05),6号样点显著低于其他样点(<0.05);20个样点化学需氧量范围为2~15mg/ L,其中1号样点显著高于其他样点(<0.05),3号、6号以及17号样点显著低于其他样点(<0.05);20个样点氨氮范围为0.06~0.71mg/L,其中1号样点显著高于其他样点(<0.05),3号样点显著低于其他样点(<0.05); 20个样点总磷范围为0.005~0.05mg/L,其中1号样点显著高于其他样点(<0.05),6号样点显著低于其他样点(<0.05);20个样点总氮范围为0.15~0.97mg/L,其中1号样点显著高于其他样点(< 0.05),3号和8号样点显著低于其他样点(<0.05).根据地表水环境质量标准基本项目标准限值,各理化因子均显示纳木错水质为Ⅱ类水质,较为清洁.
纳木错水体理化因子间相关性分析结果表明(图6),化学需氧量、氨氮及总磷两两呈极显著正相关(<0.01),pH值与电导率、总溶解固体量、盐度呈极显著正相关(<0.01),与化学需氧量呈显著正相关(<0.05), 电导率、总溶解固体量、盐度三者两两呈极显著正相关(<0.01),且三者与氨氮呈极显著负相关(<0.01),与总氮呈显著负相关(<0.05);总氮与化学需氧量及氨氮呈极显著正相关(<0.01),与总磷呈显著正相关(<0.05).
2.3 纳木错夏季各样点水体理化因子与可培养酵母菌多样性指数间相关性分析
由图6可知.纳木错水体可培养酵母菌总丰度与pH值、电导率、总溶解固体量、盐度呈极显著负相关(<0.01),与总氮、氨氮呈显著正相关(<0.05);物种数、Shannon-Wiener多样性指数、Simpson多样性指数与总磷呈显著负相关(<0.05).综上所述,pH值、电导率、总溶解固体量、盐度、总氮、氨氮以及总磷是影响纳木错水体可培养酵母菌多样性的主要理化因子.
2.4 纳木错夏季水体可培养酵母菌群落排序
为更直观反映酵母菌群落结构与理化因子间的关系,采用CANOCO 5.0对二者进行排序.为确定合理的排序模型,先进行去趋势对应分析(DCA).去趋势对应分析结果显示第1轴的梯度长度值为2.7,因此选择冗余分析(RDA)进行排序.使用前向选择筛选对酵母菌群落结构影响显著的环境因子(<0.05)(图7),选出pH进行RDA分析(=2.6,= 0.008),RDA分析结果显示,第1排序轴对响应变量的解释度比例为12.8%,为避免冗杂,在排序图中,仅展现贡献度最高的15个酵母菌属(图7).
环境因子对酵母菌分布的影响在排序图中有较直观的展示,贡献度最高的15个酵母菌属中,、以及的分布与pH有密切联系,pH是影响纳木错各样点水体酵母菌群落结构最显著的环境因子.
郝兆等[38]研究认为,pH、电导率、总溶解固体量、盐度以及总磷是影响羊卓雍错水体酵母菌的主要理化因子;严亚萍等[32]通过对阳宗海水体酵母菌种群结构的研究认为,电导率是影响其水体酵母菌多样性的重要因素;董明华等[8]研究表明,pH和总磷分别对杞麓湖隐球酵母属和红冬孢酵母属的分布有重要影响.与以上研究结果相类似,本实验结果表明,纳木错水体可培养酵母菌α多样性主要受pH、电导率、总溶解固体量、盐度、总氮、总磷以及氨氮的显著影响,RDA分析结果显示,pH是影响纳木错水体可培养酵母菌的主要理化因子.在本研究中,pH、电导率、总溶解固体量以及盐度主要通过抑制酵母菌的总丰度来对酵母菌群落结构产生影响,总氮和氨氮通过增加酵母菌总丰度来对酵母菌群落结构产生影响,总磷则通过抑制酵母菌物种数以及酵母菌多样性来对酵母菌群落结构产生影响.电导率、总溶解固体量以及盐度对酵母菌的影响主要表现在对酵母菌细胞渗透压的影响上,高渗环境可能会导致酵母菌死亡、裂解或休眠,并且会影响酵母菌对环境中营养盐的摄取[48-49].酵母菌喜生活于偏酸性环境中,高pH值的环境会对酵母菌产生抑制作用[50].纳木错高盐偏碱性的水体环境对纳木错酵母菌形成选择压力,抑制了优势酵母菌种群的丰度,增加了酵母菌多样性,符合中度干扰假说[51].总氮、总磷和氨氮的作用则与pH相反,水体的富营养化促进了优势菌群的形成,优势菌群的形成增加酵母菌总丰度的同时降低了酵母菌多样性指数.纳木错水体酵母菌群落结构受水体pH、电导率、总溶解固体量以及盐度的抑制作用以及总氮、总磷以及氨氮的促进作用的共同控制.

图7 纳木错水体可培养酵母菌群落与理化因子RDA分析排序图
3 结论
3.1 从纳木错水体20个样点中共分离出1067株酵母菌,鉴定后分属于27个属45个种及2个潜在新分类单元,优势种为和..为纳木错水体广泛分布种.
3.2 NMDS及酵母菌多样性指数分析显示,纳木错不同区域水体可培养酵母菌群落β多样性差异明显,且水体酵母菌资源较为丰富.
3.3 Pearson相关性分析结果表明,酵母菌总丰度与pH、EC、TDS、Salt呈极显著负相关(<0.01),与TN、NH3-N呈显著正相关(<0.05);物种数、Shannon- Wiener多样性指数、Simpson多样性指数均与TP呈显著负相关(<0.05).冗余分析显示,pH是影响纳木错水体酵母菌种群分布的主要理化因子.
[1] 王苏民,窦鸿身.中国湖泊志 [M]. 北京:科学出版社, 1998.
Wang S M, Dou H S. Records of lakes in China [M]. Beijing: Science Press, 1998.
[2] Wetzel R G. Limnology: lake and river ecosystems [M]. Salt Lake City: Academic Press, 2001.
[3] Wang M, Liang J, Hu L. Distribution of GDGTs in lake surface sediments on the Tibetan Plateau and its influencing factors [J]. Sci China-Earth Sci, 2016,59:961-974.
[4] 陈兆进,丁传雨,朱静亚,等.丹江口水库枯水期浮游细菌群落组成及影响因素研究 [J]. 中国环境科学, 2017,37(1):336-344.
Chen Z J, Ding C Y, Zhu J Y, et al. Community structure and influencing factors of bacterioplankton during low water periods in Danjiangkou Reservoir [J]. China Environmental Science, 2017,37(1): 336-344.
[5] Allison S D, Martiny J B H. Resistance, resilience, and redundancy in microbial communities [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008,105(1):11512-11519.
[6] 吴庆龙,江和龙.中国湖泊微生物组研究 [J]. 中国科学院院刊, 2017,32(3):273-279.
Wu Q L, Jiang H L. China lake microbiome project [J]. Bulletin of Chinese Academy of Sciences, 2017,32(3):273-279.
[7] 李娜英,韩智勇,王双超,等.多污染源作用下填埋场地下水微生物群落分析 [J]. 中国环境科学, 2020,40(11):4900-4910.
Li N Y, Han Z Y, Wang S C, et al. Impacts of different pollution sources on the microbial community in groundwater at municipal solid waste landfill sites [J]. China Environmental Science, 2020,40(11): 4900-4910.
[8] 董明华,李治滢,周 斌,等.云南高原湖泊杞麓湖冬季可培养酵母菌多样性分析 [J]. 微生物学报, 2016,56(4):603-613.
Dong M H, Li Z Y, Zhou B, et al. Diversity of cultivable yeast in Qilu Lake in winter [J]. Acta Microbiologica Sinica, 2016,56(4):603-613.
[9] Medeiros A O, Missagia B S, Brandão L R, et al. Water quality and diversity of yeasts from tropical lakes and rivers from the Rio Doce basin in southeastern Brazil [J]. Brazilian Journal of Microbiology, 2012,43(4):1582-1594.
[10] 魏 伟,王 丽,周 平,等.安徽铜陵地区河流生态系统健康的多指标评价 [J]. 中国环境科学, 2013,33(4):691-699.
Wei W, Wang L, Zhou P, et al. Multi-variable assessment of river ecosystem health in Tongling of Anhui Province [J]. China Environmental Science, 2013,33(4):691-699.
[11] Hagler A N. Yeasts as indicator of environmental quality [M]. Berlin: Springer, 2006.
[12] Nagahama T. Yeast biodiversity in freshwater, marine and deep-sea environments [M]. Berlin: Springer, 2006.
[13] Brandão L R, Medeiros A O, Duarte M C, et al. Diversity and antifungal susceptibility of yeasts isolated by multiple-tube fermentation from three freshwater lakes in Brazil [J]. J. Water Health, 2010,8(2):279-289.
[14] Arvanitidou M, Kanellou K, Vagiona D G. Diversity ofspp. and fungi in northern Greek rivers and their correlation to fecal pollution indicators [J]. Environ. Res., 2005,99(2):278-284.
[15] de Almeida J M. Yeast community survey in the Tagus estuary [J]. FEMS Microbiol. Ecol., 2005,53(2):295-303.
[16] 李治滢,周新丽,周 斌,等.云南程海湖冬季酵母菌多样性及胞外酶活性研究 [J]. 菌物学报, 2017,36(2):177-185.
Li Z Y, Zhou X L, Zhou B, et al. Diversity and extracellular enzymes of yeasts from Chenghai Lake in winter [J]. Mycosystema, 2017,36(2): 177-185.
[17] 郭小芳,李治滢,董明华,等.云南高原湖泊抚仙湖酵母菌空间分布及其与环境因子的关系 [J]. 湖泊科学, 2016,28(2):358-369.
Guo X F, Li Z Y, Dong M H, et al. Spatial dynamics of yeast community and its relationship to environmental factors in Lake Fuxian, Yunnan Province [J]. Journal of Lake Sciences, 2016,28(2): 358-369.
[18] Russo G, Libkind D, Sampaio J P, et al. Yeast diversity in the acidic RioAgrio Lake Caviahue volcanic environment (Patagonia, Argentina) [J]. FEMS Microbiology Ecology, 2008,65:415-424.
[19] Brandão L R, Libkind D, Vaz A B, et al. Yeasts from an oligotrophic lake in Patagonia (Argentina): Diversity, distribution and synthesis of photoprotective compounds and extracellular enzymes [J]. FEMS Microbiology Ecology, 2011,76(1):1-13.
[20] Libkind D, Moliné M, Sampaio J P, et al. Yeasts from high-altitude: influence of UV radiation [J]. FEMS Microbiology Ecology, 2009, 69(3):353-362.
[21] 时 玉,孙怀博,刘勇勤,等.青藏高原淡水湖普莫雍错和盐水湖阿翁错湖底沉积物中细菌群落的垂直分布 [J]. 微生物学通报, 2014, 41(11):2379-2387.
Shi Y, Sun H B, Liu Y Q, et al. Vertical distribution of bacterial community in sediments of freshwater lake Puma Yumco and saline lake AWongco on the Tibetan Plateau [J]. Microbiology China, 2014, 41(11):2379-2387.
[22] 孙殿超,龚 平,王小萍,等.拉萨河全氟化合物的时空分布特征研究 [J]. 中国环境科学, 2018,38(11):4298-4306.
Sun D C, Dong P, Wang X P, et al. Special distribution and seasonal variation of perfluoroalkyls substances in Lhasa River Basin, China [J]. China Environmental Science, 2018,38(11):4298-4306.
[23] 万 玮,肖鹏峰,冯学智,等.卫星遥感监测近30年来青藏高原湖泊变化 [J]. 科学通报, 2014,59(8):701-714.
Wan W, Xiao P F, Feng X Z, et al. Monitoring lake changes of Qinghai-Tibetan Plateau over the past 30years using satellite remote sensing data [J]. Chin. Sci. Bull., 2014,59(8):701-714.
[24] 刘金波,孔维栋,王君波,等.纳木错湖水体固碳微生物数量、群落结构及其驱动因子 [J]. 生态学报, 2019,39(8):2772-2783.
Liu J B, Kong W D, Wang J B, et al. Abundance, community structure, and the driving factors of Carbon fixing microorganisms in the Nam Co Lake [J]. Acta Ecologica Sinica, 2019,39(8):2772-2783.
[25] 杜 娟,文莉娟,苏东生.青藏高原不同深度湖泊无冰期湖气温差及湖表辐射与能量平衡特征模拟分析 [J]. 高原气象, 2020,39(6): 1181-1194.
Du J, Wen L J, Su D S. Analysis of simulated temperature difference between lake surface and air and energy balance of three alpine lakes with different depths on the Qinghai-Xizang Plateau during the ice-free period [J]. Plateau Meteorology, 2020,39(6):1181-1194.
[26] 陈 飞,蔡强国,孙莉英.青藏高原纳木错流域冰雪融水径流量估算 [J]. 中国水土保持科学, 2016,14(2):127-136.
Chen F, Cai G Q, Sun L Y. Estimation of meltwater runoff from glaciers and snow cover in Nam Co basin, Tibetan Plateau [J]. Science of Soil and Water Conservation, 2016,14(2):127-136.
[27] 王永胜,孙继彬,王 彦,等.西藏纳木错西岸班戈县新吉乡早白垩世的石珊瑚 [J]. 古生物学报, 2020,59(4):452-466.
Wang Y S, Sun J B, Wang Y, et al. Early Cretaceous scleractinian corals from Xenkyer, Baingoin, Tibet [J]. Acta Palaeontologica Sinica, 2020,59(4):452-466.
[28] 刘晓波,康世昌,刘勇勤,等.青藏高原纳木错湖细菌群落特征及其与高山湖泊的对比 [J]. 冰川冻土, 2008,30(6):1041-1047.
Liu X B, Kang S C, Liu Y Q, et al. Microbial community structures in the Nam Co Lake, Tibetan Plateau, and comparison with other alpine lakes [J]. Journal of Glaciology and Geocryology, 2008,30(6):1041- 1047.
[29] 陆美美,周石硚,何 霞.青藏高原湖泊蒸发估算方法的比较研究——以纳木错为例 [J]. 冰川冻土, 2017,39(2):281-291.
Lu M M, Zhou S Q, He X. A comparison of the ormulas for estimation of the lake evaporation on the Tibetan Plateau: Taking Lake Nam Co as an example [J]. Journal of Glaciology and Geocryology, 2017, 39(2):281-291.
[30] 黄 磊,王君波,朱立平,等.纳木错水温变化及热力学分层特征初步研究 [J]. 湖泊科学, 2015,27(4):711-718.
Huang L, Wang J B, Zhu L P, et al. Water temperature and characteristics of thermal stratification in Nam Co, Tibet [J]. Journal of Lake Sciences, 2015,27(4):711-718.
[31] 王君波,朱立平,Gerhard Daut,等.西藏纳木错水深分布及现代湖沼学特征初步分析 [J]. 湖泊科学, 2009,21(1):128-134.
Wang J P, Zhu L P, Daut G, et al. Bathymetric survey and modern limnological parameters of Nam Co, central Tibet [J]. Journal of Lake Sciences, 2009,21(1):128-134.
[32] 严亚萍,李治滢,董明华,等.云南阳宗海酵母菌种群结构及产胞外酶测试 [J]. 微生物学报, 2013,53(11):1205-1212.
Yan Y P, Li Z Y, Dong M H, et al. Yeasts from Yangzonghai Lake in Yunnan (China): Diversity and extracellular enzymes [J]. Acta Microbiologica Sinica, 2013,53(11):1205-1212.
[33] 孙立夫,张艳华,裴克全.一种高效提取真菌总DNA的方法 [J]. 菌物学报, 2009,28(2):299-302.
Sun L F, Zhang Y H, Pei K Q. A rapid extraction of genomic DNA from fungi [J]. Mycosystema, 2009,28(2):299-302.
[34] White T J, Bruns T D, Lee S B, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics//PCR Protocols: A Guide to Methods and Applications [M]. San Diego: Academic Press, 1990:315-322.
[35] Kurtzman C P, Robnett C J. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit(26S) ribosomal DNA partial sequences [J]. Antonie Van Leeuwenhoek, 1998,73(4):331-371.
[36] 罗正明,刘晋仙,暴家兵,等.五台山亚高山土壤真菌海拔分布格局与构建机制 [J]. 生态学报, 2020,40(19):7009-7017.
Luo Z M, Liu J X, Bao J B, et al. Elevational distribution patterns and assembly mechanisms of soil fungal community in Mount Wutai, Shanxi, China [J]. Acta Ecologica Sinica, 2020,40(19):7009-7017.
[37] 白 梅,侯强川,孙志宏,等.健康蒙古族人肠道中乳酸菌和双歧杆菌多样性 [J]. 微生物学通报, 2019,46(10):2697-2709.
Bai M, Hou Q C, Sun Z H, et al. Diversity of lactic acid bacteria and Bifidobacterium in the intestine of healthy Mongolians [J]. Microbiology China, 2019,46(10):2697-2709.
[38] 郝 兆,王艳红,郑艳艳,等.羊卓雍措水体可培养酵母菌多样性及其与理化因子相关性 [J]. 微生物学报, 2021,61(5):1269-1286.
Hao Z, Wang Y H, Zheng Y Y, et al. Analysis on culturable yeast diversity and its relationship with environmental factors in Yamzhog Yumco Lake [J]. Acta Microbiologica Sinica, 2021,61(5):1269-1286.
[39] 李治滢,樊竹青,董明华,等.云南星云湖酵母菌多样性及产类胡萝卜素的评价 [J]. 微生物学通报, 2019,46(6):1309-1319.
Li Z Y, Fan Z Q, Dong M H, et al. Diversity and evaluation of carotenoids-producing of yeasts isolated from Xingyun Lake [J]. Microbiology China, 2019,46(6):1309-1319.
[40] 方德新,吉芳英,许晓毅,等.高原高寒污水处理系统的微生物群落特征 [J]. 中国环境科学, 2020,40(3):1081-1088.
Fang D X, Ji F Y, Xu X Y, et al. Microbial community characteristics of wastewater treatment systems in high-altitude and cold regions [J]. China Environmental Science, 2020,40(3):1081-1088.
[41] 张瑞蕊,薛 梅,李宁宁,等.天山一号冰川表面冰尘和底部沉积层中可培养酵母菌系统发育类群的分布及生态生理特征 [J]. 微生物学报, 2019,59(2):334-348.
Zhang R R, Xue M, Li N N, et al. Phylogeny and diversity of culturable yeasts in supraglacial cryoconite and subglacial sediments of the Glacier No.1in Tianshan Mountains [J]. Acta Microbiologica Sinica, 2019,59(2):334-348.
[42] Virginia D G, Polona Z, Silvia B, et al. Cryptococcus species (Tremellales) from glacial biomes in the southern (Patagonia) and northern (Svalbard) hemispheres [J]. FEMS Microbiology Ecology, 2012,(2):523-539.
[43] Białkowska A M, Szulczewska K M, Krysiak J, et al. Genetic and biochemical characterization of yeasts isolated from Antarctic soil samples [J]. Polar Biology, 2017,40(9):1787-1803.
[44] Sannino C, Tasselli G, Filippucci S, et al. Yeasts in nonpolar cold habitats [M]. Berlin: Springer, 2017.
[45] de García V, Brizzio S, Libkind D, et al. Biodiversity of cold-adapted yeasts from glacial meltwater rivers in Patagonia, Argentina [J]. FEMS Microbiol Ecol, 2007,59(2):331-341.
[46] Brandão L R, Libkind D, Vaz A B, et al. Yeasts from an oligotrophic lake in Patagonia (Argentina): diversity, distribution and synthesis of photoprotective compounds and extracellular enzymes [J]. FEMS Microbiol Ecol, 2011,76(1):1-13.
[47] 游庆龙,康世昌,李潮流,等.青藏高原纳木错气象要素变化特征 [J]. 气象, 2007,33(3):54-60.
Yong Q L, Kang S C, Li C L, et al. Variation features of meteorological elements at Namco station, Tibetan Plateau [J]. Meteorological Monthly, 2007,33(3):54-60.
[48] 王建辉,游庆国,申 渝,等.短程反硝化-厌氧氨氧化耦合脱氮工艺影响因素与调控研究进展 [J]. 环境化学, 2021,40(4):1216-1231.
Wang J H, You Q G, Shen Y, et al. Research advances on influence factors and regulation of Partial denitrification and Anammox coupling denitrification process [J]. Environmental Chemistry, 2021,40(4): 1216-1231.
[49] 杨文焕,杜 璇,姚 植,等.基于VAR模型的乌梁素海富营养化影响因子评价 [J]. 环境科学与技术, 2021,44(2):25-32.
Yang W H, Du X, Yao Z, et al. Evaluation of the Influencing Factors of Wuliangsuhai Eutrophication Based on VAR Model [J]. Environmental Science & Technology, 2021,44(2):25-32.
[50] 孙万儒.酵母菌 [J]. 生物学通报, 2007,42(11):5-10.
Sun W R. Yeast [J]. Bulletin of Biology, 2007,42(11):5-10.
[51] Connell J H, Slatyer R O. Mechanisms of succession in natural communities and their role in community stability and organization [J]. American Naturalist, 1977,111(982):1119-1144.
Analysis on yeast diversity and the influencing factors during summertime in Nam Co Lake.
WANG Yan-hong, HAO Zhao, GUO Xiao-fang*, De-ji**
(School of Science, Tibet University, Lhasa 850000, China)., 2021,41(11):5361~5371
Yeasts were isolated by membrane filtration flat culture from Nam Co Lake. Identifications of the yeasts were based on sequence analysis of the ITS region, combined with traditional classification method. Moreover, bioinformatical and statistical methods were used to determine the correlationships between diversity of culturable yeast and environmental factors. The result showed that a total of 1067 yeast isolates were identified, belonging to 27 genera and 45 species, and including two previously undescribed taxa. Among them,andwere the dominated species. Furthermore, NMDS analysis showed that the β diversity of the culturable yeast communities in different sites of Nam Co Lake was significantly different. Statistical analysis indicated that the richness of culturable yeast were negatively correlated to lake pH, electric conductivity (EC), and total dissolved salt (TDS). Meanwhile, the richness was positively correlated to total nitrogen (TN) and ammonia nitrogen (NH3-N). Additionally, the number of yeast species, Shannon-Wiener index, and Simpson index were negatively correlated to total phosphorus (TP). Interestingly, pH played a crucial role in the formation of yest community structures in Nam Co Lake. As a whole, the yeast community in Nam Co Lake showed high species richness, and the community structures differed in different sites, influenced by a variety of environmental factors.
plateau lake;Nam Co Lake;yeast;diversity;environmental factors
X172
A
1000-6923(2021)11-5361-11
王艳红(1994-),女,河南郑州人,西藏大学硕士研究生,主要从事微生物生态学研究.
2021-04-02
国家自然科学基金资助项目(31960024);2019年中央支持地方高校改革发展基金(藏财预指[2019]01号)
*责任作者, 教授, gxf005@Hotmail.com;**高级实验师, dg971103@163.com
