盐胁迫对不同区域野生枸杞种子萌发的影响
2021-12-01任小燕柳迪潘平新马彦军
任小燕,柳迪,潘平新,马彦军
(甘肃农业大学林学院,甘肃 兰州 730070)
在全球范围内,土壤盐渍化是最严重的自然灾害之一。我国盐渍土面积约3 460万hm2,耕地盐碱化面积760万hm2,近1/5耕地发生盐碱化,其中原生盐化型、次生盐化型和各种碱化型分布分别占总面积的52%、40%和8%[1]。在北方干旱、半干旱地区,降水不足、淋溶作用弱、地下水蒸发和蒸腾强烈以及降水会造成土壤中盐分升高,出现盐渍化或次生盐渍化[2]现象。研究表明,种植耐盐碱植物可以降低土壤盐渍化对植物生长产生的不利影响[3]。
枸杞(Lyciumbarbarum)为茄科(Solanaceae)枸杞属(Lycium)植物,枝细长,叶卵形或卵状披针形,花淡紫色,浆果红色,种子肾形黄色,8-10月成熟。其果实有滋肝补肾、生精益气、治虚安神,祛风明目的功效,对治慢性肝炎、糖尿病、肺结核也有一定疗效。此外,枸杞枝叶煮水治棉蚜效果显著。目前, 关于枸杞的研究主要着重于其药用价值[4-8],对其耐盐性研究较少。本文旨在通过研究不同浓度的两种盐(NaCl、NaHCO3)对3个区域野生枸杞种子萌发的影响,筛选出耐盐碱区域种子,为枸杞在盐碱地种植提供参考依据。
1 材料与方法
1.1 试验材料
2019年9月在甘肃定西、临夏、兰州采集野生枸杞果实,用自封袋标记带回实验室,采用水选法清除果皮、果肉及瘪种等杂质,种子洗净,自然阴干,置-18℃冰箱备用。试验于2020年6月5日在甘肃农业大学林学院人工气候室进行,材料来源见表1。
1.2 试验方法
1.2.1 基质处理 本试验以蛭石为基质,清洗干净后,用立式高压灭菌锅(121℃)灭菌30 min,自然晾干,平铺于18.4 cm×11.3 cm×5.8 cm发芽盒,蛭石3 cm厚,备用。
1.2.2 种子处理 取颗粒饱满、大小基本一致净种,置于烧杯,温水浸泡24 h,经84消毒液消毒5 min,取出种子用无菌水洗净,吸水纸吸干水分。
1.2.3 盐处理 将备好的种子均匀点播于发芽盒中,每个处理播50粒,重复3次,设置NaCl、NaHCO3浓度分别为50、100、150、200、250、300 mmol/L,以蒸馏水处理为对照(CK),用等量不同类溶液将发芽盒浇透,在人工气候箱(温度25℃,湿度75%,前2 d暗光,第3 d开始12 h/d光照)进行萌发观测,以肉眼看到种子发芽为标准,每天定时记录一次发芽数,重复中若有一粒种子发芽即为该处理的起始发芽时间,连续3 d累计发芽数不再增加时方可认为萌发试验结束。
1.3 指标测定
1.3.1 种子大小 随机抽取不同区域种子20粒粘贴于坐标纸上,重复3次,用EPSAN EXPRESSION 10000XL型扫描仪扫描,Auto CAD 2007(主菜单插入-光栅图像参照-左菜单多段线)制图软件进行种子纵横径(种子最大部位)及面积测定,求均值。
1.3.2 种子千粒重 随机抽取各区域净种1 000粒,天平称重,重复3次,求均值。
1.3.3 种子吸水特性 称取各区域种子0.4 g,室温浸种,隔2 h取出,吸水纸去除多余水分并称重[9],直至浸种24 h,重复3次,求均值并绘制种子吸水速率图。指标计算参照文献[10]:
吸水速率(g/h)=种子吸水量/种子吸水时间
式中,种子吸水量为两次测量的种子质量的差值,种子吸水时间为2 h。
1.3.4 种子萌发指标 各指标计算参照文献[11]。
起始发芽时间(d):以肉眼看到种子发芽时所经历的时间。
发芽率(Gp)=n/N×100%;
相对发芽率(RGp)=处理发芽率/对照发芽率×100%
式中,n为发芽种子数,N为供试种子总数。
发芽势(Ge)=n/N×100%;
相对发芽势(RGe)=处理发芽势/对照发芽势×100%;
式中n为发芽高峰时(12 d)累计发芽种子数,N为供试种子总数。
发芽指数(Gi)=Σ(Gt/Dt);
相对发芽指数(RGi)=处理发芽指数/对照发芽指数×100%;
式中Gt为t天的发芽数,Dt为发芽天数。
活力指数(VI)=发芽指数(Gi)×幼苗鲜重(W);
相对活力指数(RVI)=处理活力指数/对照活力指数×100%;
相对盐害率(Rsi)=(对照发芽率-处理发芽率)/对照发芽率×100%。
1.4 耐盐性评价
以相对发芽率Y为因变量,盐浓度X为自变量进行回归分析确定其耐盐性。指标计算参照文献[2]:
耐盐适宜浓度:相对发芽率≥75%时的盐溶液浓度
耐盐半致死浓度:相对发芽率≥50%时的盐溶液浓度
耐盐极限浓度:相对发芽率≤10%时的盐溶液浓度
1.5 数据处理:
利用Microsoft Excel进行数据处理及图表转化;SPSS 21软件进行差异显著性(P<0.05)、相关性及回归性分析。
2 结果与分析
2.1 枸杞种子形态、大小及千粒重
3个区域中,兰州区域种子特征的各指标均最大,除种子长与定西区域差异不显著(P>0.05)外,其他3项指标皆与2个区域差异显著(P<0.05)(表2)。据此可将兰州、定西、临夏区域种子大小分为大、中、小3类。

表2 种子特征
2.2 枸杞种子吸水特性分析
3个区域种子吸水速率在浸种2 h时达到最大,此时定西、兰州、临夏区域种子吸水速率分别为0.142 4、0.140 3、0.131 9 g/h,之后随浸种时间的延长可将种子吸水分为3个阶段,0~2 h为快速吸水阶段;2~4 h为中速吸水阶段;4~24 h吸水基本稳定,为饱和吸水阶段(图1)。

图1 种子吸水速率Fig.1 Water absorption speed
2.3 盐胁迫对枸杞种子萌发特性的影响
2.3.1 盐胁迫对枸杞种子起始发芽时间的影响 种子起始发芽时间随盐浓度增加而推迟(表3)。其中NaCl处理下,盐浓度为300 mmol/L时定西与临夏区域种子未发芽。定西区域种子起始发芽时间从150 mmol/L开始显著推迟(P<0.05),兰州、临夏区域种子起始发芽时间从200 mmol/L时开始显著推迟(P<0.05);NaHCO3处理下,盐浓度为300 mmol/L时3个区域的种子皆未发芽,另外250 mmol/L时定西区域的种子也未发芽。定西、临夏区域种子起始发芽时间从150 mmol/L开始显著推迟(P<0.05),兰州区域种子起始发芽时间从200 mmol/L时开始显著推迟(P<0.05)。

表3 盐胁迫下种子的起始发芽时间
2.3.2 盐胁迫对枸杞种子发芽率、相对发芽率的影响 各区域种子发芽率和相对发芽率随盐浓度升高呈降低趋势,降低幅度最小的是定西区域种子(图2,图3)。与对照相比,不同浓度NaCl处理下的种子发芽率均显著降低(P<0.05),分别降低了20.00%、37.33%、43.33%、44.66%、54.00%(图2-A);相对发芽率从100 mmol/L浓度时开始显著降低(P<0.05),100~250 mmol/L 4个NaCl处理分别降低了55.00%、64.00%、66.00%、80.33%(图2-B)。在NaHCO3处理下,与对照相比,种子发芽率、相对发芽率分别从100、150 mmol/L时开始显著降低(P<0.05),发芽率在100、150、200 mmol/L时分别降低了20.00%、51.33%、63.33%(图3-A),相对发芽率在150、200 mmol/L时分别降低了77.00%、96.33%(图3-B)。

图2 NaCl胁迫下的种子发芽率、相对发芽率Fig.2 Effects of NaCl stress on seed germination rate and relative germination rate注:图中不同小写字母表示差异显著(P<0.05),下同

图3 NaHCO3胁迫下的种子发芽率、相对发芽率Fig.3 Effects of NaHCO3 stress on germination rate and relative germination rate
2.3.3 盐胁迫对枸杞种子发芽势、相对发芽势的影响 种子发芽势和相对发芽势均随盐浓度的上升而下降,且盐浓度越大下降的幅度越大,下降最少的是定西区域种子(图4、图5)。与对照相比, 不同浓度NaCl处理下,发芽势分别下降了12.00%、24.66%、25.33%、28.66%、31.33%(图4-A),相对发芽势分别下降了36.00%、72.33%、76.00%、86.00%、94.33%(图4-B);NaHCO3处理下,当盐浓度为50、100、150、200 mmol/L时,发芽势分别下降了0.66%、14.66%、28.00%、32.66%(图5-A),相对发芽势在50 mmol/L时上升了0.67%,在100、150、200 mmol/L时分别下降了41.33%、83.00%、97.67%(图5-B)。
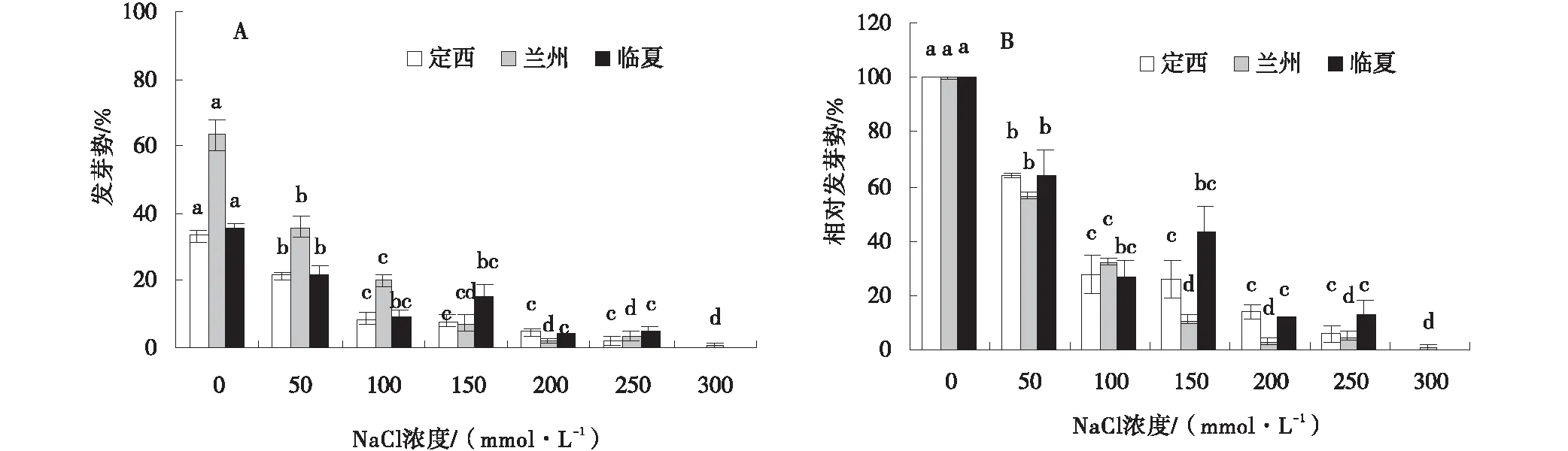
图4 NaCl胁迫下的种子发芽势、相对发芽势Fig.4 Effects of NaCl stress on seed germination potential and relative germination potential

图5 NaHCO3胁迫下种子的发芽势、相对发芽势Fig.5 Effects of NaHCO3 stress on seed germination potential and relative germination potential
2.3.4 盐胁迫对枸杞种子发芽指数、相对发芽指数的影响 随着盐浓度增大,种子发芽指数和相对发芽指数呈现减小的趋势,变化大小顺序为临夏>兰州>定西(图6、图7)。与对照相比,在NaCl处理下,3个区域种子发芽指数(图6-A)、相对发芽指数(图6-B)均从50 mmol/L开始显著减小(P<0.05);在NaHCO3处理下,该指数分别从100、150 mmol/L盐浓度时开始显著减小(P<0.05)(图7-A、7-B)。

图6 NaCl胁迫下的种子的发芽指数、相对发芽指数Fig.6 Effects of NaCl stress on seed germination index and relative germination index

图7 NaHCO3胁迫下的种子发芽指数、相对发芽指数Fig.7 Effects of NaHCO3 stress on seed germination index and relative germination index
2.3.5 盐胁迫对枸杞种子活力指数、相对活力指数的影响 各区域种子活力指数、相对活力指数均在对照时最大(图8、图9)。在NaCl处理中,与对照相比,种子活力指数和相对活力指数分别从100、150 mmol/L时开始下降显著(P<0.05),当盐浓度为100、150、200、250、300 mmol/L时,定西区域种子活力指数分别下降了22.53%、33.87%、35.08%、38.62%,兰州区域种子活力指数分别下降了52.8%、75.91%、99.61%、92.88%、102.77%,临夏区域种子活力指数分别下降了24.93%,30.46%、49.37%、47.84%(图8-A)。当盐浓度为150、200、250、300 mmol/L时,定西区域种子相对活力指数分别下降了69.67%、75.00%、83.33%,兰州区域种子相对活力指数分别下降了72.33%、93.33%、88.33%、96.00%,临夏区域种子相对活力指数分别下降了54.33%、80.00%、80.00%(图8-B);NaHCO3处理中,与对照相比,定西、兰州、临夏3个区域种子活力指数、相对活力指数均从150 mmol/L时开始显著下降(P<0.05),各区域种子活力指数分别下降了38.75%、93.67%、56.62%(图9-A),相对活力指数分别下降了83.33%,86.33%、94.00%(图9-B)。
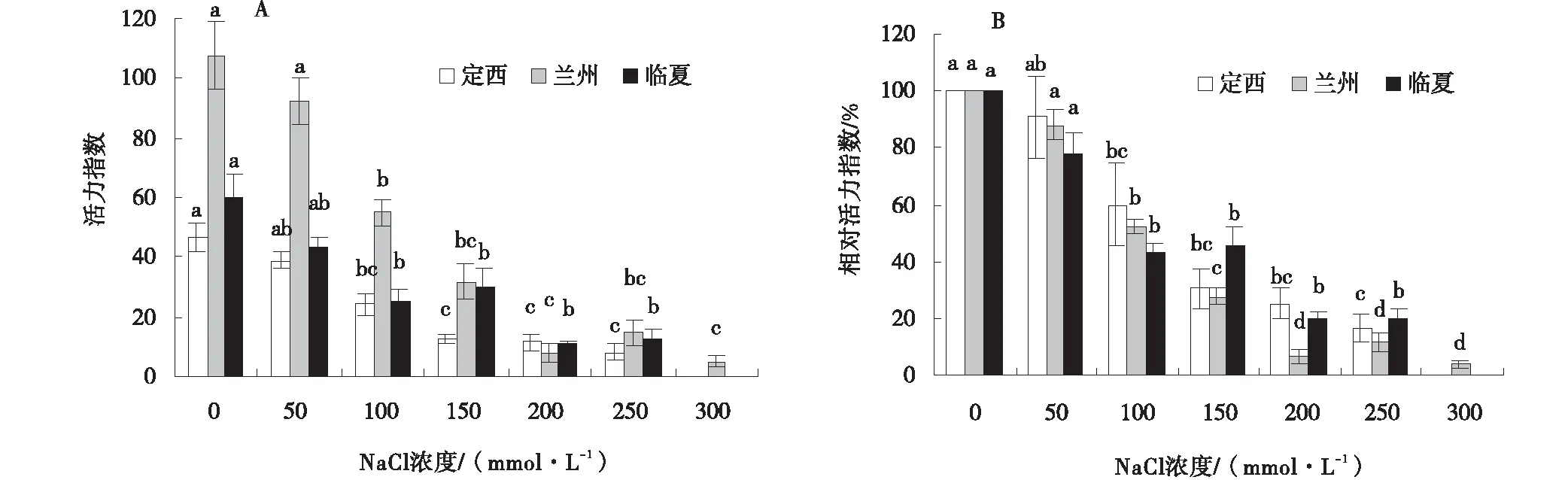
图8 NaCl胁迫下的种子活力指数、相对活力指数Fig.8 Effects of NaCl stress on seed vigor index and relative vigor index

图9 NaHCO3胁迫下的种子活力指数、相对活力指数Fig.9 Effects of NaHCO3 stress on seed vigor index and relative vigor index
2.3.6 盐胁迫对枸杞相对盐害率的影响 各区域种子的相对盐害率随盐胁迫的加剧逐渐增大,受影响最小的是定西区域种子(图10)。与对照相比,不同浓度NaCl处理下分别增大了39.33%、55.00%、64.33%、66.33%、80.33%(图10-A);NaHCO3处理下分别增大6.33%、27.33%、77.00%、96.33%(图10-B)。

图10 两种盐胁迫下的种子相对盐害率Fig.10 Effects of two salt stresses on the relative salt damage rate of seeds
2.4 耐盐性评价
3个区域种子对盐的耐受性大小为定西>兰州>临夏,两种盐的伤害程度NaHCO3>NaCl(表4、表5)。

表4 NaCl胁迫下种子萌发阶段耐盐性分析

表5 NaHCO3胁迫下种子萌发阶段耐盐性分析
3 讨论
3.1 枸杞种子形态、大小及千粒重
大粒种子可以贮藏更多的物质,能为种子萌发提供充足的营养物质和能量,保证幼苗能够有充足的资源,最大可能用于生长,尽量争夺和占据空间,在种间竞争中处于优势[12]。本研究所采集3个区域枸杞种子中,兰州种子长、宽、面积、千粒重最大。各区域间种子形态、大小、千粒重有所差异,这可能跟种子遗传特性与生长环境有关。
3.2 枸杞种子吸水特性分析
种子萌发的第一步是吸水,种子吸水吸胀后不仅可以软化种皮,增强透性使供氧充足,而且水分也是营养物质分解转移的必要前提[13]。本研究发现枸杞种子饱和吸水阶段从浸种4 h开始,这与张沛[9]的研究结果基本一致,前人研究的黑果枸杞吸水性饱和阶段从浸种8 h开始,原因可能与种子种皮的硬度有关。不同区域间种子吸水有所不同,这可能与种子的形态学特征及自身遗传特性有关[9]。
3.3 盐胁迫对枸杞种子萌发特性的影响
种子萌发是种子从相对静止的状态吸水活化转变为生理代谢旺盛的生长发育阶段,整个过程需要适宜的温度、水分和充足的空气,干旱和盐胁迫会引起种子渗透势发生改变,无法正常吸水,从而影响种子萌发过程[14]。种子的发芽率、发芽势、发芽指数和活力指数是衡量和评价种子发芽水平的常用指标[15],发芽率是衡量种子质量好坏的重要指标,可以显示种子胚的活性[16],发芽势和发芽指数反映了种子的发芽快慢和整齐程度[17],种子活力是评价植物耐盐性的重要指标之一[18]。本研究显示,种子发芽率、发芽势、发芽指数、活力指数与刘克彪等[19-21]的研究一致,相对发芽率、相对发芽势、相对发芽指数、相对活力指数与任永霞[2]的研究一致,即随盐浓度的升高呈降低趋势。但在NaCl处理下,起始发芽时间与张涛[14]的研究不一致,前人认为种子的起始发芽时间不受盐胁迫的影响,而本试验得出盐胁迫会使种子的起始发芽时间推迟;在NaHCO3处理下发芽率与杨志江[20]的结果相似,差异在于前人的研究中低浓度(5~10 mmol/L)的盐胁迫使种子发芽率上升之后便随着NaHCO3浓度增大开始下降。
3.4 耐盐性评价
植物最重要的繁殖器官是种子,因此植物种子在萌发阶段的耐盐状况可以反映该物种的耐盐性[11]。为进一步证明3个区域的耐盐性,通过相对发芽率与盐浓度进行回归分析,得知定西区域的耐盐适宜浓度、半致死浓度、极限浓度最高,NaCl浓度分别为45.98、129.04、261.93 mmol/L;NaHCO3浓度分别为68.44、116.06、192.25 mmol/L,此结果与萌发指标的反映相吻合,表明该区域更耐盐。虽然各区域在NaCl处理下的耐盐适宜浓度低于NaHCO3处理,但耐盐半致死及极限浓度高于NaHCO3,说明NaCl对3个区域的胁迫作用较弱。
4 结论
1) 兰州区域种子纵横径、面积及千粒重最大,临夏区域种子各指标最小;
2) 定西区域种子吸水率、吸水速率均最高,同时期内临夏源种子吸水最低;
3) 不同区域的种子对盐的耐受度为NaCl>NaHCO3。
4) 通过两种盐对不同区域枸杞种子萌发进行胁迫,以及回归分析表明定西区域种子在本试验的3个区域中耐盐碱性最强。
